Chemistry and Chemists № 2 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 2 2025 Journal of Chemists-Enthusiasts |
Crystallization of Supercooled Acetic Acid: Metamorphoses of Experiment - pt.1, 2 Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Introduction: Acetic Acid, Water, and Cold - Part 1
I first encountered acetic acid in my childhood. When I became interested in chemistry in the fifth grade, I faced a problem: many chemical reagents were unavailable. Some substances were sold in pharmacies, some in grocery stores, and some could be bought in hardware stores. However, most of the substances needed to repeat the chemical experiments described in books were unavailable there.
Кристаллизация переохлажденной уксусной кислоты: метаморфозы эксперимента Вступление: уксусная кислота, вода и холод - часть 1 Furthermore, some necessary substances were available for sale, but I didn't know where to find them. There was no Internet at that time and there were no chemists around me, but sometimes knowledgeable people helped. For example, I was very grateful to my physics teacher, who casually mentioned in class that the electrolyte for lead batteries is sulfuric acid and that it is freely sold in stores. Vinegar was one of the few chemical reagents available to me that I could experiment with. Unfortunately, vinegar is a highly diluted solution of acetic acid, typically at a concentration of 6% or 9%. This acid did not appear to react with metallic zinc: no hydrogen bubbles were observed. At the time, a 70% acetic acid solution (''acetic essence'') was occasionally available in grocery stores, but not in my city. Ordering goods by mail was rarely practiced then. A few years later, I figured out how to increase the acid concentration in vinegar using anhydrous copper sulfate. The resulting solution released hydrogen, reacting with metallic zinc. The reaction was additionally accelerated by the presence of copper ions in the solution. Later, my father traveled to another city and bought me a 100 ml bottle of 70% acetic acid, for which I was very grateful. I used the acid for experiments, spending it sparingly. I became acquainted with pure acetic acid when I was in graduate school. In our lab, there was a 20-liter bottle filled 2/3 with acetic acid. Although the lab wasn't particularly cold, half of the acid froze during the winter. Solid acetic acid closely resembles ice, which is why pure acetic acid is often called ''glacial acetic acid''. The freezing point of acetic acid is 16.6°C, so it is not surprising that the acid in the bottle partially solidified. Despite their similar appearance, solid acetic acid differs significantly from frozen water. Water expands when it freezes, as a result of which ice floats on the surface of liquid water since its density is lower than the density of water. Like most liquids, acetic acid contracts when it freezes. As a result, solid acetic acid is denser than its liquid form, causing the solid to sink while the liquid remains on top. This property of acetic acid played a cruel joke on my neighbor. When he poured acid from this bottle, the neighbor had to tilt the vessel upside down. As a result, its bottom ended up on top. At first, nothing bad happened, the neighbor began pouring acid into the glass. However, the solid acetic acid suddenly detached from the bottom and moved downward toward the neck, pushing the liquid out like a piston. As a result, the colleague got doused with the acid. Fortunately, there were no consequences. The next time I encountered glacial acetic acid was in the galvanic shop laboratory [1]. It was also winter. The bottle contained liquid acid without any signs of crystallization. The room temperature was 12°C. I opened the bottle and tried to draw the acid into the pipette, but I failed. The pipette tip was clogged with something solid. It turned out that the acetic acid had begun to crystallize. Soon all the acid in the bottle became solid. My colleagues informed me that glacial acetic acid is prone to supercooling. It can cool below the freezing point while remaining liquid. The supercooled acid often freezes unexpectedly when poured from one vessel to another. However, if left undisturbed, supercooled acetic acid can remain liquid for a long time. A colleague recently mentioned that the heating in their lab had been turned off, making the room cold. A 20-liter canister of glacial acetic acid stood in the room, remaining liquid. When his colleague picked up the canister and began pouring the acid, he was able to pour out only half before the acid suddenly froze. I recalled finding a PET bottle containing acetic acid in the lab during the summer. The neck of the colorless bottle had turned opaque due to exposure to acetic acid vapors. Its concentration was unknown - it could have been glacial acetic acid or a highly concentrated aqueous solution. I poured the acid into a glass bottle and left it until winter. In winter, this lab is not heated; the temperature in it is only a few degrees above zero. If acetic acid freezes, it is glacial acetic acid. If it remains liquid, acetic acid contains water. Acetic acid forms a eutectic mixture with water, crystallizing at -26.5°C [2]. Gradually adding water to glacial acetic acid lowers its freezing point until it reaches -26.5°C at an acid concentration of approximately 60% by weight. Beyond this point, increasing the water content raises the freezing temperature of the solution. 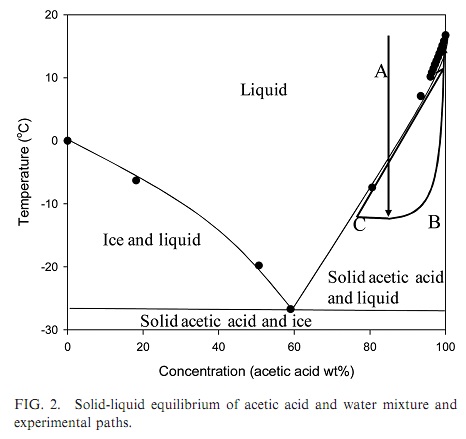 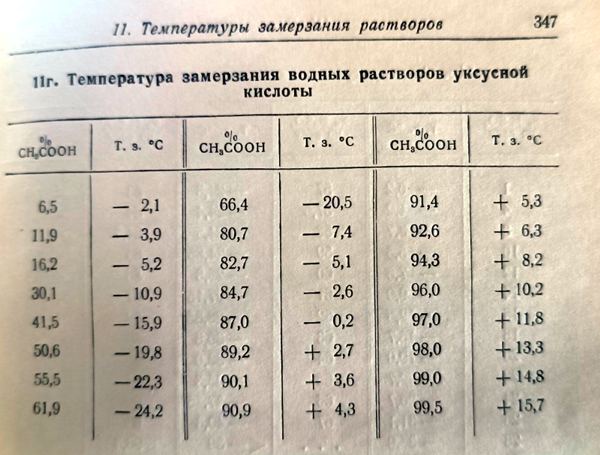 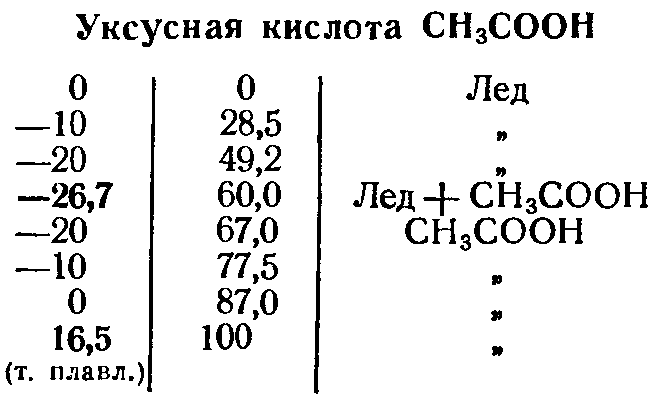
Unlike the other substances mentioned, the relationship between the density of an acetic acid solution and its concentration is non-monotonic. As the acetic acid concentration increases, the solution's density initially rises, reaches a peak, and then decreases. This means that two different concentrations of acetic acid can correspond to the same density. 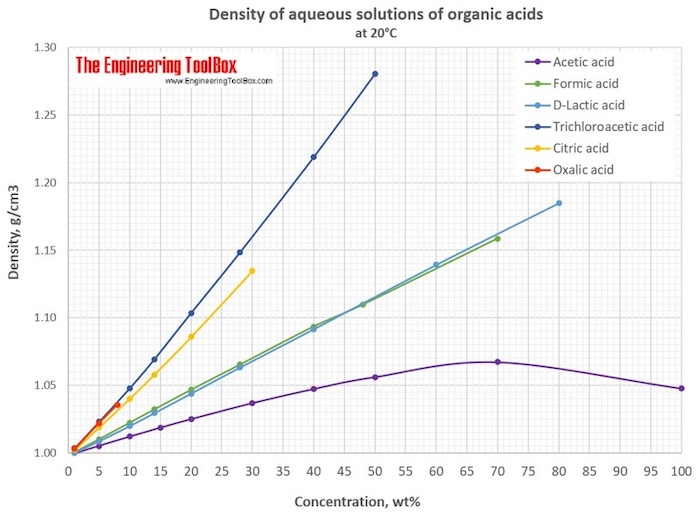
https://www.engineeringtoolbox.com/density-aqueous-solution-formic-lactic-oxalic-acetic-citric-acid-concentration-d_1953.html __________________________________________________ 1 See the article Crystallization of supercooled acetic acid / Кристаллизация переохлажденной уксусной кислоты [link]. 2 See the article Choi, W. S., & Kim, K. J. (2013). Separation of Acetic Acid from Acetic Acid-Water Mixture by Crystallization. Separation Science and Technology, 48(7), 1056-1061. [link]. |
|
Кристаллизация переохлажденной уксусной кислоты: метаморфозы эксперимента
С уксусной кислотой я познакомился в детстве. Увлекшись химией в пятом классе, я столкнулся с проблемой: многие химические реактивы оказались недоступны. Некоторые вещества продавались в аптеке, некоторые - в продуктовых магазинах, некоторые можно было купить в хозяйственных магазинах. Однако большинство веществ, необходимых, чтобы повторить химические эксперименты, описанные в книгах, там отсутствовали.
Вступление: уксусная кислота, вода и холод - часть 1 Более того, некоторые нужные вещества были в продаже, но я не знал, где их искать. Интернета в те времена не было, химиков в моем окружении тоже не было, зато иногда помогали знающие люди. Например, я был очень благодарен нашему учителю физики, который на уроке вскользь упомянул, что электролит для свинцовых аккумуляторов это серная кислота, и он свободно продается в магазине. Уксус был одним из немногих доступных мне химических реактивов, с которыми я мог проводить эксперименты. К сожалению, уксус представляет собой слишком разбавленный раствор уксусной кислоты (концентрация обычно составляла 6 или 9%). Такая кислота не реагировала с металлическим цинком с заметной скоростью: образование пузырьков водорода не наблюдалось. В те времена в продуктовых магазинах иногда продавался также 70% раствор уксусной кислоты ("уксусная эссенция"), но не в моем городе. Заказ товаров почтой тогда почти не практиковался. Через несколько лет я догадался повысить концентрацию кислоты в уксусе с помощью безводного сульфата меди. Полученный раствор выделял водород, реагируя с металлическим цинком. Реакция дополнительно ускорялась за счет наличия в растворе ионов меди. Еще позже отец поехал в другой город и купил мне 100 мл бутылочку с 70% уксусной кислотой, за что я ему был очень благодарен. Я использовал кислоту для экспериментов, расходуя экономно. С чистой уксусной кислотой познакомился, будучи в аспирантуре. У нас в лаборатории стояла 20 л бутыль, наполненная на 2/3 уксусной кислотой. Хотя в лаборатории не было особенно холодно, зимой половина кислоты замерзла. Твердая уксусная кислота очень похожа на лед, именно поэтому чистую уксусную кислоту часто называют "ледяная уксусная кислота". Температура замерзания уксусной кислоты равна 16.6°C: не удивительно, что кислота в бутыли частично затвердела. Несмотря на внешнее сходство, между твердой уксусной кислотой и замерзшей водой есть существенное различие. Вода при замерзании расширяется, в результате лед плавает на поверхности жидкой воды, поскольку его плотность ниже, чем плотность воды. Уксусная кислота, как и подавляющее большинство жидкостей, при замерзании уменьшает объем (сжимается). В результате твердая уксусная кислота тяжелее, чем жидкая, следовательно, твердая кислота располагается снизу, а жидкая - сверху. Данное свойство уксусной кислоты сыграло злую шутку с моим соседом. Когда он наливал кислоту из этой бутыли, соседу пришлось наклонить сосуд горлышком вниз. В результате его дно оказалось сверху. Сначала ничего плохого не произошло, сосед начал наливать кислоту в стакан. Однако, потом твердая уксусная кислота резко отделилась от дна и двинулась вниз к горлышку, выдавливая жидкость из бутыли, словно поршень. В результате коллега облился кислотой. Благо обошлось без последствий. Следующий раз я столкнулся с ледяной уксусной кислотой в лаборатории гальванического цеха [1]. Дело было также зимой. В бутылке находилась жидкая кислота без каких-либо признаков кристаллизации. Температура в помещении была 12°С. Открыл бутылку и попытался засосать кислоту в пипетку, но мне это не удалось. Носик пипетки забился чем-то твердым. Оказалось, что уксусная кислота начала кристаллизоваться. Вскоре вся кислота в бутылке затвердела. От коллег узнал, что ледяная уксусная кислота склонна к переохлаждению. Она может охлаждаться ниже точки замерзания, оставаясь жидкой. Неожиданное замерзание часто происходит при переливании переохлажденной кислоты из сосуда в сосуд. Зато, если ее "не беспокоить", переохлажденная уксусная кислота может оставаться жидкой длительное время. Недавно другой коллега упомянул, что у них в лаборатории отключили отопление. В комнате стало холодно. Там стояла 20 л канистра с ледяной уксусной кислотой, которая осталась жидкой. Когда его сосед взял эту канистру и попытался перелить из нее кислоту, удалось вылить только половину, после чего кислота замерзла. Я вспомнил, что летом нашел в лаборатории ПЭТФ бутылку, содержащую уксусную кислоту. Горлышко бесцветной бутылки стало матовым из-за действия паров кислоты. Ее концентрация была неизвестна: это могла быть ледяная уксусная кислота или водный раствор с высоким содержанием кислоты. Перелил кислоту в стеклянную бутылку и оставил до зимы. Зимой данная лаборатория не отапливается, температура в ней лишь на несколько градусов выше нуля. Если уксусная кислота замерзнет, следовательно, это ледяная уксусная кислота. Если кислота останется жидкой, значит, кислота содержит воду. Уксусная кислота образует с водой одну эвтектику с температурой кристаллизации -26.5°C [2]. Таким образом, постепенное добавление воды в ледяную уксусную кислоту понижает температуру замерзания раствора, пока она не достигнет -26.5°C (при концентрации кислоты примерно 60% мас.). Дальнейшее увеличение содержания воды в смеси приводит к увеличению температуры замерзания раствора уксусной кислоты.   
Дело в том, что зависимость плотности раствора уксусной кислоты от концентрации немонотонна. В этом состоит отличие уксусной кислоты от всех упомянутых веществ. При увеличении концентрации уксусной кислоты плотность раствора сначала увеличивается, проходит через максимум, а потом уменьшается. В результате одному и тому же значению плотности раствора могут соответствовать две разные концентрации уксусной кислоты. 
https://www.engineeringtoolbox.com/density-aqueous-solution-formic-lactic-oxalic-acetic-citric-acid-concentration-d_1953.html |

Acetic Acid |

|

|

|

|

1,4-Dioxane |

|

|

|

Did Acetic Acid Freeze? |

The Acetic Acid |

|

The Bottle Containing Acetic Acid |