Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
В чистом виде кислород впервые был получен Шееле в 1772 г., затем в 1774 г. Пристли выделил
его из окиси ртути.
Латинское название кислорода "оксигениум" происходит от древнегреческого слова "оксис", что значит "кислый", и "геннао" - "рождаю"; отсюда латинское "оксигениум" означает "рождающий кислоты".
Содержание кислорода в земной коре, включая воду и воздух, составляет 49,42%; это самый распространенный элемент.
В свободном состоянии кислород находится в воздухе и воде. В воздухе (атмосфере) его содержится 20,9% по объему или 23,2% по весу; содержание его в воде в растворенном состоянии составляет 7-10 мг/л.
В связанном виде кислород входит в состав воды (88,9%), различных минералов (в виде различных кислородных соединений). Кислород входит в состав тканей каждого растения. Он необходим для дыхания животных.
Кислород в природе встречается в свободном состоянии в смеси с другими газами и в виде соединений, а поэтому применяются как физические, так и химические методы его получения.
Общий метод получения кислорода из соединений основан на окислении двухвалентного отрицательно заряженного иона по схеме:
2О2- - 4е- = О2.
Поскольку окисление может быть осуществлено различным образом, существует и множество различных (лабораторных и промышленных) способов получения кислорода.
2HgO = 2Hg + O2 - 2x25 ккал.
Из 10 г красной окиси ртути получают 500 мл кислорода.
Для опыта пользуются пробиркой из тугоплавкого стекла длиной 17 см и диаметром 1,5 см с согнутым, как показано на рис. 107, нижним концом длиной 3-4 см. В нижний конец насыпают 3-5 г красной окиси ртути. В пробирку, укрепленную в штативе в наклонном положении, вставляют резиновую пробку с отводной трубкой, по которой выделяющийся при нагревании кислород отводят в кристаллизатор с водой.
При нагревании красной окиси ртути до 500° наблюдается выделение кислорода из отводной трубки и появление капелек металлической ртути на стенках пробирки.
Кислород плохо растворяется в воде, и поэтому его собирают, применяя способ вытеснения воды после полного удаления воздуха, из прибора.
По окончании опыта сначала вынимают отводную трубку из кристаллизатора с водой, затем гасят горелку и, учитывая ядовитость паров ртути, открывают пробку только после полного остывания пробирки.
Вместо пробирки можно пользоваться ретортой с приемником для ртути.
Опыт. Термическое разложение окиси серебра. Уравнение реакции:
2Ag2О = 4Ag + О2 - 13 ккал.
При нагревании черного порошка окиси серебра в пробирке с отводной трубкой выделяется кислород, который собирают над водой, а на стенках пробирки остается в виде зеркала блестящий слой серебра.
а) 2PbO2 = 2PbO + O2;
б) 2Pb3O4 = 6PbO + O2;
PbO2 290-320°→ Pb2O3 390-420°→ Pb3O4 530-550°→ PbO.
При термическом разложении из 10 г двуокиси свинца получают около 460 мл кислорода, а из 10 г Рb3O4 - около 160 мл кислорода.
Получение кислорода из окислов свинца требует более сильного нагревания.
При сильном нагревании темно-бурого порошка РbO2 или оранжевого Рb3O4 в пробирке образуется желтый порошок окиси свинца РbО; при помощи тлеющей лучинки можно убедиться в том, что происходит выделение кислорода.
Пробирка после этого опыта не годится для дальнейшего употребления, так как. при сильном нагревании окись свинца соединяется со стеклом.
Опыт. Термическое разложение двуокиси марганца. Кислород образуется в результате внутримолекулярной окислительно-восстановительной реакции:
3МnO2 = Мn3O4 + O2 - 48 ккал.
Из 10 г двуокиси марганца (пиролюзита) получают около 420 мл кислорода. Пробирку в этом случае нагревают до светло-красного каления.
Для получения большого количества кислорода процесс разложения пиролюзита осуществляют в закрытой с одного конца железной трубке длиной 20 см. Второй конец ее закрывают пробкой с трубкой, по которой отводится кислород.
Железную трубку нагревают при помощи печи для сжигания или газовой горелки Теклу с насадкой "ласточкин хвост".
Опыт. Термическое разложение хромового ангидрида. Кислород образуется в результате внутримолекулярной окислительно-восстановительной реакции:
4СrO3 = 2Сr2O3 + 3O2 - 12,2 ккал.
При термическом разложении хромового ангидрида (гигроскопического, твердого вещества темно-красного цвета) выделяется кислород и образуется зеленый порошок окиси хрома Сr2O3.
2ВаO2 + 38 ккал ←500° 700°→ 2ВаО + O2.
При сильном нагревании перекиси бария ВаO2 перекисная связь разрывается с образованием окиси бария и выделением кислорода.
Из 10 г перекиси бария получают около 660 мл кислорода.
Вместо перекиси бария можно пользоваться также перекисью натрия. Тогда разложение идет по уравнению
2Na2O2 = 2Na2O + O2.
Опыт проводят в пробирке с отводной трубкой.
Опыт. Термическое разложение хлората калия. В зависимости от температуры хлорат калия разлагается по-разному. При нагревании его до 356° он плавится, а при 400° разлагается по уравнению
2КСlO3 = КСlO4 + КСl + O2.
В этом случае выделяется только одна треть содержащегося в соединении кислорода и наблюдается затвердение расплава. Такое явление объясняется тем, что образовавшееся соединение КСlO4 более стойкое и тугоплавкое.
При нагревании хлората калия до 500° образование перхлората калия является промежуточной реакцией. Разложение в этом случае протекает по уравнениям:
а) 4КСlO3 = 3КСlO4 + КСl + 71 ккал;
б) 3КСlO4 = 3КСl + 6O2 - 24 ккал;
4КСlO3 = 4КСl + 6O2 + 52 ккал.
Термическое разложение хлората калия проводят в небольшой реторте, которая при помощи отводной трубки с предохранительной трубкой соединена с кристаллизатором, наполненным водой (или пневматической ванной). Прибор собирают в соответствии с рис. 108. Во избежание взрыва в реторту насыпают чистый КСlO3, без примеси органических веществ.
Чтобы избежать бурного разложения, из-за которого может лопнуть реторта, нагревание ведут осторожно.
Выделяющийся кислород собирают в различные сосуды над водой. Когда хотят получить медленный ток кислорода, хлорат калия разбавляют, смешивая его с сухой поваренной солью.
Опыт. Термическое разложение хлората калия в присутствии катализатора. В присутствии катализаторов (MnO2, Fe2O3, Сr2О3 и СuО) хлорат калия легко и полностью разлагается при более низкой температуре (без образования промежуточного соединения, перхлората калия) по уравнению:
2КСlO3 = 2КСl + 3O2 + 19,6 ккал.
При добавлении двуокиси марганца КClO3 разлагается уже при 150-200°; процесс имеет следующие промежуточные стадии:
2КСlO3 + 6MnO2 → 2КСl + 6МnO3 → 2КСl + 6MnO2 + 3O2 + 19,6 ккал.
Доля добавляемой двуокиси марганца (пиролюзита) составляет от 5 до 100% от веса хлората калия.
Пробирку с хлоратом калия закрывают пробкой, сквозь которую пропускают две стеклянные трубки. Одна трубка служит для отвода кислорода в кристаллизатор с водой, вторая, очень короткая трубка, согнутая под прямым углом с закрытым внешним концом, содержит мелкий порошок черной двуокиси марганца MnO2.
Прибор собирают в соответствии с рис. 109. При нагревании пробирки приблизительно до 200° пузырьки кислорода в кристаллизаторе с водой еще не выделяются. Но стоит повернуть вверх коротенькую трубку с двуокисью марганца и слегка постучать по ней, в пробирку попадет небольшое количество двуокиси марганца и сразу же начнется бурное выделение кислорода.
После окончания опыта и охлаждения прибора смесь двуокиси марганца и хлорида калия высыпают в воду. После растворения хлорида калия отфильтровывают трудно растворимую двуокись марганца, тщательно промывают на фильтре, высушивают в сушильном шкафу и хранят для дальнейшего ее использования в качестве катализатора. Если необходимо получить большое количество кислорода, процесс разложения ведут в ретортах из тугоплавкого стекла либо в чугунных ретортах.
Термическое разложение хлората калия в присутствии двуокиси марганца является наиболее удобным из сухих способов получения кислорода.
Этот опыт проделывают и с другими катализаторами - Fe2O3, Сr2О3 и СuО.
Опыт. Получение кислорода путем нагревания хлората калия, смеси хлората калия с двуокисью марганца и двуокиси марганца. Для проведения опыта необходимы следующие приборы: три пробирки из тугоплавкого стекла с отводными трубками, три цилиндра емкостью по 100 мл каждый, три газовые горелки, три кристаллизатора и три штатива с зажимами.
Установку собирают в соответствии с рис. 110. Кристаллизаторы и цилиндры наполняют водой, слегка подкрашенной перманганатом калия или фуксином S.
В первую пробирку насыпают 1 г чистого КСlO3, во вторую - 0,5 г КСlO3 и 0,5 г MnO2 и в третью - 1 г MnO2. Особое внимание обращают на то, чтобы пробирки были чистыми и в них не попали крупинки пробки.
Тщательно отрегулированные газовые горелки, горящие одинаковым, не очень сильным несветящимся пламенем и выделяющие одинаковое количество тепла, подставляют под пробирки так, чтобы они верхушкой пламени нагревали находящееся в пробирке вещество.
Вскоре из пробирки со смесью хлората калия и двуокиси марганца начинает выделяться кислород, и реакция заканчивается еще до того, как он начнет выделяться в других пробирках.
Усиливают нагревание остальных двух пробирок. Как только хлорат калия расплавится и начнет выделяться кислород, уменьшают пламя, чтобы не происходило бурного выделения газа. В пробирке с двуокисью марганца кислород начинает выделяться только после того, как содержимое пробирки нагреется до красного каления. Выделяющийся из каждой пробирки кислород собирают в кристаллизаторах путем вытеснения подкрашенной воды из цилиндров.
По окончании опыта гасят горелки, удаляют отводные трубки, затем описанным выше способом выделяют двуокись марганца из средней пробирки.
Проведенный опыт наглядно показывает особенности этих трех различных способов получения кислорода.
1. Нитраты, разлагающиеся в результате внутримолекулярных окислительно-восстановительных реакций на нитриты и кислород. К этой группе относятся нитраты щелочных металлов. Реакции протекают по уравнениям:
2NaNО3 = 2NaNО2 + О2,
2KNО3 = 2KNО2 + О2.
2. Нитраты, разлагающиеся в результате внутримолекулярных окислительно-восстановительных реакций на окись металла, двуокись азота и кислород. К этой группе относятся нитраты всех металлов, за исключением щелочных и благородных металлов. Например:
2Pb(NО3)2 = 2РbО + 4NO2 + O2,
2Cu(NO3)2 = 2CuO + 4NO2 + O2,
2Hg(NO3)2 = 2HgO + 4NO2 + O2.
3. Нитраты, разлагающиеся в результате внутримолекулярных окислительно-восстановительных реакций на металл, двуокись азота и кислород. К этой группе относятся нитраты благородных металлов:
2AgNO3 = 2Ag + 2NO2 + O2.
Неодинаковое разложение нитратов при нагревании объясняется различной устойчивостью соответствующих нитритов и окислов.
Нитриты щелочных металлов устойчивы, нитриты свинца (или меди) неустойчивы, но устойчивы их окислы, а что касается серебра, то здесь неустойчивыми являются и нитриты, и окислы; поэтому при нагревании нитратов этой группы выделяются свободные металлы.
Опыт. Термическое разложение нитрата натрия или калия. Нитрат натрия или калия нагревают в пробирке или реторте с отводной трубкой. При 314° плавится нитрат натрия, а при 339° - нитрат калия; лишь после того как содержимое в пробирке или реторте накалится докрасна, начинается разложение нитрата по уравнениям, которые приводились выше.
Разложение протекает гораздо легче, если предупредить расплавление нитратов, смешав их с двуокисью марганца или натронной известью, представляющей собою смесь NaOН и СаО.
Термическое разложение нитратов свинца и серебра рассматривается в опытах получения двуокиси азота.
2КМnO4 = К2МnO4 + МnO2 + O2.
Эта внутримолекулярная окислительно-восстановительная реакция протекает приблизительно при 240°. Термическое разложение проводят в сухой пробирке (или реторте) с газоотводной трубкой. Если хотят получить чистый кислород без следов пыли, которая образуется при термическом разложении, в шейку пробирки (или реторты) вставляют тампон стеклянной ваты.
Это удобный способ получения кислорода, но он дорог.
После окончания опыта и охлаждения пробирки (или реторты) в нее наливают несколько миллилитров воды, тщательно взбалтывают содержимое и наблюдают цвет образовавшихся веществ (К2МnO4 - зеленого цвета и МnO2 темно-бурого).
Благодаря свойству перманганата калия выделять кислород при нагревании, его наравне с серой, углем и фосфором применяют в различных взрывчатых смесях.
(NН4)2S2O8 = (NН4)2SO4 + SO2 + O2.
Для освобождения кислорода от примеси двуокиси серы газовую смесь пропускают через раствор NaOН, который связывает двуокись серы в виде сульфита натрия. Термическое разложение проводят в пробирке с отводной трубкой.
2К2С2O6 = 2К2СO3 + 2СO2 + O2.
Для освобождения кислорода от примеси углекислого газа газовую смесь пропускают через раствор гидрата окиси кальция или бария.
Кислород можно также получать сжиганием оксигенита. Оксигенитом называют тонкую смесь 100 вес. ч. КСlO3, 15 вес. ч. МnO2 и небольшого количества угольной пыли.
Получаемый этим способом кислород загрязнен примесью углекислого газа.
Наряду с веществами, которые при нагревании разлагаются с выделением кислорода, имеется много веществ, не выделяющих кислорода при нагревании. Чтобы убедиться в этом, проделывают опыты с нагреванием СuО, СаО, Na2SO4 и др.
2Na2O2 + 4Н2O = 4NaOH + 2Н2O + O2.
Это сильно экзотермическая реакция, протекающая на холоду и ускоряющаяся катализаторами - солями меди, никеля, кобальта (например, СuSO4•5Н2O, NiSO4•7Н2O и СoSO4•7Н2O).
Удобным для получения кислорода является оксилит - смесь перекиси натрия Na2O2, калия К2O2 и безводного сульфата меди. Эту смесь хранят в плотно укупоренных железных ящиках, предохраняя ее от атмосферной влаги (которая разлагает ее, см. уравнение предыдущей реакции) и углекислого газа, с которым она вступает в реакцию по уравнению:
Na2O2 + 2СO2 = 2Na2СO3 + O2 + 113 ккал.
Опыт. В пробирку (стакан или склянку) с небольшим количеством холодной воды насыпают щепотку перекиси натрия (или оксилита); при этом наблюдается бурное выделение кислорода и сосуд разогревается.
Если опыт проводить в сосуде с отводной трубкой, то выделяющийся кислород можно собрать.
2ВаO2 + 4НСl = 2ВаСl2 + 2Н2O + O2.
При использовании РbO2 в качестве катализатора к смеси добавляют разбавленную HNO3.
2Н2O2 = 2Н2O + O2.
При изучении свойств перекиси водорода отмечаются факторы, благоприятствующие ее разложению, и проводятся опыты ее разложения под влиянием двуокиси марганца и коллоидного раствора серебра.
Опыт. В стеклянный цилиндр с 50 мл воды и 10-15 мл пергидроля (30%-ный раствор Н2O2) добавляют немного тонко измельченного порошка двуокиси марганца; наблюдается бурное выделение кислорода с образованием пены (это явление очень похоже на кипение).
Опыт можно проделать и в пробирке, а вместо пергидроля использовать 3%-ный раствор перекиси водорода.
Вместо МnO2 можно пользоваться коллоидным раствором серебра.
2КМnO4 + 3Н2SO4 + 5Н2O2 = 2МnSO4 + К2SO4 + 8Н2O + 5O2,
2КМnO4 + 2Н2O + 3Н2O2 = 2МnO2 + 2КОН + 4Н2O + 3O2,
2КМnO4 + 2КОН + Н2O2 = 2К2МnO4 + 2Н2O + O2.
Опыт. Получение легко регулируемого постоянного тока кислорода окислением перекиси водорода на холоду перманганатом калия в щелочной среде. В колбу Бунзена наливают 3-5%-ный раствор перекиси водорода, подкисленный 15%-ным раствором Н2SO4, а в укрепленную в горлышке колбы капельную воронку - 10%-ный раствор перманганата калия.
При помощи крана капельной воронки можно регулировать как поступление раствора перманганата в колбу, так и ток кислорода. При проведении опыта раствор КМnO4 вводят в колбу по каплям.
Колбу Бунзена в опыте можно заменить колбой Вюрца или двугорлой склянкой.
Опыт. Получение кислорода окислением перекиси водорода двуокисью марганца в кислой среде. Уравнение реакции:
МnO2 + Н2SO4 + Н2O2 = МnSO4 + 2Н2O + O2.
Реакция протекает на холоду; поэтому для опыта можно пользоваться любым прибором, позволяющим взаимодействием на холоду между твердым и жидким веществом получать постоянный ток газа (аппаратом Киппа или колбой Вюрца, колбой Бунзена или двугорлой склянкой с капельной воронкой).
При проведении опыта пользуются двуокисью марганца в кусках, 15%-ной Н2SO4 и 3-5%-ным раствором перекиси водорода.
Опыт. Получение кислорода окислением перекиси водорода железосинеродистым калием в щелочной среде. Уравнение реакции:
2К3[Fe(СN)6] + Н2O2 + 2КОН = 2К4[Fe(CN)6] + 2Н2O + O2.
Реакция протекает на холоду; для получения постоянного тока кислорода используются приборы, указанные в предыдущем опыте, твердый железосинеродистый калий, 6-10%-ный раствор гидрата окиси калия и 3-5%-ный раствор перекиси водорода.
Опыт. Получение кислорода нагреванием хромата (бихромата или хромового ангидрида) с концентрированной серной кислотой. Благодаря обратимой реакции, протекающей по уравнению:
2CrO42- + 2Н+ ↔ Cr2O72- + Н2O,
в кислой среде всегда содержится бихромат, а не хромат.
Между концентрированной серной кислотой и бихроматом имеют место следующие реакции:
К2Сr2O7 + Н2SO4 = 2СrO3 + К2SO4 + Н2O,
(реакция двойного обмена и дегидратации)
4СrO3 + 6Н2SO4 = 2Сr2(SO4)3 + 6Н2O + 3O2.
(окислительно-восстановительная реакция)
При проведении опыта в пробирке происходит выделение кислорода и изменение оранжевого цвета (характерного для бихромата) в зеленый цвет (характерный для солей трехвалентного хрома).
Большинство газов при сжатии нагревается, а при расширении охлаждается. На рис. 111 приводится принципиальная схема работы машины Линде, применяемой для сжижения воздуха.
Компрессор В при помощи поршня сжимает до 200 атм поступающий через кран А воздух, очищенный от углекислого газа, влаги и следов пыли. Возникающее при сжатии тепло поглощается в холодильнике D, охлаждаемом проточной водой. После этого открывают кран С и воздух поступает в сосуд Е, где он расширяется до давления 20 атм. Благодаря такому расширению воздух охлаждается приблизительно до -30°. Из сосуда Е воздух снова возвращается в компрессор В; проходя по наружной трубке змеевика G, он охлаждает по пути новую порцию сжатого воздуха, идущую ему навстречу по внутренней трубке змеевика. Вторая порция воздуха охлаждается таким образом приблизительно до -60°. Этот процесс повторяется до тех пор, пока воздух не охладится до -180°; такая температура является достаточной для сжижения его при 20 атм в сосуде Е. Скопляющийся в сосуде Е жидкий воздух сливают в баллон через кран 1. Описанная установка работает непрерывно. Детали этой машины на схеме не показаны. Эту машину усовершенствовал Ж. Клод, после чего она стала более производительной.
По своему составу жидкий воздух отличается от обычного атмосферного; он содержит 54% по весу жидкого кислорода, 44% азота и 2% аргона.
Опыт. Чтобы показать, как изменяются свойства органических веществ под влиянием изменения условий (температуры и концентрации кислорода), в термос с жидким воздухом погружают при помощи металлических щипцов растения с листьями и цветами или тонкую резиновую трубку.
Из жидкого воздуха кислород получают следующими способами:
Для очистки кислорода его пропускают через промывную склянку со щелочью, которая удерживает все сопровождающие его летучие соединения кислотного характера, через раствор КI (для освобождения от озона) и через концентрированную Н2SO4, которая удерживает пары воды.
Плотность его относительно воздуха 1,10563; поэтому его можно собирать в сосуды, применяя способ вытеснения воздуха.
В нормальных условиях один литр кислорода весит 1,43 г, а один литр воздуха - 1,29 г. Температура кипения -183°, температура плавления -218,88°.
Жидкий кислород в тонком слое бесцветен, толстые слои имеют голубой цвет; удельный вес жидкого кислорода 1,134.
Твёрдый кислород обладает голубым цветом и по виду похож на снег; удельный вес его 1,426.
Критическая температура кислорода -118°; критическое давление 49,7 атм. (Кислород хранят в стальных баллонах емкостью 50 л, под давлением 150 атм. Способы хранения различных газов в стальных баллонах описаны в первой главе.)
В воде кислород растворяется в очень небольшом количестве: в одном литре воды при 20° и давлении 760 мм рт. ст. растворяется 31,1 мл кислорода. Поэтому его можно собирать в пробирки, цилиндры или газометры, применяя способ вытеснения воды. В спирте кислород растворяется лучше, чем в воде.
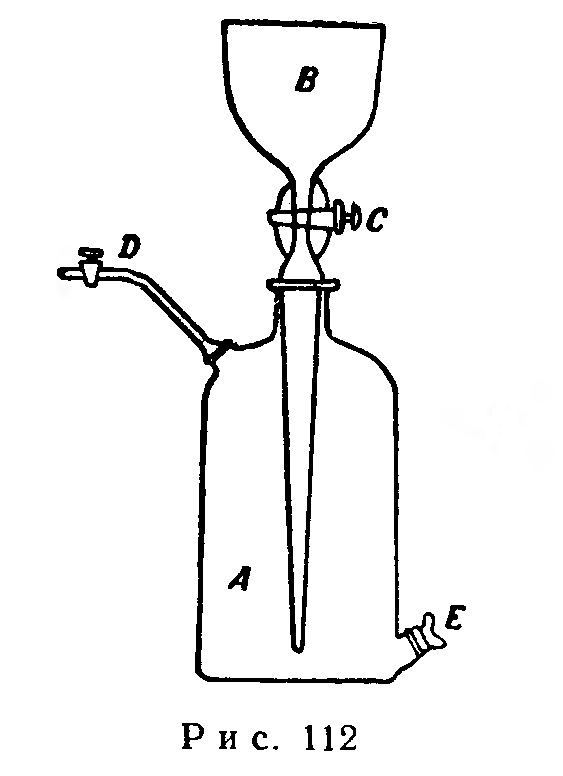
Чтобы пользоваться газометром (рис. 112), необходимо уметь наполнять его водой и газом, находящимся под атмосферным, а также выше и ниже атмосферного давления; уметь выпускать газ из газометра.
Вначале газометр А наполняют водой через воронку В, при открытых кранах С и D и закрытом отверстии Е. Вода, поступая в газометр из воронки В через кран С, вытесняет из него воздух через кран D.
Для наполнения газометра газом, находящимся под некоторым давлением, закрывают кран С и В и открывают отверстие Е: если оба верхних крана плотно пригнаны, вода из газометра не вытекает. Вводят через отверстие Е конец трубки, по которой поступает газ, находящийся под давлением, превышающим атмосферное. Газ скопляется в верхней части газометра, вытесняя из него воду, которая выливается через отверстие Е. После того как газ почти полностью наполнит газометр, отверстие Е закрывают. При наполнении газометра газом, находящимся под атмосферным или пониженным давлением, трубку, по которой поступает газ, присоединяют к открытому крану Б, затем открывают отверстие Е и оставляют закрытым кран С. Вода, вытекая из отверстия Е, всасывает газ в газометр. После того как газометр почти полностью наполнится газом, закрывают отверстие Е и кран В.
Для выпуска газа наполняют воронку В водой, открывают кран С; вода, поступая в газометр, вытесняет из него газ, который выходит через открытый кран Е).
В расплавленном состоянии некоторые металлы, например платина, золото, ртуть, иридий и серебро, растворяют около 22 объемов кислорода, который выделяется при их затвердевании со специфическим звуком, особенно характерным для серебра.
Молекула кислорода очень устойчива, она состоит из двух атомов; при 3000° только 0,85% молекул кислорода диссоциирует на атомы.
С другими элементами он соединяется непосредственно или образует соединения косвенным путем. Непосредственное соединение кислорода может протекать энергично и медленно. Соединение кислорода с элементами или сложными веществами называют окислением или горением. Оно всегда протекает с выделением тепла, а иногда и света. Температура, при которой происходит окисление, может быть различной. Одни элементы соединяются с кислородом на холоду, другие - только при нагревании.
В том случае, когда при химической реакции количество выделяющегося тепла превышает его потери в результате излучения, теплопроводности и т.д., происходит энергичное окисление (например, горение металлов и неметаллов в кислороде), в противном случае происходит медленное окисление (например, фосфора, угля, железа, тканей животных, пирита и т.д.).
Если медленное окисление протекает без потери тепла, происходит повышение температуры, которое приводит к ускорению реакции, и медленная реакция в результате самоускорения может стать энергичной.
Опыт. Пример самоускорения медленной реакции. Берут два небольших кусочка белого фосфора. Один из них обертывают фильтровальной бумагой. Через некоторое время обернутый бумагой кусочек фосфора загорается, в то время как незавернутый продолжает медленно окисляться.
Четкой грани между энергичным и медленным окислением не существует. Энергичное окисление сопровождается выделением большого количества тепла и света; медленное окисление иногда сопровождается холодной люминесценцией.
Горение также протекает по-разному. Вещества, которые при горении превращаются в парообразное состояние (натрий, фосфор, сера и др.), сгорают с образованием пламени; вещества, не образующие при горении газов и паров, сгорают без пламени; горение некоторых металлов (кальций, магний, торий и др.) сопровождается выделением большого количества тепла, а образующиеся при этом раскаленные окислы обладают способностью выделять много света в видимой области спектра.
Вещества, выделяющие большое количество тепла при окислении (кальций, магний, алюминий), способны вытеснять другие металлы из их окислов (на этом свойстве основана алюминотермия).
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе, в котором оно замедляется ввиду того, что в нем содержится около 80% азота, не поддерживающего горения.
Для сжигания в кислороде вещество помещают в специальную ложечку, сделанную из расплющенной на конце толстой железной (или медной) проволоки, либо прикрепляют сжигаемый образец к концу проволоки.
Опыт. Воспламенение и горение в кислороде тлеющей лучинки (или свечи). При внесении в сосуд с кислородом тлеющей лучинки (или свечи) лучинка воспламеняется и сгорает ярким пламенем. Иногда лучинка воспламеняется с небольшим взрывом. Описанным опытом пользуются всегда для открытия свободного кислорода (* Аналогичную реакцию дает закись азота).
Опыт. Горение угля в кислороде. Уравнение реакции:
С + O2 = СO2 + 94,3 ккал.
Если внести в сосуд с кислородом кусочек тлеющего угля, укрепленного на конце железной проволоки, уголь сгорает с выделением большого количества тепла и света. Образующийся при горении углекислый газ открывают при помощи смоченной водой синей лакмусовой бумаги или путем пропускания газообразных продуктов горения через раствор гидрата окиси кальция.
Опыт горения угля в кислороде, выделяющемся при термическом разложении КClO3, уже проводился при изучении свойств хлората калия.
Опыт. Горение серы в кислороде. Уравнение реакции:
S + O2 = SO2 + 71 ккал.
При внесении в сосуд с кислородом зажженного серного цвета наблюдается более интенсивное горение серы в кислороде и ощущается резкий запах сернистого газа. Чтобы не распространялся по лаборатории этот ядовитый газ, сосуд по окончании опыта плотно закрывают.
Горение серы в кислороде, выделяющемся при термическом разложении хлората калия, описывалось при изучении свойств КClO3.
Опыт. Горение белого и красного фосфора в кислороде. Реакция протекает по уравнению:
4Р + 5O2 = 2Р2О5 + 2х358,4 ккал.
Короткое и широкое горлышко колбы (или банки) емкостью 0,5-2 л, помещенной на поднос с песком, закрывают пробкой с пропущенной через нее металлической ложечкой и стеклянной трубкой, ось которой должна проходить через середину ложечки (рис. 114).
Одновременно с наполнением колбы кислородом (способом вытеснения воздуха) отрезают в ступке под водой кусочек белого фосфора величиной с горошину, слегка обжимают его фильтровальной бумагой для удаления следов воды и при помощи металлических щипцов кладут в металлическую ложечку. Ложечку опускают в колбу, закрывают ее и прикасаются к фосфору нагретой до 60-80° стеклянной палочкой (или проволокой), которую вводят через стеклянную трубку.
Фосфор воспламеняется и сгорает ярким пламенем с образованием пятиокиси фосфора в виде белого дыма (вызывающего кашель).
Иногда белый фосфор загорается в кислороде и без прикосновения к нему нагретой стеклянной палочки или проволоки. Поэтому рекомендуется пользоваться фосфором, хранившимся в очень холодной воде; отжимать его фильтровальной бумагой следует без всякого трения и вообще всю подготовку к введению его в сосуд с кислородом надо проводить как можно быстрее. Если фосфор После сгорания фосфора вынимают пробку с ложечкой, наливают в колбу небольшое количество воды и испытывают ее синей лакмусовой бумагой.
Если часть фосфора осталась неокисленной, ложечку опускают в кристаллизатор с водой. Если же фосфор сгорел весь, то ложечку прокаливают под тягой, промывают водой и высушивают над пламенем горелки.
При проведении этого опыта никогда не вводят в сосуд с кислородом расплавленный белый фосфор. Этого нельзя делать, во-первых, потому, что фосфор легко можно разлить, а, во-вторых, потому, что в этом случае фосфор сгорает в кислороде слишком бурно, разбрасывая во все стороны брызги, которые могут попасть на экспериментатора; от брызг фосфора лопается сосуд, осколки которого могут ранить окружающих.
Поэтому на столе должен быть кристаллизатор с водой, в который можно бросить фосфор в случае, если он загорится при его обжимании фильтровальной бумагой; необходимо также иметь концентрированный раствор КМnO4 или AgNO3 (1 : 10) для оказания первой помощи в случае ожогов фосфором.
Вместо белого фосфора можно пользоваться сухим красным фосфором. Для этого красный фосфор предварительно очищают, тщательно промывают водой и высушивают.
Красный фосфор воспламеняется при более высокой температуре, поэтому его поджигают сильно нагретой проволокой.
После сжигания и в этом случае наливают в колбу немного воды, испытывают лакмусом полученный раствор и прокаливают ложечку под тягой.
В обоих опытах следует пользоваться защитными очками из темного стекла.
Опыт. Горение в кислороде металлического натрия. Реакция протекает по уравнению:
2Na + O2 = Na2O2 + 119,8 ккал.
Натрий сжигают в небольшом тигле из чистой окиси кальция, мела или асбестового картона, но не в металлической ложечке, которая от тепла, выделяющегося при горении натрия в кислороде, может сама расплавиться и сгореть.
Натрий поджигают и вносят в сосуд с кислородом, в котором он сгорает очень ярким пламенем; наблюдать за его горением следует через защитные темные очки.
Приготовленный из мела (или СаО) тигель прикрепляют двумя-тремя тонкими проволочками к толстой железной (или медной) проволоке (рис. 115) и кладут в него очищенный от окиси кусочек металлического натрия размером с горошину.
Мел, асбест, окись кальция являются плохими проводниками тепла, и поэтому поджигают натрий, направляя на него сверху пламя горелки при помощи паяльной трубки. Чтобы обезопасить себя от брызг горящего натрия, на паяльную трубку надевают резиновую трубку.
Нагревание, плавление и поджигание натрия в воздухе производят над сосудом с кислородом.
Если натрий не загорается, то при помощи паяльной трубки удаляют образовавшуюся на поверхности металла корку, но делать это следует крайне осторожно из-за возможного разбрызгивания расплавленного натрия.
Опыт. Горение в кислороде металлического кальция. Уравнение реакции:
2Са + O2 = 2СаО + 2х152,1 ккал.
В небольшой тигель из асбестового картона кладут спичку, а сверху на нее - стружки кальция.
Зажигают спичку и вносят тигель со стружками кальция в сосуд с кислородом. Через защитные очки наблюдают воспламенение и сгорание металлического кальция ярким пламенем.
В сосуд с кислородом можно внести и зажженный кальций (как это делалось в предыдущем опыте с натрием).
Опыт. Горение магния в кислороде. Реакция протекает по уравнению:
2Mg + O2 = 2MgO + 2x143,84 ккал.
К одному концу ленты магния длиной 20-25 см, скрученной в виде спирали, прикрепляют кусочек трута, а к другому - железную проволоку. Проволоку берут в руку и, держа ленту магния в вертикальном положении, поджигают трут и вносят ленту магния в сосуд с кислородом. Сквозь защитные очки наблюдают воспламенение и горение магния с образованием окиси магния.
По окончании опыта наливают в сосуд немного воды и при помощи индикатора убеждаются в щелочном характере раствора образовавшейся гидроокиси магния.
Опыт можно проделать и с порошком магния. Для этого берут ложечку порошка магния и вставляют в него половину спички с головкой. Поджигают спичку и вносят ложечку в сосуд с кислородом.
Впрочем, магний горит ослепительным пламенем и на воздухе, хотя здесь окислительные реакции кислорода значительно ослаблены в связи с тем, что в воздухе содержится большой процент азота.
Сосуд, в котором сжигают магний, может лопнуть, если вводить в него горящий магний недостаточно быстро или если горящий магний прикоснется к его стенкам.
Яркий свет горящего магния нашел применение для освещения фотографируемых объектов, а также в качестве инициатора некоторых реакций, протекающих под влиянием коротких световых волн, например синтеза НСl из элементов.
При рассмотрении свойств хлората калия описывался опыт горения его смеси с магнием.
Опыт. Горение в кислороде крупных опилок цинка. Уравнение реакции:
2Zn + O2 = 2ZnО + 2х83,17 ккал.
В трубку из тугоплавкого стекла длиной 15 см и внутренним диаметром 0,8-1 см насыпают крупных опилок цинка (за отсутствием их можно пользоваться и порошком, но таким образом, чтобы через него мог проходить кислород) и укрепляют ее за один конец в горизонтальном положении в зажиме штатива.
Укрепленный в штативе конец трубки соединяют с источником кислорода, а противоположный конец нагревают газовой горелкой.
При пропускании через трубку кислорода цинк воспламеняется и горит ярким пламенем с образованием окиси цинка (твердое белое вещество). Опыт проводится под тягой.
Опыт. Определение количества кислорода, расходуемого при горении меди. Реакция протекает по уравнению:
2Сu + O2 = 2СuО + 2х37,1 ккал.
Прибор для опыта показан на рис. 116. В тугоплавкую трубку длиной 20 см и внутренним диаметром 1,5 см вставляют фарфоровую лодочку с 1 г тонкого порошка металлической меди. Промывную склянку с водой соединяют с источником кислорода (газометром или баллоном).
Газометр с колоколом, расположенный справа, наполняют водой, подкрашенной раствором индиго или фуксина. Кран газометра открывают, чтобы проходящий через прибор кислород мог поступать под колокол.
Открывают зажим между промывной склянкой и тугоплавкой трубкой и впускают под колокол около 250 мл кислорода. Закрывают зажим и отмечают точный объем кислорода.
При помощи горелки Теклу с "ласточкиным хвостом" нагревают ту часть трубки, в которой находится фарфоровая лодочка. Через несколько минут медь загорается, и сразу же повышается уровень воды в колоколе.
Нагревание продолжают 35-40 минут, пока объем газа в газометре не перестанет изменяться.
Дают остыть прибору; при этом устанавливается постоянный объем газа. Затем приводят воду к одному уровню и по делениям газометра определяют объем непрореагировавшего кислорода.
Опыт дает возможность точно определить количество кислорода, затраченного на окисление меди, взвешенной перед началом опыта.
Пользоваться этим прибором для сжигания порошка цинка, магния или кальция запрещается.
Опыт. Подтверждение закона постоянства состава. Точно, до сотых долей грамма, взвешивают пустой фарфоровый тигель с крышкой, который перед этим был тщательно очищен, прокален и охлажден в эксикаторе. Затем в тигель насыпают приблизительно 3-4 г тонкого порошка меди и точно взвешивают тигель с медью.
Кладут тигель в наклонном положении на фарфоровый треугольник и нагревают его на слабом огне в течение 15-20 минут. Затем снимают крышку и сильно нагревают окислительным пламенем горелки. Через 20-25 минут накрывают тигель крышкой и продолжают нагревание. После прекращения нагревания тигель охлаждают в эксикаторе и точно взвешивают.
Данные трех взвешиваний позволяют рассчитать количество кислорода, связанное с 1 г и 63,54 г (грамм-атомом) меди. Записывают:
Повторив опыт с металлической медью и другими металлами, находят, что во всех случаях кислород соединяется с различными элементами в постоянном количественном соотношении, и на практике убеждаются, что отношение между весовым количеством веществ, вступающих в химическое соединение, всегда постоянно.
Опыт. Горение железа в кислороде. Уравнение реакции:
4Fе + 3O2 = 2Fе2O3 + 2х196,5 ккал.
Для опыта пользуются тонкой проволочкой из отпущенной стали диаметром 7-8 мм, один конец которой втыкают в корковую пробку, а к другому ее концу прикрепляют кусочек трута или обматывают нитками и погружают в расплавленную серу (серный фитиль). При введении в сосуд с кислородом (на дне которого должен быть слой песка) стальной спирали с зажженным трутом (или серным фитилем) спираль сгорает, разбрасывая искры.
Опыт. Сгорание металлических порошков в воздухе. Над пламенем установленной под тягой газовой горелки высыпают по щепотке порошка меди, цинка, железа, магния, алюминия, сурьмы.
Опыт. Окисление металлов в закрытом сосуде. Опыт позволяет доказать, что при превращении металлов в окислы расходуется часть воздуха и что увеличение веса металлов при их окислении равно потере веса воздуха.
Пробирку с тонким порошком железа плотно закрывают резиновой пробкой, сквозь которую должна быть пропущена стеклянная трубка с надетой на нее резиновой трубкой, имеющей винтовой зажим (рис. 117). Пробка и зажим должны закрывать пробирку герметически.
После взвешивания собранного прибора пробирку нагревают пламенем газовой горелки при непрерывном потряхивании до тех пор, пока в порошке не образуются искры. После охлаждения пробирки взвешиванием на весах проверяют, изменился ли вес пробирки. Затем в резиновую трубку вставляют стеклянную трубку, конец которой опускают в стакан с водой.
При открывании зажима наблюдают, как поднимается по трубке вода. Это происходит вследствие того, что кислород воздуха израсходовался на окисление железа и поэтому в приборе понизилось давление.
Выявить небольшую разницу между весом железа и весом окиси железа можно только с помощью достаточно чувствительных весов.
Вместо пробирки можно пользоваться ретортой или кругло-донной колбочкой, а вместо резиновой пробки - парафинированной корковой пробкой.
Аналогичные опыты были проделаны Ломоносовым и Лавуазье для доказательства закона сохранения материи.
Опыт. Медленное окисление влажного железа. Опыт позволяет установить, что при окислении влажного порошка железа выделяется тепло.
Прибор состоит из термоскопа, соединенного с манометром (рис. 118). В реакционное пространство термоскопа через плотно подогнанную резиновую пробку вводят две трубки. Первая трубка соединена с газовым баллоном и служит для подачи кислорода. Вторая трубка служит для удаления газа; она соединена с промывной склянкой Мюнке, в которую налита вода, подкрашенная индиго или фуксином.
В промывную склянку наливают такое количество воды, чтобы при всасывании во внутреннюю трубку и наполнении ее в склянке еще оставалась вода, которая закрывала бы выходное отверстие трубки.
Для изготовления термоскопа можно пользоваться внешней частью промывной склянки Дрекселя емкостью 300 мл с боковым тубусом. В сосуд вставляют пробирку длиной 23 см и диаметром 2,5 см с несколько суженной шейкой. Верхняя внешняя часть пробирки должна быть притерта к шейке сосуда. При отсутствии указанных выше деталей термоскоп можно изготовить из колбы Бунзена, в шейку которой при помощи резинового кольца вставляют большую пробирку. Термоскоп соединяют с U-образным манометром, в который наливают подкрашенную фуксином воду.
Манометр имеет Т-образный отвод с краном, который облегчает его регулирование.
В конической колбе смешивают 100 г железного порошка с бензолом, фильтруют его через складчатый фильтр, промывают эфиром и быстро (окисленный железный порошок не годится для опыта) просушивают на плитке из пористого керамического материала.
Железный порошок, тщательно смоченный 18 мл дистиллированной воды, рассеивают по стеклянной вате и заполняют ею все реакционное пространство термоскопа.
Для удаления из прибора воздуха через него продувают сильную струю кислорода. Наличие в приборе чистого кислорода устанавливают тем, что подносят тлеющую лучинку к выходному отверстию промывной склянки. Затем прекращают поступление кислорода и уравнивают жидкость в обеих трубках манометра (за манометром укрепляется миллиметровая бумага).
В реакционном сосуде кислород частично соединяется с железом, и уже через несколько минут наблюдают всасывание жидкости во внутреннюю трубку промывной склянки. В таком случае пропускают в термоскоп еще некоторое количество кислорода, чтобы выровнять уровни жидкости во внутренней и внешней трубках промывной склянки. Эту операцию повторяют два-три раза. Изменение давления, отмечаемое манометром, указывает на выделение тепла при окислении.
В разделе, посвященном фосфору, описаны опыты, показывающие медленное окисление белого фосфора.
Опыт. Каталитическое окисление метилового спирта в формальдегид. Реакция протекает по уравнению:
Н3С-ОН + 0.5O2 → Н2С=O + Н2O + 36 ккал.
Прибор собирают в соответствии с рис. 119. В колбу Вюрца емкостью 150 мл с оттянутым до диаметра 1 мм концом боковой трубки наливают 50 мл чистого метилового спирта. В тугоплавкую трубку длиной 25-30 см и диаметром 1 см вкладывают валик из медной сетки длиной 10 см, намотанной на толстую медную проволоку. В промывную склянку слева наливают воды, а в склянку справа перед самым началом опыта наливают бесцветный раствор сернистой кислоты Н2SO3 с фуксином. Стакан, в который опускают колбу Вюрца, должен содержать нагретую до 30-40° воду.
Для проведения опыта нагревают воду в стакане до 45-48°, при помощи водоструйного насоса просасывают через прибор сильный ток воздуха и нагревают валик из медной сетки горелкой Теклу, сначала слабым пламенем, затем доводят до красного каления.
Ток воздуха регулируют таким образом, чтобы после того, как уберут горелку, валик из медной сетки оставался раскаленным без подогревания извне.
Через некоторое время смесь сернистой кислоты с фуксином в правой промывной склянке окрашивается в интенсивный красно-фиолетовый цвет.
Параллельно показывают, что реакция раствора формальдегида с бесцветным раствором сернистой кислоты и фуксина является характерной для альдегида.
Для получения бесцветного раствора сернистой кислоты с фуксином растворяют 0,1 г фуксина в 300 мл дистиллированной воды и через полученный раствор пропускают сернистый газ до исчезновения окраски фуксина. Полученный реактив хранят в сосуде с притертой пробкой. Весь опыт длится около пяти минут. По окончании опыта дают прибору остыть в слабом токе воздуха.
При пользовании этиловым спиртом образуется ацетальдегид по уравнению:
CH3CH2-OH + 0.5O2 → CH3CH=O + H2O.
Восстановление окисленного валика из медной сетки метиловым спиртом описано в разделе, посвященном азоту (способ получения азота связыванием кислорода воздуха раскаленной медью).
Опыт. Анодное окисление, обесцвечивающее действие кислорода в момент его выделения. Стакан с раствором сульфата натрия накрывают пробочным кружком, сквозь который пропускают два угольных электрода диаметром 5-6 мм.
Анод обертывают несколько раз окрашенной в синий цвет хлопчатобумажной тканью и электроды соединяют с тремя последовательно включенными аккумуляторами.
После 2-3 минут пропускания тока первые два слоя ткани, непосредственно прилегающие к аноду, обесцвечиваются выделяющимся при электролизе атомарным кислородом. Второй и последующие слои ткани, через которые проходят уже устойчивые двухатомные молекулы кислорода, остаются окрашенными.
Опыт. Анодное окисление. Наливают в стакан 25%-ный раствор Н2SO4 и опускают в него два свинцовых электрода в виде пластин. Электроды соединяют с источником постоянного электрического тока напряжением 10 В. При замыкании цепи у анода появляется бурое окрашивание.
Электролиз продолжают до тех пор, пока станет видимой образовавшаяся на аноде двуокись свинца РbO2 бурого цвета.
Если пользоваться серебряным анодом, то на аноде выделяется черная окись серебра Ag2O.
Тушение огня. Зная, что собой представляет горение, легко понять, на чем основано тушение огня.
Огонь можно гасить твердыми веществами, газами и парами, жидкостью и пеной. Чтобы погасить очаг огня, следует изолировать его от воздуха (кислорода), для чего его и забрасывают песком, солью, землей или накрывают плотным покрывалом.
Часто при тушении пожаров пользуются огнетушителями, описание которых приводится в разделе, посвященном углекислому газу.
При тушении горящих дровяных складов, соломы, текстиля, бумаги пользуются так называемыми сухими огнетушителями, выбрасывающими твердый углекислый газ, имеющий температуру -80°C. В этом случае пламя гаснет из-за сильного снижения температуры и разбавления кислорода воздуха углекислым газом, не поддерживающим горения. Эти огнетушители удобны при пожарах на электростанциях, телефонных узлах, заводах по производству масел и лаков, спиртовых заводах и т.д.
Примером применения газов для тушения пожаров может служить использование сернистого газа, образующегося при сгорании бросаемой в печь или дымоход серы, для гашения загоревшейся в печном дымоходе сажи.
Наиболее распространенной и дешевой жидкостью для тушения пожаров является вода. Она понижает температуру пламени, а пары ее препятствуют доступу воздуха к горящим предметам. Однако водой не пользуются для гашения горящего масла, бензина, бензола, нефти и других горючих жидкостей легче воды, так как они всплывают на поверхность воды и продолжают гореть; применение воды в этом случае лишь способствовало бы распространению огня.
Для тушения бензина и масел пользуются пенообразующими огнетушителями; выбрасываемая ими пена остается на поверхности жидкости и изолирует ее от кислорода воздуха.
Без кислорода ни одно животное не может существовать.
Пропитанные жидким кислородом уголь, нефть, парафин, нафталин и ряд других веществ применяются для приготовления некоторых взрывчатых веществ.
Смеси жидкого кислорода с угольным порошком, древесной мукой, маслом и другими горючими веществами получили название оксиликвитов. Они обладают очень сильными взрывчатыми свойствами и применяются в подрывных работах.
В очень малых количествах озон содержится в атмосфере: у поверхности земли концентрация его составляет 10-7%, а на высоте 22 км от земной поверхности - 10-6%. На поверхности земли озон встречается главным образом у водопадов, на берегу моря (где он, как и атомарный кислород, образуется под влиянием ультрафиолетовых лучей), в хвойных лесах (здесь он образуется в результате окисления терпенов и других органических веществ); озон образуется при грозовых разрядах. На высоте около 22 км от земной поверхности он образуется из кислорода под влиянием ультрафиолетовых лучей солнца.
Озон получают из кислорода; при этом необходимо затратить внешнюю энергию (тепловую, электрическую, излучение). Реакция протекает по уравнению:
3О2 + 69 ккал ↔ 2O3.
Таким образом, превращение кислорода в озон является эндотермической реакцией, при которой происходит уменьшение объема газов.
Молекулы кислорода под влиянием тепловой, световой или электрической энергии распадаются на атомы. Являясь более реакционноспособными, чем молекулы, атомы вступают в соединение с недиссоциированными молекулами кислорода и образуют озон.
Количество образующегося озона тем больше, чем ниже температура, и почти не зависит от давления, при котором протекает реакция. Оно ограничено скоростями распада получившихся молекул озона и их образования в результате фотохимического действия (при электрических разрядах, под влиянием излучения кварцевых ламп).
При всех способах получения озона в условиях, близких к обычной температуре, характерным является низкий его выход (около 15%), объясняющийся неустойчивостью этого соединения.
Разложение озона может быть частичным (когда оно протекает самопроизвольно при обычной температуре; в этом случае оно пропорционально концентрации) и полным (в присутствии катализаторов).
Опыт. Получение озона действием концентрированной серной кислоты на перманганат калия. Уравнения реакций:
Образовавшийся согласно приведенным выше уравнениям марганцевый ангидрид Мn2O7 представляет собой тяжелую маслянистую жидкость зеленовато-бурого цвета, разлагающуюся при 40-50° на МnO2, МnO и атомарный кислород, который, соединяясь с молекулярным кислородом воздуха, образует озон.
Вместо ступки можно пользоваться фарфоровой чашкой, часовым стеклом или асбестовой плиткой.
Внесенный в атмосферу озона на кончике проволоки комок ваты, смоченный в эфире, немедленно воспламеняется. Вместо эфира вату можно смочить спиртом, бензином или скипидаром.
Смоченная водой иодкрахмальная индикаторная бумага окрашивается озоном в синий цвет. Это явление объясняется реакцией:
2КI + О3 + Н2О = I2 + 2КOН + О2.
Иодкрахмальную бумагу получают смачиванием полосок фильтровальной бумаги в смеси бесцветного концентрированного раствора иодида калия и крахмального раствора.
Синяя окраска иодкрахмальной бумаги постепенно исчезает, поскольку между иодом и гидратом окиси калия протекает реакция:
3I2 + 6КОН = КIO3 + 5KI + 3H2O.
В присутствии избытка озона свободный иод окисляется; при этом протекают реакции:
I2 + 5O3 + Н2O = 2НIO3 + 5О2,
I2 + 9O3 = I(IO3)3 + 9O2.
Опыт. Получение озона действием концентрированной азотной кислоты на персульфат аммония. Источником атомарного кислорода в этом опыте является надсерная кислота, образующаяся в результате реакции обмена между персульфатом аммония и азотной кислотой, а источником молекулярного кислорода — разлагающаяся при нагревании азотная кислота.
В основе этого способа получения озона лежат следующие реакции:
(NH4)2S2O8 + 2HNO3 = H2S2O8 + 2NH4NO3,

2HNO3 → 2NO2 + 0.5O2 + H2O,
O + O2 = O3.
Необходимый для опыта прибор показан на рис. 120. Небольшую колбочку, содержащую 2 г персульфата аммония и 10 мл концентрированной азотной кислоты, посредством шлифа соединяют со стеклянной трубкой, конец которой опускают в пробирку с раствором иодида калия и небольшим количеством крахмала.
Через некоторое время после начала нагревания колбы на слабом огне раствор в пробирке окрашивается в синий цвет. Однако в результате взаимодействия иода с гидратом окиси калия синий цвет вскоре исчезает.
0,5%-ный раствор индигокармина или 1%-ный раствор индиго в концентрированной Н2SO4 изменяет цвет от синего до бледно-желтого из-за окисления озоном индиго в изатин по уравнению:
С16Н10О2N2 + 2O3 ← 2С8Н5O2N + 2O2 + 63,2 ккал.
Вместо колбочки в этом опыте можно пользоваться пробиркой с газоотводной трубкой.
Опыт. Получение озона при самоокислении влажного белого фосфора. Медленное окисление белого фосфора кислородом воздуха протекает в две стадии. Сначала образуется фосфористый ангидрид и озон, а затем фосфористый ангидрид окисляется до фосфорного ангидрида.
Предварительно очищенный под водой от поверхностной пленки белый фосфор кладут при помощи металлических щипцов в стеклянный цилиндр емкостью 1,5-2 л.
Наливают в цилиндр дистиллированной воды столько, чтобы она на 2/3 покрывала фосфорные палочки, и ставят его в кристаллизатор с водой, нагретой до 25°.
место цилиндра можно воспользоваться колбой емкостью 500 мл, в которой фосфор можно нагреть до его плавления (приблизительно до 44°) при непрерывном взбалтывании.
Присутствие озона обнаруживают приблизительно через два часа после начала опыта по характерному, напоминающему чеснок запаху и индикаторной иодкрахмальной бумагой; обнаружить озон можно приливанием в пробирку с взятым из цилиндра раствором нескольких капель сульфата титанила.
Сульфат титанила получают нагреванием под тягой в фарфоровой чашке 1 г двуокиси титана с двойным объемом концентрированной серной кислоты до начала выделения белых паров. После охлаждения содержимое чашки постепенно вводят в 250 мл ледяной воды. В воде сульфат титана Ті(SO4)2 переходит в сульфат титанила.
В присутствии озона бесцветный раствор сульфата титанила переходит в желто-оранжевый раствор пертитановой кислоты, реакция протекает по уравнению:
ТіOSO4 + O3 + 2Н2O = Н2ТiO4 + O2 + Н2SO4.
O + O2 = O3.
В зависимости от условий (плотности тока и температуры) на аноде образуются надсерная кислота, озон и молекулярный кислород.
При электролизе подкисленной воды озон образуется в том случае, когда анод сделан из неокисляющегося металла, а вода не содержит веществ, способных поглощать кислород.
Прибор собирают в соответствии с рис. 121. В стакан емкостью 150 мл наливают 100 мл 20-50%-ного раствора серной кислоты, в которую погружают катод, сделанный из свинцовой пластинки (25 х 10 мм), и анод, которым служит платиновая проволока диаметром 0,5 мм, впаянная в стеклянную трубку длиной 9 см и диаметром 5 мм. Проволоку впаивают таким образом, чтобы свободный конец ее выходил из трубки на 1 см. Платиновую проволоку соединяют с внешним проводом при помощи нескольких капель ртути, вводимых в трубку. Анод сквозь парафинированную корковую пробку вводят в открытую трубку длиной 9 см и диаметром 1,5 см, которая в верхней части имеет боковую трубочку.
После замыкания электрической цепи, при силе тока в 1,5 А, у отверстия боковой трубочки по запаху или при помощи иодкрахмальной бумаги можно обнаружить озон.
Если пользоваться платиновым анодом и применять охлаждение электролизера до -14°, озон в небольшом количестве можно получить и при электролизе разбавленной Н2SO4.
Озон получают также и электролизом хромовой, уксусной, фосфорной и фтористоводородной кислот.
При соединении проводов эвдиометра с вторичными клеммами индукционной катушки между платиновыми проволочками проскакивают искры и подкрахмаленный раствор иодида калия начинает окрашиваться в синий цвет. Окисление озоном раствора иодида усиливается при его взбалтывании.
Вместо эвдиометра Бунзена можно пользоваться прибором, указанным на рис. 122, изготовленным из толстого стекла. Этот прибор мог бы озонировать весь введенный кислород, если бы не происходило нагревания при искровых разрядах, ускоряющего обратную реакцию разложения озона.
Раствор иодида калия с добавкой крахмала готовят следующим образом: растирают в ступке 0,5 г крахмала в небольшом количестве воды, полученное тесто вводят при помешивании в 100 мл кипящей воды; после остывания крахмального раствора в него добавляют предварительно растворенные в небольшом количестве воды 0,5 г КI.
При пропускании тока чистого и сухого кислорода (воздуха) через озонатор под действием тихого электрического разряда электрических разрядов без искр) некоторая часть кислорода {максимум 12-15% по объему) превращается в озон.
Влажным и пыльным воздухом для этой цели пользоваться нельзя, так как при электрических разрядах в этом случае образуется густой туман, оседающий на электродах и стеклянных стенках озонатора; в результате вместо тихих разрядов в озонаторе начинают проскакивать искры, и образуется окись азота; окись азота в присутствии кислорода окисляется до двуокиси азота, разрушающей электроды.
Источником кислорода может быть газометр или кислородный баллон; поступающий в озонатор кислород предварительно пропускают через промывную склянку с концентрированной Н2SO4.
Под действием таких электрических разрядов в пространстве, занятом кислородом, образуются ионы и электроны, вызывающие при столкновении с молекулами кислорода их распад.
Присутствие озона обнаруживают описанными выше способами, а также способами, указанными при описании свойств озона.
Ниже приводятся описания некоторых типов озонаторов.
Озонатор Верховского (рис. 123) состоит из стеклянной трубки длиной 40-50 см и диаметром 2 см, закрытой с обеих сторон парафинированными корковыми пробками (резиновые разрушаются озоном). Через центр одной из пробок пропущена прямая железная проволока, проходящая вдоль оси трубки, и стеклянная трубка, по которой поступает в озонатор сухой кислород. Через вторую трубку пропущена еще одна стеклянная трубка, служащая для удаления газа из озонатора; эта же трубка служит опорой для второго конца проходящей через озонатор железной проволоки.
Снаружи трубка озонатора должна быть обмотана железной или медной проволокой (диаметр спирали 2-2,5 см); она может быть также оклеена оловянной, алюминиевой или свинцовой фольгой.
Концы внутренней проволоки и наружной спирали присоединяют к полюсам индукционной катушки (Румкорфа).
Пользоваться катушкой очень высокого напряжения не рекомендуется; катушка должна быть средней, дающей искры длиной 5-10 см.
Учитывая высокое напряжение, при работе с озонатором необходимо соблюдать осторожность. Ток включают только на время, необходимое для получения озона.
Питание электрическим током производят при помощи толстого медного провода; во избежание соприкосновения провода с поддерживающим озонатор штативом провод должен быть тщательно изолирован.
Озонатор Бертло (рис. 124) состоит из широкой трубки с с припаянными к ней двумя стеклянными трубками а и b, по которым кислород поступает в прибор и удаляется из него. К трубке с припаивают либо присоединяют на шлифе входящую в нее более узкую трубку d. В трубку d наливают подкисленную серной кислотой воду. Один из проводов погружают во внутреннюю трубку d, а второй — в сосуд е. Погружаемый в сосуд е провод может иметь форму прямого стержня или спирали.
При действии прибора через трубку а кислород поступает в озонатор, а через b удаляется из него.
Для прибора необходима индукционная катушка, дающая ток в 0,05 А, напряжением 8000-10000 В.
Озонатор Сименса (рис. 125). В основу его положен шариковый стеклянный водяной холодильник с активной длиной 50 см.
После того как один конец внутренней трубки будет закрыт резиновой пробкой, заполняют внутреннюю трубку водой, подкисленной серной кислотой, и закрывают ее также резиновой пробкой, через которую должна быть пропущена толстая медная проволока, доходящая до первого шарика. Пробку закрывают таким образом, чтобы в трубке не осталось пузырьков воздуха.
Внешнюю трубку холодильника обертывают оловянной (или алюминиевой) фольгой, на которую наматывают спираль из чистой медной проволоки. Конец спирали и пропущенной во внутреннюю трубку медной проволоки соединяют с индукционной катушкой, питаемой источником постоянного тока 4-6 А и создающей напряжение 30000-50000 В.
При помощи двух стеклянных палочек длиной 25 см и толщиной 8-10 мм, один конец которых загнут в виде крючка, а другой укреплен в зажиме штатива, озонатор подвешивают в горизонтальном положении.
Промывную склянку соединяют с источником кислорода и озонатором при помощи резиновых трубок, в которые встык должны быть вставлены стеклянные трубки. Вторую боковую трубку холодильника при помощи парафинированной корковой пробки соединяют с согнутой стеклянной трубкой, проходящей в нескольких сантиметрах от холодильника.
Выпускаются серийные озонаторы, в которых серная кислота заменена металлической фольгой. Прибор состоит из стеклянной или фарфоровой трубки, оклеенной снаружи металлической фольгой; внутри трубки находится закрытый пустой металлический цилиндр. Иногда применяют целые батареи, состоящие из 6-8 соединенных последовательно озонаторов. Трубки, по которым проходит озон, делают из неокисляемого материала.
Образование озона ощущается по характерному чесночному запаху и устанавливается индикаторной иодкрахмальной бумагой, которую следует подносить сухими деревянными щипцами.
Образование озона вокруг излучающих ультрафиолетовые лучи кварцевых ламп объясняется фотохимическими реакциями. Каждый квант ультрафиолетового излучения с длиной волны 2090 Å может привести к образованию двух молекул озона. По закону эквивалентности Эйнштейна каждый поглощенный квант света способен активизировать одну молекулу кислорода.
В манометр наливают такое количество слегка подкрашенной индиго концентрированной серной кислоты, чтобы она приблизительно наполовину заполнила короткое колено трубки. Уровень Н2SO4 перед началом опыта в обеих трубках должен быть одинаков. В манометр не наливают ртути, так как при соприкосновении с озоном она вступает с ним в химическую реакцию.
Из озонатора удаляют воздух продуванием сильного тока чистого и сухого кислорода, закрывают кран слева и присоединяют к отводной трубке широкую трубку с манометром.
Отмечают уровень Н2SO4 в манометре и включают ток.
Через некоторое время изменение уровня серной кислоты в манометре указывает на уменьшение объема газа.
При проведении этого опыта нельзя пользоваться резиновыми пробками и трубками, так как резина сильно поглощает озон.
Озон можно выделить из смеси его с кислородом сжижением и дробной перегонкой.
В воде озон плохо растворяется, поэтому его можно собирать в ссуды, применяя способ вытеснения воды. Если газоотводную трубку озонатора опустить в стакан с водой, то можно заметить распространение запаха озона.
Сероуглерод СS2 растворяет озон, при этом раствор окрашивается в синий цвет. Самым лучшим растворителем озона является четыреххлористый углерод ССI4, один объем которого поглощает три объема озона; в этом случае растворение также сопровождается окрашиванием жидкости в синий цвет.
Температура кипения озона -112,5°; температура плавления -251,4°.
При охлаждении озона до -112,5° он превращается в жидкость сине-фиолетового цвета, взрывающуюся при взбалтывании, поэтому с ней следует обращаться очень осторожно. Удельный вес озона равен 1,78; жидкий озон с кислородом смешивается не в любых соотношениях и очень легко выделяется из смеси.
При охлаждении до -251,4° озон превращается в кристаллы темно-фиолетового цвета, взрывающиеся при простом прикосновении к ним.
Озон является сильным окислителем. Нормальный окислительный потенциал его Е0 = +1,90 B. Он реагирует при обычной температуре с теми веществами, с которыми кислород реагирует только при высокой температуре.
Об окислении озоном индикаторной иодкрахмальной бумаги (или иодкрахмального раствора иодида калия), сульфата титанила ТiOSO4 и индиго сказано в разделе получения озона.
Опыт. Обесцвечивание лакмуса. При пропускании озона через синий или красный раствор лакмуса наблюдается обесцвечивание раствора из-за окисления лакмуса.
Опыт. Окисление ртути озоном. В пробирку со слегка подогретой ртутью пропускают через тонкую совершенно сухую стеклянную трубочку озон. Некоторое время спустя на поверхности ртути образуется тонкий слой черной закиси ртути, которая при встряхивании прилипает к стенкам пробирки.
Если пропускать озон через ртуть, то последняя окисляется и теряет подвижность; при опрокидывании пробирки ртуть остается на ее стенках.
Опыт. Окисление серебра озоном. Реакция протекает по уравнению:
4Аg + 2O3 → 2Аg2O + 2O2.
К отверстию стеклянной трубки, по которой поступает озонированный кислород, при помощи щипцов подносят серебряную пластинку. Через некоторое время серебро окисляется, в результате чего на пластинке появляется темно-коричневое пятно.
Затем пластинку переносят в пламя с температурой 950° (не выше, чтобы не расплавился металл!) и наблюдают, что происходит с пятном.
Опыт. Окисление озоном гидрата окиси свинца. Уравнение реакции:
Рb(ОН)2 + O3 = РbО(ОН)2 + O2.
Если перед отверстием узкой стеклянной трубочки, по которой поступает озонированный кислород, подержать полоску фильтровальной бумаги, содержащей осадок гидрата окиси свинца, то индикаторная бумага окрашивается в коричневый цвет в результате окисления гидрата окиси двухвалентного свинца.
Гидрат окиси свинца получают взаимодействием 0,5 М раствора ацетата свинца и разбавленною раствора NaОН (или КОН).
Опыт. Окисление озоном сульфида свинца до сульфата. Уравнение реакции:
РbS + 4O3 = РbSO4 + 4O2.
Фильтровальную бумагу, смоченную раствором ацетата свинца, держат до ее почернения над склянкой с раствором сероводорода, а затем подносят к узкой трубочке, по которой поступает озонированный кислород.
Под влиянием окисления озоном темный цвет сульфида свинца исчезает; однако бумага снова чернеет под действием сероводорода.
Опыт. Окисление резины озоном. При пропускании через узкую резиновую трубку озонированного кислорода озон, окисляя резину, разрушает ее макромолекулярное строение; на трубке появляются продольные трещины, и она начинает распадаться на куски.
Кроме резины, озон окисляет и другие органические соединения с двойной связью; окислению подвергаются жиры, корковые пробки и т.п.
Поэтому краны приборов, применяемых для получения озона, никогда не смазывают жирами, а при сборке прибора пользуются парафинированными корковыми пробками.
Опыт. Реакция Арнольда. Если поднести к отверстию узкой стеклянной трубки, из которой поступает озонированный кислород, полоску фильтровальной бумаги, смоченной раствором тетраметилдиаминодифенилметана в метиловом спирте, бумага окрашивается в фиолетовый цвет.
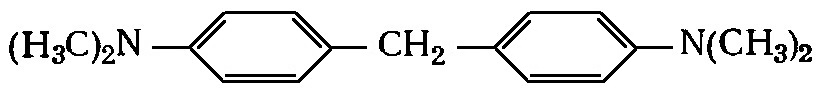
Для наглядного сравнения полоски фильтровальной бумаги, смоченной тем же раствором, держат над склянкой с хлорной водой (окрашивается в синий цвет), над склянкой с бромной водой (синий цвет), над пробиркой с раствором уксусной кислоты и нитрита натрия (желтый цвет) и над пробиркой с перекисью водорода (не окрашивается).
Опыт. Окисление озоном железистосинеродистого калия. Реакция протекает по уравнению:
2К4[Fе(СN)6] + Н2O + O3 = 2К3[Fе(СN)6] + 2КОН + O2.
При пропускании озонированного кислорода через желтый раствор железистосинеродистого калия происходит окисление озоном и окраска становится красновато-коричневой.
При работающем озонаторе с помощью индикаторной иодкрахмальной бумаги устанавливают присутствие озона. Если узкую стеклянную трубку нагревать, то присутствие озона не обнаруживается.
Опыт. Каталитическое разложение озона. Отводную трубку какого-либо озонатора (например, озонатора Сименса) при помощи узкой стеклянной трубки и двух парафинированных корковых пробок соединяют со стеклянной трубкой длиной 20 см и диаметром 12 мм, как показано на рис. 127.
Вводя в широкую трубку попеременно слой стеклянной ваты с порошком двуокиси марганца или свинца (10 см) или слой активированного гранулированного угля, убеждаются, что, проходя через них, озон разлагается.
Разложение озона сопровождается выделением тепла и увеличением объема газа.
O2 + 2Н → Н2O2 + 138 ккал.
Прибор собирают в соответствии с рис. 128. Электролитической ванной служит стакан емкостью 250-300 мл, заполненный серной кислотой (уд. вес 1,2-1,25) и накрытый асбестовой пластинкой.
Сквозь пластинку пропускают анод и стеклянный цилиндр диаметром 3 см, внутри которого находится катод, а также стеклянную трубку, по которой из газометра или баллона поступает чистый кислород. Подающая кислород трубка с оттянутым кончиком проходит снизу под цилиндр и заканчивается у самого катода.
Вблизи анода в асбестовой пластинке проделывают еще одно отверстие для удаления кислорода, выделяющегося у анода.
Анодом служит платиновая пластинка, расположенная на более высоком уровне по сравнению с катодом. Катод изготовляется из платиновой или палладиевой пластинки.
Источником электрической энергии является батарея аккумуляторов напряжением 10 В.
После сборки прибора берут пипеткой из анодного пространства 10 мл электролита, выливают его в стакан и добавляют несколько капель раствора сульфата титанила. Никакого окрашивания в этом случае не происходит.
Через 5-10 минут после начала электролиза при силе тока 4-5 А и пропускании сильной струи кислорода выключают ток и берут пробу электролита. На этот раз при добавлении сульфата титанила электролит окрашивается в желто-оранжевый цвет; это объясняется образованием пероксодисульфатотитановой кислоты:
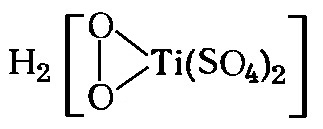
При более длительном электролизе пробы на сульфат титанила дают более интенсивное окрашивание. При этом имеют место следующие реакции:
а) TiОSO4 + Н2O2 + Н2O = Н2ТiO4 + Н2SO4,
б) TiОSO4 + Н2O2 + Н2SO4 = Н2[ТiО2(SO4)2] + Н2O.
Опыт. Получение перекиси водорода действием на щелочные перекиси (Na2O2 или К2O2) разбавленных кислот. Реакция протекает по уравнениям:
Na2O2 + Н2SO4 = Н2O2 + Nа2SO4,
К2O2 + Н2SO4 = Н2O2 + К2SO4.
Опыт проводят в пробирке. Получение этим способом перекиси водорода не очень удобно из-за трудности ее отделения от щелочных сульфатов.
Нельзя также рекомендовать получение перекиси водорода действием воды на щелочные перекиси, так как в этих реакциях перекись водорода является только промежуточным соединением, которое в присутствии щелочей разлагается на кислород и воду; поэтому реакция взаимодействия щелочных перекисей и воды лежит в основе одного из мокрых способов получения кислорода.
Опыт. Получение перекиси водорода из перекиси бария действием серной кислоты. Уравнение реакции:
ВаO2 + Н2SO4 = Н2O2 + ВаSO4.
В стакан наливают 120 мл воды, добавляют 5 мл концентрированной Н2SO4 (уд. вес 1,84) и погружают его в кристаллизатор со смесью льда и соли. Положив в стакан немного льда при 0°С, постепенно при непрерывном помешивании добавляют суспензию перекиси бария, которую получают растиранием в ступке 15 г ВаO2 с 30 мл ледяной воды. Суспензия является гидратом перекиси бария ВаO2•8Н2O.
После отфильтрования сульфата бария получают 3-5%-ный раствор перекиси водорода. Небольшой избыток кислоты не мешает получению перекиси.
Присутствие перекиси водорода открывают следующим образом: наливают в пробирку 2 мл испытываемого раствора и 2 мл Н2SO4, приливают эфира (слой толщиной 0,5 см) и добавляют несколько капель раствора хромата калия. В присутствии перекиси водорода в кислой среде хроматы (а также и бихроматы) образуют интенсивно окрашенные надхромовые кислоты, при этом протекает реакция:
Н2Сr2O7 + 4Н2O2 = 2Н2CrO6 + 3Н2O.
Надхромовая кислота Н2CrO6 со структурной формулой
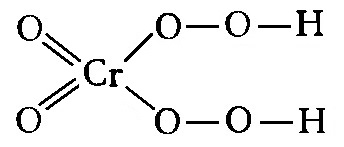
окрашена в синий цвет и разлагается уже при комнатной температуре; поэтому окраска раствора быстро исчезает. Эфир экстрагирует кислоту из раствора при встряхивании и делает ее более устойчивой.
Перекисные соединения хрома восстанавливаются до соединений трехвалентного хрома (зеленого цвета) с выделением кислорода.
Опыт. Перекись водорода можно также получить при гидролизе пербората натрия и перкарбоната бария. При этом реакция протекает по уравнениям:
NaBO3 + Н2O = NaBO2 + Н2O2,
ВаС2O6 + Н2O = ВаСO3 + СO2 + Н2O2.
В максимальной концентрации — это сиропообразная жидкость с удельным весом 1,5. В толстом слое имеет голубой цвет.
В воде, этиловом спирте, этиловом эфире растворяется в любых соотношениях. В продаже перекись водорода обычно встречается в виде 3%-ного и 30%-ного раствора в дистиллированной воде. Последний носит название «пергидроль». Под давлением 26 мм рт. ст. кипит при 69,7°. Затвердевает при -2°.
Более устойчивыми являются разбавленные растворы перекиси водорода; что касается концентрированных растворов, то они разлагаются со взрывом по уравнению:
2Н2O2 = 2Н2O + O2 + 47 ккал.
Разложению перекиси водорода благоприятствуют свет, тепло, некоторые неорганические и органические вещества, шероховатость стекла и следы пыли.
Из неорганических веществ перекись водорода разлагают окислы (MnO2, Fe2O3, Cr2O3), щелочные гидраты окислов NaOH, КОН, Ва(ОН)2 в присутствии примесей, гидратированные соли ионов Cu2+, Со3+, Pb2+, Mn2+ и др., ионы трехвалентных металлов Fe3+, Al3+, металлы в сильно измельченном, особенно в коллоидальном, состоянии (Au, Ag, Pt), соединения кремния, в том числе и входящие в состав стекла.
К органическим веществам, разлагающим перекись водорода, относится кровь, активизирующая разложение благодаря содержащемуся в ней ферменту каталазе, тогда как другой ее фермент, пероксидаза, содействует отщеплению от перекиси кислорода в присутствии окисляющихся веществ.
Каталитическое разложение Н2O2 в присутствии щелочей, двуокиси марганца и коллоидного раствора серебра описано в разделе «Получение кислорода мокрыми способами».
Опыт. Разложение перекиси водорода под влиянием тепла. Колбу емкостью 200-250 мл наполняют почти полностью раствором перекиси водорода; закрывают пробкой с газоотводной трубкой, кончик которой опускают в кристаллизатор с водой (рис. 129). После удаления из прибора воздуха нагревают колбу и собирают в наполненный водой цилиндр выделяющийся кислород.
Ток кислорода регулируют усилением или ослаблением нагревания колбы.
Присутствие кислорода открывают с помощью тлеющей лучинки.
Опыт. Каталитическое разложение перекиси водорода. В три рюмки наливают примерно одинаковое количество пергидроля (30%-ного раствора перекиси водорода). В первую рюмку добавляют двуокиси марганца, во вторую — платиновой черни, а в третью — несколько капель крови.
Лучше всего идет разложение в третьей рюмке, куда была добавлена кровь. Если к крови добавить цианистого натрия, а затем пергидроля, кислород выделяется слабо.
Экспериментально установлено, что коллоидная платина и каталаза отравляются одними и теми же веществами, например HCN, KCN, NaCN, СО, I2, Н2S, СS2 и др. Отравление катализаторов объясняется тем, что их большая поверхность адсорбирует значительное количество отравляющих веществ. В этом случае отравляющие вещества изолируют активную поверхность катализатора от реагирующего вещества и катализатор теряет способность ускорять реакцию.
Опыт. Каталитическое разложение перекиси водорода в щелочной среде. Для получения светящейся в темноте воды готовят четыре раствора:
Когда глаза приспособятся к темноте, вливают в стакан пергидроль при непрерывном помешивании. Жидкость начинает как бы кипеть, пенится и светится желто-оранжевым светом, переливаясь блестящей пеной.
Выделение света при химических реакциях, протекающих без заметного выделения тепла, называется хемилюминесценцией. Выделяющийся при хемилюминесценции свет чаще всего бывает красного или желтого цвета. В настоящем опыте хемилюминесценция объясняется окислением пирогаллола перекисью водорода в щелочной среде. Выделяемая при окислении энергия почти целиком преобразуется в световую, хотя небольшое ее количество выделяется и в виде тепловой энергии, которая нагревает содержимое стакана и вызывает частичное испарение формальдегида (распространяется резкий запах).
Вместо пирогаллола можно пользоваться гидрохиноном, резорцином или фотографическими проявителями.
Перекись водорода можно сделать более устойчивой, если добавить к ней небольшое количество одного из следующих веществ (стабилизаторов): барбитуровой, мочевой, фосфорной, серной кислот, фосфата натрия, мочевины, фенацетина и др.
Перекись водорода — очень слабая кислота (слабее угольной). Кислотные свойства ее можно установить при помощи нейтрального раствора лакмуса.
Перекиси водорода соответствуют два вида солей: гидроперекиси (NaHO2, КНO2) и перекиси (Na2O2, К2O2, ВаO2).
В химических реакциях перекись водорода может выступать как в роли окислителя, так и в роли восстановителя.
Иногда очень незначительное изменение рН приводит к радикальному изменению окислительно-восстановительной функции перекиси водорода. В качестве примера можно привести следующие реакции:
I2 + 5Н2O2 → 2НIO3 + 4Н2O; при рН1 Н2O2 окислитель,
2НIO3 + 5Н2O2 → I2 + 6Н2O + 5O2; при рН2 Н2O2 восстановитель.
Как окислитель перекись водорода распадается следующим образом:
H–O–O–H → H–O–H + O.
(выделяющиеся атомы кислорода реагируют с восстановителем, переходя в отрицательно заряженный двухвалентный кислород).
Опыт. Окисление перекисью водорода иона двухвалентного железа в ион трехвалентного железа. Уравнение реакции:
2FeSO4 + Н2SO4 + Н2O2 = Fe2(SO4)3 + 2Н2O.
В пробирку со свежеприготовленным зеленым раствором FeSO4 приливают разбавленной серной кислоты и 3%-ного раствора перекиси водорода. Благодаря окислению двухвалентного иона железа в трехвалентный цвет раствора изменяется и становится желтым. Присутствие трехвалентного иона железа можно установить с помощью иона роданида, так как роданид трехвалентного железа интенсивно окрашен в кроваво-красный цвет (реакция очень чувствительна).
Опыт. Окисление перекисью водорода сернистой кислоты (сульфитов) в серную кислоту (сульфаты). Реакция протекает по уравнению:
H2SO3 + Н2O2 = Н2SO4 + Н2O.
Если к водному раствору сернистого газа (сернистой кислоты) добавить перекиси водорода, то сернистая кислота окисляется в серную.
Для того чтобы убедиться в образовании серной кислоты, можно воспользоваться тем, что ВаSО3 растворяется в минеральных кислотах, в то время как ВаSO4 в них мало растворим.
Опыт. Окисление перекисью водорода железистосинеродистого калия. Уравнение реакции:
2К4[Fe(СN)6] + Н2O2 + Н2SO4 = 2К3[Fe(CN)6] + 2Н2O + К2SO4.
Если в пробирку с желтым раствором железистосинеродистого калия добавить немного разбавленной Н2SO4 и 3%-ного раствора Н2O2, то раствор в пробирке окрашивается в буро-красный цвет, характерный для железосинеродистого калия.
Опыт. Окисление перекисью водорода сернистого свинца. Реакция протекает по уравнению:
PbS + 4Н2O2 = РbSO4 + 4Н2O.
К раствору Рb(NО3)2 [или Рb(СН3СОО)2] добавляют водного раствора сероводорода; выпадает черный осадок сернистого свинца. Реакция идет по уравнению:
Pb(NO3)2 + Н2S = РbS + 2HNO3.
К тщательно промытому декантацией осадку сернистого свинца добавляют 3%-ного раствора перекиси водорода; окисляясь в сульфат свинца, осадок становится белым.
На этой реакции основано обновление почерневших от времени картин (из-за образования на них сернистого свинца).
Опыт. Окисление перекисью водорода индиго. При кипячении в пробирке 5-6 мл разбавленного раствора индиго и 10-12 мл 3%-ного или более крепкого раствора перекиси водорода наблюдается обесцвечивание раствора индиго.
2KCrO2 + 2КОН + 3Н2O2 = 2К2СrO4 + 4Н2O.
К зеленому раствору хромита щелочного металла приливают перекиси водорода; происходит окисление хромита в хромат, и раствор становится желтым.
Хромит щелочного металла получают действием щелочи (в избытке) на раствор соединения трехвалентного хрома (см. окисление бромной водой в щелочной среде).
Опыт. Окисление перекисью водорода солей двухвалентного марганца. Уравнение реакции:
МnSO4 + 2NaОН + Н2О2 = Н2МnO3 + Nа2SO4 + Н2O.
К бесцветному (или слабо розовому) раствору какого-либо соединения двухвалентного марганца приливают щелочь. Выпадает белый осадок гидрата закиси марганца, который даже в присутствии следов кислорода окисляется в гидрат двуокиси марганца, и осадок становится бурым.
Гидрат закиси в присутствии гидрата двуокиси марганца образует окись марганца.
Описанные выше реакции протекают следующим образом:
МnSO4 + 2NaОН = Мn(ОН)2 + Nа2SO4,
Мn(ОН)2 + 1/2O2 = Н2МnO3 или МnО(ОН)2,
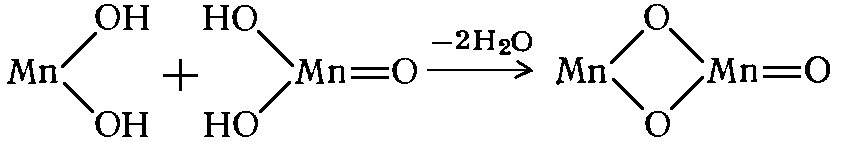
В присутствии перекиси водорода окисление гидрата закиси в гидрат двуокиси марганца протекает очень быстро.
При нагревании окисление солей двухвалентного марганца перекисью водорода идет до образования двуокиси марганца по уравнению:
МnSO4 + Н2O2 + 2КОН = МnO2 + К2SO4 + 2Н2O.
В целом ряде реакций перекись водорода служит восстановителем как в щелочной, так и в кислой среде.
Как восстановитель перекись водорода разлагается следующим образом:
H–O–O–H → 2H + O=O.
Так как перекиси могут быть как окислителями, так и восстановителями, электроны перекисей могут переходить от одной молекулы к другой:
Н2O2 + Н2O2 = O2 + 2Н2O.
Восстановление перекисью водорода КМnO4 и МnO2 в кислой среде и К3[Fe(СN)6] в щелочной среде описано в разделе получения кислорода мокрым способом.
Опыт. Восстановление перекисью водорода темно-бурой окиси серебра до металлического серебра. Реакция протекает по уравнению:
Ag2O + Н2O2 = 2Ag + Н2O + O2.
Наливают в пробирку 2 мл разбавленного раствора АgNO3, 4-6 мл 3%-ного раствора Н2O2 и 2-3 мл разбавленного раствора NaОН. Образуется черный осадок металлического серебра по суммарному уравнению реакции:
2AgNO3 + 2NaОН + Н2O2 = 2Ag + 2NаNО3 + 2Н2O + O2.
При действии щелочей на растворы солей серебра вместо неустойчивого гидрата окиси серебра выпадает темно-коричневый осадок окиси серебра (это свойство характерно и для гидратов окисей других благородных металлов).
В избытке щелочей окись серебра нерастворима.
Опыт. Восстановление перекисью водорода соединений золота. Восстановление может протекать как в кислой, так и в щелочной среде.
В пробирку с небольшим количеством раствора хлорного золота добавляют немного раствора щелочи и 3%-ного раствора перекиси водорода. Происходит мгновенное восстановление иона трехвалентного золота до свободного золота:
2АuСl3 + 3Н2O2 + 6КОН = 2Аu + 6Н2O + 3O2 + 6КСl.
Опыт. Восстановление перекисью водорода гипохлоритов и гипобромитов. Уравнения реакций:
КСlO + Н2O2 = КСl + H2O + O2,
NaСlO + Н2O2 = NаСl + Н2O + O2,
NaBrO + Н2O2 = NаВr + Н2O + O2,
СаОСl2 + Н2O2 = СаСl2 + Н2O + O2.
Эти реакции лежат в основе пробирочных опытов получения кислорода.
Продукты присоединения перекиси водорода. Таким веществом является пергидроль — продукт присоединения перекиси водорода к мочевине [K1]:
Это соединение в кристаллическом состоянии стабилизируется следами лимонной кислоты. При простом растворении в воде образуется перекись водорода.
Хранение перекиси водорода. Перекись водорода хранят в темном и холодном месте в парафиновых (или стеклянных парафинированных внутри) сосудах, закупоренных парафиновой пробкой.
По сравнению с хлором перекись водорода как отбеливающее средство обладает большими преимуществами. Она применяется для производства перборатов (например, пербората натрия, являющегося активно действующим веществом в отбеливающих препаратах).
Сильно концентрированные растворы перекиси водорода (85-90%) в смеси с некоторыми горючими веществами применяются для получения взрывчатых смесей.
Самой чистой природной водой является вода атмосферных осадков, самой загрязненной примесями является вода морей и океанов. По своей природе примеси могут быть неорганическими и органическими. В воде они могут находиться в растворенном и во взвешенном состоянии.
Примесями воды, являются: свободный углекислый газ, азот, кислород, СаСО3, Ca(HCO3)2, MgCO3, CaSO4, MgSO4, хлориды щелочных металлов, кремневая кислота и ее соли щелочных и щелочноземельных металлов, окислы железа, алюминия, марганца, соли щелочных и щелочноземельных металлов азотной, азотистой и фосфорной кислот, микроорганизмы и различные органические вещества в коллоидном состоянии.
Минеральные воды, кроме этих примесей, содержат сероводород, сульфаты, соли борной, мышьяковой, фтористоводородной, бромистоводородной, иодистоводородной и других кислот.
Вода, содержащая бикарбонаты и сернокислые соли щелочноземельных металлов, называется жесткой.
Опыт. При помощи иона Ва2+ устанавливают в любой природной воде присутствие ионов SO42-, при помощи иона Ag+ — присутствие иона Cl-, а выпариванием в чашке 500 мл воды — наличие сухого остатка.
Воду можно получить при нагревании веществ, содержащих кристаллизационную воду, например: СuSO4•5Н2O, Nа2СO3•10Н2О, Nа2В4О7•10Н2О, Na2SО4•10Н2О, FеSO4•7Н2O; в качестве побочного продукта она образуется при реакциях нейтрализации, окислительно-восстановительных и других реакциях.
Для получения больших количеств химически чистой воды не пользуются ни одним из описанных выше способов ее получения, а прибегают к очистке различными способами очень распространенной природной воды.
Для удержания примесей, сообщающих воде жесткость, воду пропускают через пермутитовые фильтры, а для освобождения от красящих веществ — через активированный уголь.
Удаление растворенных в воде примесей достигается в процессе дистилляции. На рис. 130 изображен простейший прибор для дистилляции, состоящий из колбы Вюрца, холодильника и приемника.
Чтобы не разбирать каждый раз прибор и избежать соединений при помощи пробок, рекомендуется пользоваться прибором, изготовляемым из иенского стекла (рис. 131).
Равномерное кипение при дистилляции достигается благодаря тому, что в колбу предварительно помещают немного пористого фарфора.
Полученная таким способом вода содержит в растворенном состоянии газы, например СО2, и очень небольшое количество силикатов (образующихся в результате растворения стекла холодильника конденсатом воды).
Для удаления газов (например, СО2) наливают 750 мл дистиллированной воды в колбу емкостью 1000 мл, бросают в нее несколько кусочков капиллярных трубок и кипятят в течение 30-40 минут. По окончании кипячения закрывают колбу пробкой, в которую вставляют трубку с натронной известью (смесью СаО и NaОН). Натронная известь поглощает углекислый газ из воздуха, который может попасть в дистиллированную воду после ее охлаждения.
Поскольку в химической лаборатории на приготовление растворов и промывку осадков расходуется большое количество дистиллированной воды, ниже описываются несколько аппаратов непрерывной дистилляции.
Перегонный аппарат Калещинского (рис. 132) состоит из реторты с боковым тубусом и изогнутой шейкой, соединенной со спиральным холодильником.
Постоянный уровень воды в реторте и холодильнике поддерживается при помощи сифона.
Перед началом опыта через боковую трубку, на которую должна быть надета резиновая трубка, засасывают в сифон воду и закрывают резиновую трубку зажимом или плотно вставляют в нее стеклянную палочку.
Чтобы обеспечить равномерное кипение, перед началом перегонки в реторту кладут несколько кусочков пористого фарфора, а к концу боковой трубки сифона присоединяют колбу, в которую будут собираться пузырьки воздуха, попавшие в сифон при нагревании воды (пузырьки воздуха в сифоне могут нарушить нормальное питание реторты водой).
Этот небольшой аппарат может действовать непрерывно довольно длительное время, не требуя специального ухода.
Перегонный аппарат Верховского (рис. 133). Описание прибора: широкая трубка А служит для собирания пузырьков воздуха, выделяющихся из воды при ее нагревании. Она при наполнении сифона В, С, D почти полностью наполняется водой. Склянка F с отрезанным дном закрыта пробкой с пропущенной через нее трубкой Е (для удаления из склянки излишней воды). Все части аппарата соединяются между собой при помощи резиновых пробок и трубок. Вода из водопроводного крана попадает в холодильник, оттуда — в склянку F, затем — в сифон В, С, D к перегонную колбу. Одинаковый уровень воды в колбе и склянке поддерживается при помощи сифона В, С, D. Нормальное функционирование этого, как и предыдущего, аппарата обеспечивается непрерывным поступлением воды из водопроводного крана.
Кроме описанных, существует еще целый ряд других, более сложных аппаратов. Предпочтение отдается аппаратам, сделанным из иенского стекла, в которых отдельные части соединены не пробками, а шлифами. Можно пользоваться также металлическими аппаратами, нагреваемыми электричеством или газом.
Дистиллированная вода может быть однократной, двойной и многократной дистилляции.
Опыт. Различие между паром и туманом. В колбу емкостью 100 мл наливают небольшое количество воды; в шейку колбы вставляют стеклянную трубку длиной 5 см и диаметром 6 мм со слегка оттянутым внешним концом. Установив колбу на треножник, покрытый асбестовой сеткой, нагревают ее до интенсивного кипения воды. Образующиеся пары воды незаметны как в колбе, так и у отверстия трубки, но над колбой образуются клубы тумана (капелек конденсированного пара). Для равномерного кипения воды внутрь колбы помещают несколько кусочков пористого фарфора или стеклянных бусинок.
Конец трубки сильно оттягивать не надо, так как при этом может создаться высокое давление и тогда колба лопнет.
Чистая вода во всех агрегатных состояниях бесцветна. Водяные пары невидимы.
Опыт. Пары, видимые и невидимые. На столе устанавливают четыре большие склянки. В первую наливают немного воды, во вторую — брома, в третью — спирта и в четвертую — бензина.
Через некоторое время воздух в каждой склянке насыщается парами соответствующей жидкости. В склянке с бромом пары видимы, в склянках с водой, спиртом и бензином они невидимы; в склянках со спиртом и бензином их можно обнаружить по запаху.
. Плотность чистой воды при +4°С и давлении 760 мм рт. ст. принимают за единицу.
Опыт. Подтверждение того, что плотность теплой воды меньше, чем воды при +4°С. Для опыта пользуются стеклянной трубкой, согнутой в виде квадрата, с длиной каждой стороны около 25 см (рис. 134). Оба конца трубки соединяют при помощи двух кусочков резиновой трубки со стеклянной Т-образной трубкой. Весь прибор наполняют холодной водой, из которой предварительно кипячением должен быть удален воздух, и закрепляют в штативе в указанном на рисунке положении. В Т-образную трубку добавляют несколько капель чернил, раствора КМnO4, метиленовой сини или флуоресцеина и наблюдают, как диффундирует краситель в обе стороны. Затем нагревают прибор у одного из углов и замечают, как нагретая вода, став более легкой, начинает подниматься вверх и вся жидкость в трубке начинает перемещаться в направлении, обозначенном на рисунке стрелками. Краситель из Т-образной трубки начинает перемещаться в сторону, противоположную нагреванию. Если теперь перенести газовую горелку к левому углу, окрашенная вода начинает перемещаться слева направо. Этот прибор служит моделью центрального отопления.
Плотность льда меньше, чем воды при +4°С, поэтому он плавает на жидкой воде.
Опыт. Проверка слабой теплопроводности воды. Взяв пробирку за нижний конец, нагревают в ней воду. Вода у отверстия пробирки начинает кипеть, оставаясь холодной в нижнем ее конце, за который держат пробирку рукой.
Электропроводность чистой воды очень низкая, т.е. чистая вода — плохой проводник электричества.
Опыт. Для изучения электропроводности чистой воды и растворов различных электролитов и неэлектролитов пользуются специальным прибором.
Основными частями прибора для определения электропроводности жидкостей являются: два электрода, ламповый цоколь с электрической лампой, штепсельная розетка, штепсельная вилка, прерыватель, источник электрического тока и электропровод.
Электроды могут быть платиновыми, угольными или медными; лампы могут быть разной мощности, но предпочитают пользоваться лампами, применяемыми для карманных фонарей; источником тока могут быть 1-2 аккумулятора или выпрямители, а также трансформаторы, соединенные с электрической сетью и дающие напряжение 3-4 В.
Электроды включают при помощи штепсельной вилки. Вместо цоколя с электрической лампой можно использовать электрический звонок. Обычно прибор (цоколь с электрической лампой, штепсельную розетку и прерыватель) монтируют на одной доске по схеме, показанной на рис. 135.
Платиновые электроды (рис. 135). Берут электрический медный шнур длиной 1 м и очищают один конец от изоляции (на 2 см). К очищенным концам провода припаивают платиновые проволочки длиной 1,5-2 см и диаметром 0,5 мм.
Припайку платиновых проволочек к медным производят с помощью буры Na2В4O7 и расплавленного серебра (пластинки). Оба медных провода с платиновыми кончиками вводят (каждый отдельно) в стеклянные трубки длиной 20 см. Стеклянные трубки подбирают такого диаметра, чтобы провод с изоляцией заполнил трубку. Платиновые проволочки на 1 см выводят из стеклянных трубок и загибают в противоположные стороны. Кончики трубок закрывают тонко измельченным асбестом и запаивают.
На расстоянии 8 см снизу обе стеклянные трубки плотно соединяют одной резиновой трубкой и вставляют в стеклянную трубку длиной 20 см и диаметром 12 мм с таким расчетом, чтобы пара стеклянных трубок с проводами на 12 см выходила из широкой трубки.
На нижний конец широкой трубки надевают резиновое кольцо, а верхний конец закрывают резиновой пробкой, через которую пропускают электрический шнур, согнув его в верхнем конце широкой трубки перед тем, как пропустить его через пробку, чтобы при натяжении не сорвать платиновую проволочку. На внешнем конце шнура прикрепляют штепсельную вилку. Чтобы защитить платиновые электроды от порчи, после опыта на них надевают предохранительную трубку или пробирку.
Угольные электроды. В качестве электродов служат угольные стержни длиной 10-12 см и диаметром 0,6-0,8 см с металлическим колпачком в верхнем конце для соединения с источником электрического тока.
Электроды укрепляют в пробковом кружке (или резиновой пробке), в который вставляют также небольшую капельную или простую воронку (рис. 136).
На нижнем конце электродов делают метку, до которой необходимо наливать в сосуд жидкость при погружении в нее электродов.
Медные электроды. Две медные проволоки длиной 10-12 см и диаметром 0,5-0,8 см.
Оба электрода, как и предыдущие, укрепляют в пробковый кружок, в который вставляют также и капельную воронку.
Для определения электропроводности жидкость можно налить в пробирку, стакан, цилиндр, склянку или банку в зависимости от размеров применяемых электродов.
Для проведения опыта электроды погружают в жидкость и включают в электрическую цепь, соединенную последовательно с электрической лампой (звонком) и через выключатель с источником электрической энергии.
Если при включении тока лампочка загорается (или звонит звонок), значит жидкость является хорошим проводником электричества.
Всякий раз перед испытанием электропроводности новой жидкости электроды, сосуд, в который наливают испытываемую жидкость, и воронку тщательно промывают дистиллированной водой, спиртом, эфиром, хлороформом, толуолом или иным растворителем и протирают фильтровальной бумагой.
Обычно в лаборатории проверяют электропроводность следующих жидкостей: дистиллированной воды, разбавленных растворов HCl, H2SO4, NaOH, Ва(ОН)2, NаСl и сахара.
Чтобы показать, что электропроводность связана с присутствием ионов, достаточно продемонстрировать следующее:
При атмосферном давлении (760 мм рт. ст.) вода кипит при 100°. Если изменяется давление, изменяется и температура кипения воды.
Опыт. Кипение воды при пониженном давлении. Прибор собирают в соответствии с рис. 137. Он состоит из холодильника Либиха с внутренней трубкой из толстого и прочного стекла, заканчивающейся внизу небольшой колбочкой. В противоположном от колбочки конце трубки должен быть крючок для подвешивания термометра.
В колбочку холодильника наливают немного воды, подвешивают термометр таким образом, чтобы его шарик с ртутью находился в воде колбочки, и укрепляют холодильник в вертикальном положении на штативе.
Внутреннюю трубку холодильника через предохранительный сосуд и манометр соединяют с водоструйным насосом.
В начале опыта пропускают через холодильник воду и слегка нагревают колбочку, внимательно наблюдая за температурой и давлением, при которых начнет кипеть вода. Очень сильного вакуума в этом опыте допускать не следует во избежание растрескивания трубок.
Опыт. Кипение воды при давлении выше атмосферного. Прибор собирают в соответствии с рис. 138.
Колбу для прибора берут широкогорлую, круглодонную, из толстого и высококачественного стекла емкостью 500 мл.
В колбу наливают 250 мл предварительно прокипяченной воды. Колбу закрепляют в штативе и закрывают резиновой пробкой, через которую пропускают две стеклянные трубки. Одна трубка, диаметром 6-7 мм, заканчивается пузырьком такого размера, чтобы он прошел через горло колбы. Вторая трубка, диаметром 6 мм начинается у нижнего обреза пробки; снаружи она согнута под углом 90° и при помощи толстостенной резиновой трубки соединена с другой, согнутой под прямым углом стеклянной трубкой, опущенной почти до дна в цилиндр со ртутью высотой 90-100 см и диаметром 1,5-2 см.
В пузырек помещают несколько кусочков пористого фарфора и наполняют до половины водой.
При указанном количестве ртути воздух в колбе находится под давлением более двух атмосфер.
Чтобы трубку, опущенную в цилиндр со ртутью, не выбросило, ее закрепляют в зажиме штатива.
После сборки прибора нагревают колбу с водой. В начале закипает вода в пузырьке, находящаяся под атмосферным давлением, и гораздо позднее закипает вода в колбе, находящаяся под давлением более двух атмосфер.
Для опыта пользуются круглодонными колбами, так как они более устойчивы к повышенному давлению.
При проведении опыта работают осторожно, ведя наблюдение на некотором расстоянии, так как при давлении 2-3 атм колба может лопнуть.
Вода участвует в следующих химических реакциях: в реакциях, в которых она проявляет окислительные свойства, в реакциях гидролиза, гидратации, присоединения, замещения и в реакциях, в которых вода играет роль катализатора.
В опытах получения водорода рассматривалось окислительное действие воды на натрий, калий, кальций, магний, алюминий, железо и углерод.
В разделах, посвященных брому и иоду, описаны опыты получения бромистого и йодистого водорода путем гидролиза галогенидов фосфора.
При рассмотрении свойств хлора, брома и хлористого водорода говорилось о гидратации, которая протекает как реакция присоединения.
В опытах, иллюстрирующих соединение водорода с хлором или иода с цинком, показаны каталитические свойства воды.
Химические реакции, протекающие с участием воды, встречаются во многих из описанных опытов.
Латинское название кислорода "оксигениум" происходит от древнегреческого слова "оксис", что значит "кислый", и "геннао" - "рождаю"; отсюда латинское "оксигениум" означает "рождающий кислоты".
Содержание кислорода в земной коре, включая воду и воздух, составляет 49,42%; это самый распространенный элемент.
В свободном состоянии кислород находится в воздухе и воде. В воздухе (атмосфере) его содержится 20,9% по объему или 23,2% по весу; содержание его в воде в растворенном состоянии составляет 7-10 мг/л.
В связанном виде кислород входит в состав воды (88,9%), различных минералов (в виде различных кислородных соединений). Кислород входит в состав тканей каждого растения. Он необходим для дыхания животных.
Кислород в природе встречается в свободном состоянии в смеси с другими газами и в виде соединений, а поэтому применяются как физические, так и химические методы его получения.
Общий метод получения кислорода из соединений основан на окислении двухвалентного отрицательно заряженного иона по схеме:
Поскольку окисление может быть осуществлено различным образом, существует и множество различных (лабораторных и промышленных) способов получения кислорода.
1. СУХИЕ СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА ПУТЕМ ТЕРМИЧЕСКОЙ ДИССОЦИАЦИИ
ПОЛУЧЕНИЕ КИСЛОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ ОКИСЛОВ НЕКОТОРЫХ МЕТАЛЛОВ (НgO, Аg2O, Аu2O3, IrO2 И ДР.)
Из 10 г красной окиси ртути получают 500 мл кислорода.
Для опыта пользуются пробиркой из тугоплавкого стекла длиной 17 см и диаметром 1,5 см с согнутым, как показано на рис. 107, нижним концом длиной 3-4 см. В нижний конец насыпают 3-5 г красной окиси ртути. В пробирку, укрепленную в штативе в наклонном положении, вставляют резиновую пробку с отводной трубкой, по которой выделяющийся при нагревании кислород отводят в кристаллизатор с водой.
 Оксид ртути (II) |
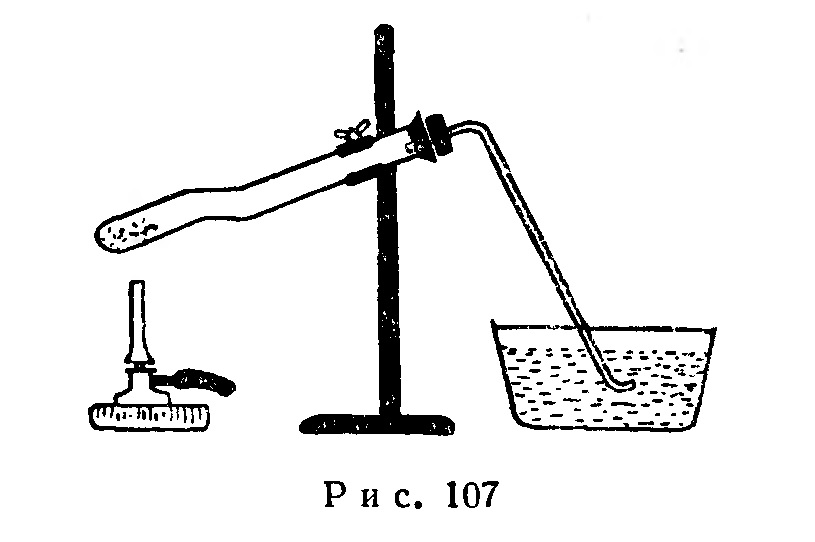 |
 Разложение HgO |
При нагревании красной окиси ртути до 500° наблюдается выделение кислорода из отводной трубки и появление капелек металлической ртути на стенках пробирки.
Кислород плохо растворяется в воде, и поэтому его собирают, применяя способ вытеснения воды после полного удаления воздуха, из прибора.
По окончании опыта сначала вынимают отводную трубку из кристаллизатора с водой, затем гасят горелку и, учитывая ядовитость паров ртути, открывают пробку только после полного остывания пробирки.
Вместо пробирки можно пользоваться ретортой с приемником для ртути.
Опыт. Термическое разложение окиси серебра. Уравнение реакции:

Оксид серебра (I) |
-oxide-sample.jpg)
Оксид серебра (I) |
При нагревании черного порошка окиси серебра в пробирке с отводной трубкой выделяется кислород, который собирают над водой, а на стенках пробирки остается в виде зеркала блестящий слой серебра.
ПОЛУЧЕНИЕ КИСЛОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ ОКИСЛОВ, КОТОРЫЕ, ВОССТАНАВЛИВАЯСЬ, ПЕРЕХОДЯТ В ОКИСЛЫ НИЗШЕЙ ВАЛЕНТНОСТИ, ОСВОБОЖДАЯ ЧАСТЬ КИСЛОРОДА

Оксид свинца (II) PbO |

Свинцовый сурик (Pb3O4 или 2PbO·PbO2) |

Свинцовый сурик |

Оксид свинца (IV) PbO2 |

Оксид свинца (IV) PbO2 |
При термическом разложении из 10 г двуокиси свинца получают около 460 мл кислорода, а из 10 г Рb3O4 - около 160 мл кислорода.
Получение кислорода из окислов свинца требует более сильного нагревания.
При сильном нагревании темно-бурого порошка РbO2 или оранжевого Рb3O4 в пробирке образуется желтый порошок окиси свинца РbО; при помощи тлеющей лучинки можно убедиться в том, что происходит выделение кислорода.
Пробирка после этого опыта не годится для дальнейшего употребления, так как. при сильном нагревании окись свинца соединяется со стеклом.
Опыт. Термическое разложение двуокиси марганца. Кислород образуется в результате внутримолекулярной окислительно-восстановительной реакции:
Из 10 г двуокиси марганца (пиролюзита) получают около 420 мл кислорода. Пробирку в этом случае нагревают до светло-красного каления.
Для получения большого количества кислорода процесс разложения пиролюзита осуществляют в закрытой с одного конца железной трубке длиной 20 см. Второй конец ее закрывают пробкой с трубкой, по которой отводится кислород.
Железную трубку нагревают при помощи печи для сжигания или газовой горелки Теклу с насадкой "ласточкин хвост".
Опыт. Термическое разложение хромового ангидрида. Кислород образуется в результате внутримолекулярной окислительно-восстановительной реакции:
![Оксид хрома (VI) [хромовый ангидрид]](http://chemistry-chemists.com/N3_2012/U3/img/Chromium_VI_oxide-2.jpg) Оксид хрома (VI) СrO3 [хромовый ангидрид] |
 Оксид хрома (III) Сr2O3 |
 Оксид хрома (III) Сr2O3 |
При термическом разложении хромового ангидрида (гигроскопического, твердого вещества темно-красного цвета) выделяется кислород и образуется зеленый порошок окиси хрома Сr2O3.
ПОЛУЧЕНИЕ КИСЛОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ ПЕРЕКИСЕЙ
При сильном нагревании перекиси бария ВаO2 перекисная связь разрывается с образованием окиси бария и выделением кислорода.
Из 10 г перекиси бария получают около 660 мл кислорода.
Вместо перекиси бария можно пользоваться также перекисью натрия. Тогда разложение идет по уравнению
Опыт проводят в пробирке с отводной трубкой.
Опыт. Термическое разложение хлората калия. В зависимости от температуры хлорат калия разлагается по-разному. При нагревании его до 356° он плавится, а при 400° разлагается по уравнению
 Хлорат калия КСlO3 (бертолетова соль) |
В этом случае выделяется только одна треть содержащегося в соединении кислорода и наблюдается затвердение расплава. Такое явление объясняется тем, что образовавшееся соединение КСlO4 более стойкое и тугоплавкое.
При нагревании хлората калия до 500° образование перхлората калия является промежуточной реакцией. Разложение в этом случае протекает по уравнениям:
Термическое разложение хлората калия проводят в небольшой реторте, которая при помощи отводной трубки с предохранительной трубкой соединена с кристаллизатором, наполненным водой (или пневматической ванной). Прибор собирают в соответствии с рис. 108. Во избежание взрыва в реторту насыпают чистый КСlO3, без примеси органических веществ.
 |
Чтобы избежать бурного разложения, из-за которого может лопнуть реторта, нагревание ведут осторожно.
Выделяющийся кислород собирают в различные сосуды над водой. Когда хотят получить медленный ток кислорода, хлорат калия разбавляют, смешивая его с сухой поваренной солью.
Опыт. Термическое разложение хлората калия в присутствии катализатора. В присутствии катализаторов (MnO2, Fe2O3, Сr2О3 и СuО) хлорат калия легко и полностью разлагается при более низкой температуре (без образования промежуточного соединения, перхлората калия) по уравнению:
При добавлении двуокиси марганца КClO3 разлагается уже при 150-200°; процесс имеет следующие промежуточные стадии:
Доля добавляемой двуокиси марганца (пиролюзита) составляет от 5 до 100% от веса хлората калия.
Пробирку с хлоратом калия закрывают пробкой, сквозь которую пропускают две стеклянные трубки. Одна трубка служит для отвода кислорода в кристаллизатор с водой, вторая, очень короткая трубка, согнутая под прямым углом с закрытым внешним концом, содержит мелкий порошок черной двуокиси марганца MnO2.
Прибор собирают в соответствии с рис. 109. При нагревании пробирки приблизительно до 200° пузырьки кислорода в кристаллизаторе с водой еще не выделяются. Но стоит повернуть вверх коротенькую трубку с двуокисью марганца и слегка постучать по ней, в пробирку попадет небольшое количество двуокиси марганца и сразу же начнется бурное выделение кислорода.
После окончания опыта и охлаждения прибора смесь двуокиси марганца и хлорида калия высыпают в воду. После растворения хлорида калия отфильтровывают трудно растворимую двуокись марганца, тщательно промывают на фильтре, высушивают в сушильном шкафу и хранят для дальнейшего ее использования в качестве катализатора. Если необходимо получить большое количество кислорода, процесс разложения ведут в ретортах из тугоплавкого стекла либо в чугунных ретортах.
Термическое разложение хлората калия в присутствии двуокиси марганца является наиболее удобным из сухих способов получения кислорода.
Этот опыт проделывают и с другими катализаторами - Fe2O3, Сr2О3 и СuО.
Опыт. Получение кислорода путем нагревания хлората калия, смеси хлората калия с двуокисью марганца и двуокиси марганца. Для проведения опыта необходимы следующие приборы: три пробирки из тугоплавкого стекла с отводными трубками, три цилиндра емкостью по 100 мл каждый, три газовые горелки, три кристаллизатора и три штатива с зажимами.
Установку собирают в соответствии с рис. 110. Кристаллизаторы и цилиндры наполняют водой, слегка подкрашенной перманганатом калия или фуксином S.
В первую пробирку насыпают 1 г чистого КСlO3, во вторую - 0,5 г КСlO3 и 0,5 г MnO2 и в третью - 1 г MnO2. Особое внимание обращают на то, чтобы пробирки были чистыми и в них не попали крупинки пробки.
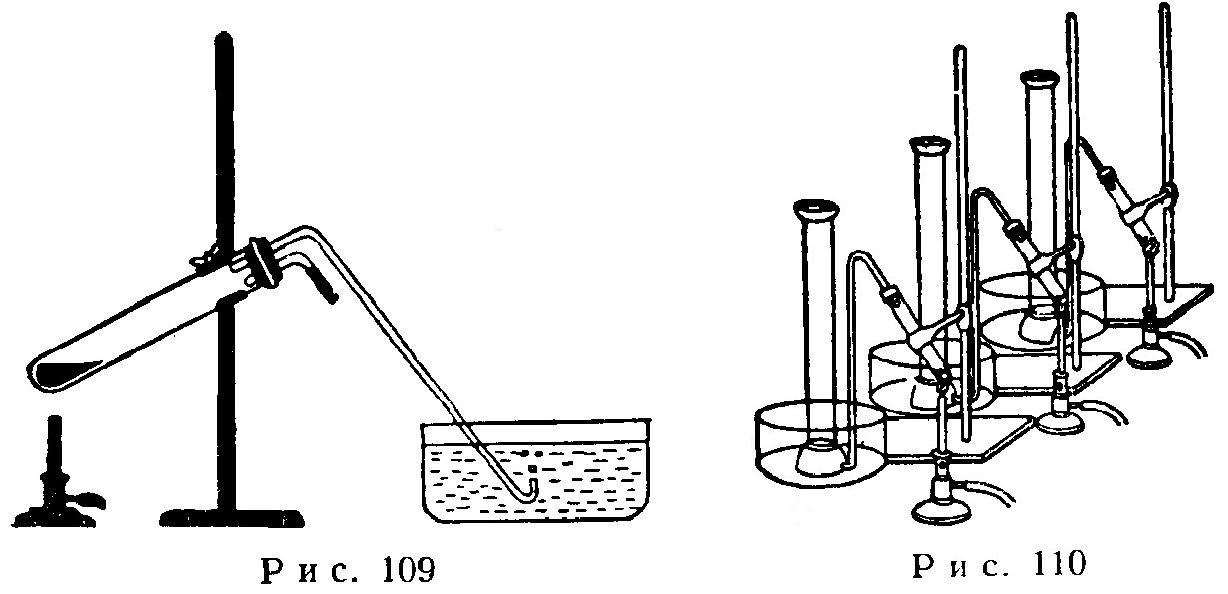 |
Тщательно отрегулированные газовые горелки, горящие одинаковым, не очень сильным несветящимся пламенем и выделяющие одинаковое количество тепла, подставляют под пробирки так, чтобы они верхушкой пламени нагревали находящееся в пробирке вещество.
Вскоре из пробирки со смесью хлората калия и двуокиси марганца начинает выделяться кислород, и реакция заканчивается еще до того, как он начнет выделяться в других пробирках.
Усиливают нагревание остальных двух пробирок. Как только хлорат калия расплавится и начнет выделяться кислород, уменьшают пламя, чтобы не происходило бурного выделения газа. В пробирке с двуокисью марганца кислород начинает выделяться только после того, как содержимое пробирки нагреется до красного каления. Выделяющийся из каждой пробирки кислород собирают в кристаллизаторах путем вытеснения подкрашенной воды из цилиндров.
По окончании опыта гасят горелки, удаляют отводные трубки, затем описанным выше способом выделяют двуокись марганца из средней пробирки.
Проведенный опыт наглядно показывает особенности этих трех различных способов получения кислорода.
ПОЛУЧЕНИЕ КИСЛОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ БРОМАТОВ И ИОДАТОВ
ПОЛУЧЕНИЕ КИСЛОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ НИТРАТОВ
1. Нитраты, разлагающиеся в результате внутримолекулярных окислительно-восстановительных реакций на нитриты и кислород. К этой группе относятся нитраты щелочных металлов. Реакции протекают по уравнениям:
2. Нитраты, разлагающиеся в результате внутримолекулярных окислительно-восстановительных реакций на окись металла, двуокись азота и кислород. К этой группе относятся нитраты всех металлов, за исключением щелочных и благородных металлов. Например:
3. Нитраты, разлагающиеся в результате внутримолекулярных окислительно-восстановительных реакций на металл, двуокись азота и кислород. К этой группе относятся нитраты благородных металлов:
Неодинаковое разложение нитратов при нагревании объясняется различной устойчивостью соответствующих нитритов и окислов.
Нитриты щелочных металлов устойчивы, нитриты свинца (или меди) неустойчивы, но устойчивы их окислы, а что касается серебра, то здесь неустойчивыми являются и нитриты, и окислы; поэтому при нагревании нитратов этой группы выделяются свободные металлы.
Опыт. Термическое разложение нитрата натрия или калия. Нитрат натрия или калия нагревают в пробирке или реторте с отводной трубкой. При 314° плавится нитрат натрия, а при 339° - нитрат калия; лишь после того как содержимое в пробирке или реторте накалится докрасна, начинается разложение нитрата по уравнениям, которые приводились выше.
Разложение протекает гораздо легче, если предупредить расплавление нитратов, смешав их с двуокисью марганца или натронной известью, представляющей собою смесь NaOН и СаО.
Термическое разложение нитратов свинца и серебра рассматривается в опытах получения двуокиси азота.
ПОЛУЧЕНИЕ КИСЛОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ ПЕРМАНГАНАТОВ
Эта внутримолекулярная окислительно-восстановительная реакция протекает приблизительно при 240°. Термическое разложение проводят в сухой пробирке (или реторте) с газоотводной трубкой. Если хотят получить чистый кислород без следов пыли, которая образуется при термическом разложении, в шейку пробирки (или реторты) вставляют тампон стеклянной ваты.
Это удобный способ получения кислорода, но он дорог.
После окончания опыта и охлаждения пробирки (или реторты) в нее наливают несколько миллилитров воды, тщательно взбалтывают содержимое и наблюдают цвет образовавшихся веществ (К2МnO4 - зеленого цвета и МnO2 темно-бурого).
Благодаря свойству перманганата калия выделять кислород при нагревании, его наравне с серой, углем и фосфором применяют в различных взрывчатых смесях.
 Получение кислорода термическим разложением перманганата калия |
 Na2MnO4 |
 Диоксид марганца МnO2 |
 Диоксид марганца МnO2 |
 Диоксид марганца МnO2 |
ПОЛУЧЕНИЕ КИСЛОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ ПЕРСУЛЬФАТОВ
Для освобождения кислорода от примеси двуокиси серы газовую смесь пропускают через раствор NaOН, который связывает двуокись серы в виде сульфита натрия. Термическое разложение проводят в пробирке с отводной трубкой.
ПОЛУЧЕНИЕ КИСЛОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ ПЕРХЛОРАТОВ
ПОЛУЧЕНИЕ КИСЛОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ ПЕРКАРБОНАТОВ
Для освобождения кислорода от примеси углекислого газа газовую смесь пропускают через раствор гидрата окиси кальция или бария.
Кислород можно также получать сжиганием оксигенита. Оксигенитом называют тонкую смесь 100 вес. ч. КСlO3, 15 вес. ч. МnO2 и небольшого количества угольной пыли.
Получаемый этим способом кислород загрязнен примесью углекислого газа.
Наряду с веществами, которые при нагревании разлагаются с выделением кислорода, имеется много веществ, не выделяющих кислорода при нагревании. Чтобы убедиться в этом, проделывают опыты с нагреванием СuО, СаО, Na2SO4 и др.
II. МОКРЫЕ СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА
ПОЛУЧЕНИЕ КИСЛОРОДА РАЗЛОЖЕНИЕМ ПЕРЕКИСЕЙ ЩЕЛОЧНЫХ МЕТАЛЛОВ ВОДОЙ
Это сильно экзотермическая реакция, протекающая на холоду и ускоряющаяся катализаторами - солями меди, никеля, кобальта (например, СuSO4•5Н2O, NiSO4•7Н2O и СoSO4•7Н2O).
Удобным для получения кислорода является оксилит - смесь перекиси натрия Na2O2, калия К2O2 и безводного сульфата меди. Эту смесь хранят в плотно укупоренных железных ящиках, предохраняя ее от атмосферной влаги (которая разлагает ее, см. уравнение предыдущей реакции) и углекислого газа, с которым она вступает в реакцию по уравнению:
Опыт. В пробирку (стакан или склянку) с небольшим количеством холодной воды насыпают щепотку перекиси натрия (или оксилита); при этом наблюдается бурное выделение кислорода и сосуд разогревается.
Если опыт проводить в сосуде с отводной трубкой, то выделяющийся кислород можно собрать.
ПОЛУЧЕНИЕ КИСЛОРОДА РАЗЛОЖЕНИЕМ ПЕРЕКИСЕЙ КИСЛОТАМИ В ПРИСУТСТВИИ КАТАЛИЗАТОРОВ, НАПРИМЕР МnO2 ИЛИ РbO2
При использовании РbO2 в качестве катализатора к смеси добавляют разбавленную HNO3.
ПОЛУЧЕНИЕ КИСЛОРОДА КАТАЛИТИЧЕСКИМ РАЗЛОЖЕНИЕМ ПЕРЕКИСИ ВОДОРОДА
При изучении свойств перекиси водорода отмечаются факторы, благоприятствующие ее разложению, и проводятся опыты ее разложения под влиянием двуокиси марганца и коллоидного раствора серебра.
Опыт. В стеклянный цилиндр с 50 мл воды и 10-15 мл пергидроля (30%-ный раствор Н2O2) добавляют немного тонко измельченного порошка двуокиси марганца; наблюдается бурное выделение кислорода с образованием пены (это явление очень похоже на кипение).
Опыт можно проделать и в пробирке, а вместо пергидроля использовать 3%-ный раствор перекиси водорода.
Вместо МnO2 можно пользоваться коллоидным раствором серебра.
ПОЛУЧЕНИЕ КИСЛОРОДА ДЕЙСТВИЕМ ПЕРМАНГАНАТА КАЛИЯ НА ПЕРЕКИСЬ ВОДОРОДА (В КИСЛОЙ, НЕЙТРАЛЬНОЙ И ЩЕЛОЧНОЙ СРЕДАХ)
Опыт. Получение легко регулируемого постоянного тока кислорода окислением перекиси водорода на холоду перманганатом калия в щелочной среде. В колбу Бунзена наливают 3-5%-ный раствор перекиси водорода, подкисленный 15%-ным раствором Н2SO4, а в укрепленную в горлышке колбы капельную воронку - 10%-ный раствор перманганата калия.
При помощи крана капельной воронки можно регулировать как поступление раствора перманганата в колбу, так и ток кислорода. При проведении опыта раствор КМnO4 вводят в колбу по каплям.
Колбу Бунзена в опыте можно заменить колбой Вюрца или двугорлой склянкой.
Опыт. Получение кислорода окислением перекиси водорода двуокисью марганца в кислой среде. Уравнение реакции:
Реакция протекает на холоду; поэтому для опыта можно пользоваться любым прибором, позволяющим взаимодействием на холоду между твердым и жидким веществом получать постоянный ток газа (аппаратом Киппа или колбой Вюрца, колбой Бунзена или двугорлой склянкой с капельной воронкой).
При проведении опыта пользуются двуокисью марганца в кусках, 15%-ной Н2SO4 и 3-5%-ным раствором перекиси водорода.
Опыт. Получение кислорода окислением перекиси водорода железосинеродистым калием в щелочной среде. Уравнение реакции:
Реакция протекает на холоду; для получения постоянного тока кислорода используются приборы, указанные в предыдущем опыте, твердый железосинеродистый калий, 6-10%-ный раствор гидрата окиси калия и 3-5%-ный раствор перекиси водорода.
Опыт. Получение кислорода нагреванием хромата (бихромата или хромового ангидрида) с концентрированной серной кислотой. Благодаря обратимой реакции, протекающей по уравнению:
в кислой среде всегда содержится бихромат, а не хромат.
Между концентрированной серной кислотой и бихроматом имеют место следующие реакции:
(реакция двойного обмена и дегидратации)
(окислительно-восстановительная реакция)
При проведении опыта в пробирке происходит выделение кислорода и изменение оранжевого цвета (характерного для бихромата) в зеленый цвет (характерный для солей трехвалентного хрома).
III. ПОЛУЧЕНИЕ КИСЛОРОДА ИЗ ЖИДКОГО ВОЗДУХА
Большинство газов при сжатии нагревается, а при расширении охлаждается. На рис. 111 приводится принципиальная схема работы машины Линде, применяемой для сжижения воздуха.
Компрессор В при помощи поршня сжимает до 200 атм поступающий через кран А воздух, очищенный от углекислого газа, влаги и следов пыли. Возникающее при сжатии тепло поглощается в холодильнике D, охлаждаемом проточной водой. После этого открывают кран С и воздух поступает в сосуд Е, где он расширяется до давления 20 атм. Благодаря такому расширению воздух охлаждается приблизительно до -30°. Из сосуда Е воздух снова возвращается в компрессор В; проходя по наружной трубке змеевика G, он охлаждает по пути новую порцию сжатого воздуха, идущую ему навстречу по внутренней трубке змеевика. Вторая порция воздуха охлаждается таким образом приблизительно до -60°. Этот процесс повторяется до тех пор, пока воздух не охладится до -180°; такая температура является достаточной для сжижения его при 20 атм в сосуде Е. Скопляющийся в сосуде Е жидкий воздух сливают в баллон через кран 1. Описанная установка работает непрерывно. Детали этой машины на схеме не показаны. Эту машину усовершенствовал Ж. Клод, после чего она стала более производительной.
По своему составу жидкий воздух отличается от обычного атмосферного; он содержит 54% по весу жидкого кислорода, 44% азота и 2% аргона.
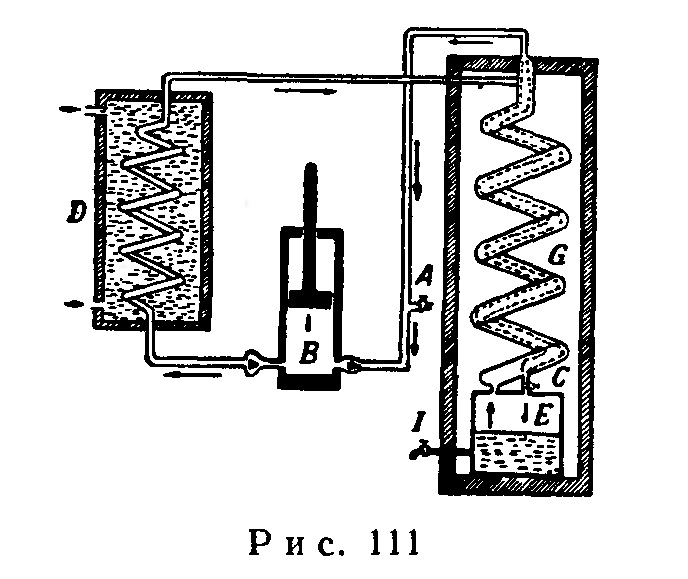 |
Жидкий кислород |
Опыт. Чтобы показать, как изменяются свойства органических веществ под влиянием изменения условий (температуры и концентрации кислорода), в термос с жидким воздухом погружают при помощи металлических щипцов растения с листьями и цветами или тонкую резиновую трубку.
Из жидкого воздуха кислород получают следующими способами:
- а) дробной перегонкой (наиболее распространенный способ);
- б) растворением воздуха в жидкостях (например, в воде растворяется 33% кислорода и 67% азота) и
извлечением его под вакуумом;
- в) селективным поглощением (древесный уголь поглощает 92,5% по объему кислорода и 7,5% по объему азота);
- г) на основе различия в скоростях диффузии кислорода и азота через резиновую мембрану.
Для очистки кислорода его пропускают через промывную склянку со щелочью, которая удерживает все сопровождающие его летучие соединения кислотного характера, через раствор КI (для освобождения от озона) и через концентрированную Н2SO4, которая удерживает пары воды.
СВОЙСТВА КИСЛОРОДА
ФИЗИЧЕСКИЕ СВОЙСТВА
Плотность его относительно воздуха 1,10563; поэтому его можно собирать в сосуды, применяя способ вытеснения воздуха.
В нормальных условиях один литр кислорода весит 1,43 г, а один литр воздуха - 1,29 г. Температура кипения -183°, температура плавления -218,88°.
Жидкий кислород в тонком слое бесцветен, толстые слои имеют голубой цвет; удельный вес жидкого кислорода 1,134.
Твёрдый кислород обладает голубым цветом и по виду похож на снег; удельный вес его 1,426.
Критическая температура кислорода -118°; критическое давление 49,7 атм. (Кислород хранят в стальных баллонах емкостью 50 л, под давлением 150 атм. Способы хранения различных газов в стальных баллонах описаны в первой главе.)
В воде кислород растворяется в очень небольшом количестве: в одном литре воды при 20° и давлении 760 мм рт. ст. растворяется 31,1 мл кислорода. Поэтому его можно собирать в пробирки, цилиндры или газометры, применяя способ вытеснения воды. В спирте кислород растворяется лучше, чем в воде.
Чтобы пользоваться газометром (рис. 112), необходимо уметь наполнять его водой и газом, находящимся под атмосферным, а также выше и ниже атмосферного давления; уметь выпускать газ из газометра.
Вначале газометр А наполняют водой через воронку В, при открытых кранах С и D и закрытом отверстии Е. Вода, поступая в газометр из воронки В через кран С, вытесняет из него воздух через кран D.
Для наполнения газометра газом, находящимся под некоторым давлением, закрывают кран С и В и открывают отверстие Е: если оба верхних крана плотно пригнаны, вода из газометра не вытекает. Вводят через отверстие Е конец трубки, по которой поступает газ, находящийся под давлением, превышающим атмосферное. Газ скопляется в верхней части газометра, вытесняя из него воду, которая выливается через отверстие Е. После того как газ почти полностью наполнит газометр, отверстие Е закрывают. При наполнении газометра газом, находящимся под атмосферным или пониженным давлением, трубку, по которой поступает газ, присоединяют к открытому крану Б, затем открывают отверстие Е и оставляют закрытым кран С. Вода, вытекая из отверстия Е, всасывает газ в газометр. После того как газометр почти полностью наполнится газом, закрывают отверстие Е и кран В.
Для выпуска газа наполняют воронку В водой, открывают кран С; вода, поступая в газометр, вытесняет из него газ, который выходит через открытый кран Е).
В расплавленном состоянии некоторые металлы, например платина, золото, ртуть, иридий и серебро, растворяют около 22 объемов кислорода, который выделяется при их затвердевании со специфическим звуком, особенно характерным для серебра.
Молекула кислорода очень устойчива, она состоит из двух атомов; при 3000° только 0,85% молекул кислорода диссоциирует на атомы.
ХИМИЧЕСКИЕ СВОЙСТВА
С другими элементами он соединяется непосредственно или образует соединения косвенным путем. Непосредственное соединение кислорода может протекать энергично и медленно. Соединение кислорода с элементами или сложными веществами называют окислением или горением. Оно всегда протекает с выделением тепла, а иногда и света. Температура, при которой происходит окисление, может быть различной. Одни элементы соединяются с кислородом на холоду, другие - только при нагревании.
В том случае, когда при химической реакции количество выделяющегося тепла превышает его потери в результате излучения, теплопроводности и т.д., происходит энергичное окисление (например, горение металлов и неметаллов в кислороде), в противном случае происходит медленное окисление (например, фосфора, угля, железа, тканей животных, пирита и т.д.).
Если медленное окисление протекает без потери тепла, происходит повышение температуры, которое приводит к ускорению реакции, и медленная реакция в результате самоускорения может стать энергичной.
Опыт. Пример самоускорения медленной реакции. Берут два небольших кусочка белого фосфора. Один из них обертывают фильтровальной бумагой. Через некоторое время обернутый бумагой кусочек фосфора загорается, в то время как незавернутый продолжает медленно окисляться.
Четкой грани между энергичным и медленным окислением не существует. Энергичное окисление сопровождается выделением большого количества тепла и света; медленное окисление иногда сопровождается холодной люминесценцией.
Горение также протекает по-разному. Вещества, которые при горении превращаются в парообразное состояние (натрий, фосфор, сера и др.), сгорают с образованием пламени; вещества, не образующие при горении газов и паров, сгорают без пламени; горение некоторых металлов (кальций, магний, торий и др.) сопровождается выделением большого количества тепла, а образующиеся при этом раскаленные окислы обладают способностью выделять много света в видимой области спектра.
Вещества, выделяющие большое количество тепла при окислении (кальций, магний, алюминий), способны вытеснять другие металлы из их окислов (на этом свойстве основана алюминотермия).
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе, в котором оно замедляется ввиду того, что в нем содержится около 80% азота, не поддерживающего горения.
ГОРЕНИЕ РАЗЛИЧНЫХ ВЕЩЕСТВ В КИСЛОРОДЕ
Для сжигания в кислороде вещество помещают в специальную ложечку, сделанную из расплющенной на конце толстой железной (или медной) проволоки, либо прикрепляют сжигаемый образец к концу проволоки.
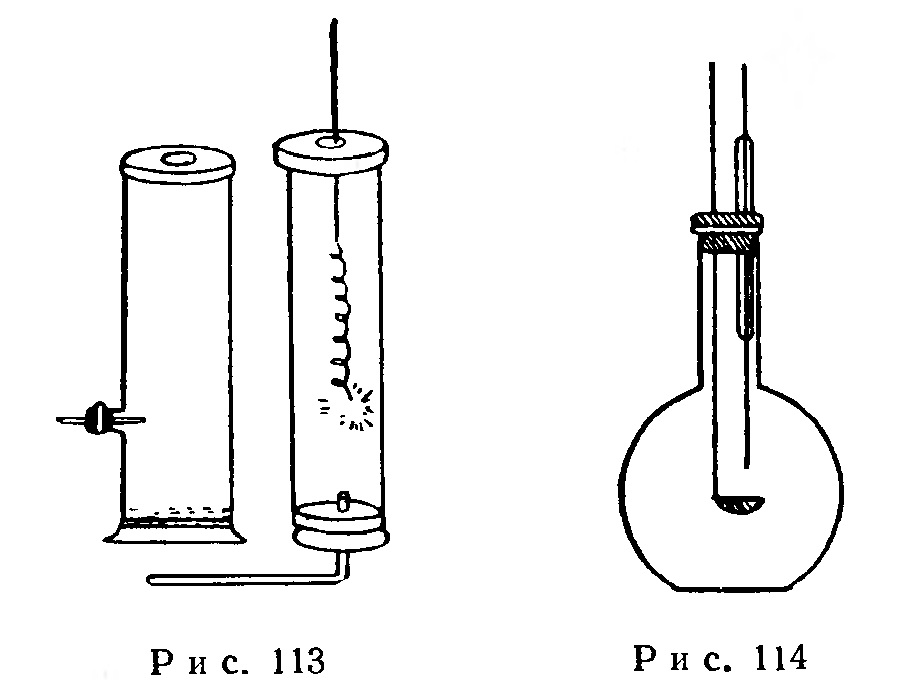 |
Опыт. Воспламенение и горение в кислороде тлеющей лучинки (или свечи). При внесении в сосуд с кислородом тлеющей лучинки (или свечи) лучинка воспламеняется и сгорает ярким пламенем. Иногда лучинка воспламеняется с небольшим взрывом. Описанным опытом пользуются всегда для открытия свободного кислорода (* Аналогичную реакцию дает закись азота).
 |
 |
 |
 Горение лучинки в кислороде |
Опыт. Горение угля в кислороде. Уравнение реакции:
Если внести в сосуд с кислородом кусочек тлеющего угля, укрепленного на конце железной проволоки, уголь сгорает с выделением большого количества тепла и света. Образующийся при горении углекислый газ открывают при помощи смоченной водой синей лакмусовой бумаги или путем пропускания газообразных продуктов горения через раствор гидрата окиси кальция.
Опыт горения угля в кислороде, выделяющемся при термическом разложении КClO3, уже проводился при изучении свойств хлората калия.
Опыт. Горение серы в кислороде. Уравнение реакции:
При внесении в сосуд с кислородом зажженного серного цвета наблюдается более интенсивное горение серы в кислороде и ощущается резкий запах сернистого газа. Чтобы не распространялся по лаборатории этот ядовитый газ, сосуд по окончании опыта плотно закрывают.
 |
 |
 |
 Горение серы в кислороде |
Горение серы в кислороде, выделяющемся при термическом разложении хлората калия, описывалось при изучении свойств КClO3.
Опыт. Горение белого и красного фосфора в кислороде. Реакция протекает по уравнению:
Короткое и широкое горлышко колбы (или банки) емкостью 0,5-2 л, помещенной на поднос с песком, закрывают пробкой с пропущенной через нее металлической ложечкой и стеклянной трубкой, ось которой должна проходить через середину ложечки (рис. 114).
Одновременно с наполнением колбы кислородом (способом вытеснения воздуха) отрезают в ступке под водой кусочек белого фосфора величиной с горошину, слегка обжимают его фильтровальной бумагой для удаления следов воды и при помощи металлических щипцов кладут в металлическую ложечку. Ложечку опускают в колбу, закрывают ее и прикасаются к фосфору нагретой до 60-80° стеклянной палочкой (или проволокой), которую вводят через стеклянную трубку.
Фосфор воспламеняется и сгорает ярким пламенем с образованием пятиокиси фосфора в виде белого дыма (вызывающего кашель).
Иногда белый фосфор загорается в кислороде и без прикосновения к нему нагретой стеклянной палочки или проволоки. Поэтому рекомендуется пользоваться фосфором, хранившимся в очень холодной воде; отжимать его фильтровальной бумагой следует без всякого трения и вообще всю подготовку к введению его в сосуд с кислородом надо проводить как можно быстрее. Если фосфор После сгорания фосфора вынимают пробку с ложечкой, наливают в колбу небольшое количество воды и испытывают ее синей лакмусовой бумагой.
Если часть фосфора осталась неокисленной, ложечку опускают в кристаллизатор с водой. Если же фосфор сгорел весь, то ложечку прокаливают под тягой, промывают водой и высушивают над пламенем горелки.
При проведении этого опыта никогда не вводят в сосуд с кислородом расплавленный белый фосфор. Этого нельзя делать, во-первых, потому, что фосфор легко можно разлить, а, во-вторых, потому, что в этом случае фосфор сгорает в кислороде слишком бурно, разбрасывая во все стороны брызги, которые могут попасть на экспериментатора; от брызг фосфора лопается сосуд, осколки которого могут ранить окружающих.
Поэтому на столе должен быть кристаллизатор с водой, в который можно бросить фосфор в случае, если он загорится при его обжимании фильтровальной бумагой; необходимо также иметь концентрированный раствор КМnO4 или AgNO3 (1 : 10) для оказания первой помощи в случае ожогов фосфором.
Вместо белого фосфора можно пользоваться сухим красным фосфором. Для этого красный фосфор предварительно очищают, тщательно промывают водой и высушивают.
Красный фосфор воспламеняется при более высокой температуре, поэтому его поджигают сильно нагретой проволокой.
После сжигания и в этом случае наливают в колбу немного воды, испытывают лакмусом полученный раствор и прокаливают ложечку под тягой.
В обоих опытах следует пользоваться защитными очками из темного стекла.

Самовоспламенение белого фосфора |

|

|

|

|
Опыт. Горение в кислороде металлического натрия. Реакция протекает по уравнению:
Натрий сжигают в небольшом тигле из чистой окиси кальция, мела или асбестового картона, но не в металлической ложечке, которая от тепла, выделяющегося при горении натрия в кислороде, может сама расплавиться и сгореть.
Натрий поджигают и вносят в сосуд с кислородом, в котором он сгорает очень ярким пламенем; наблюдать за его горением следует через защитные темные очки.
Приготовленный из мела (или СаО) тигель прикрепляют двумя-тремя тонкими проволочками к толстой железной (или медной) проволоке (рис. 115) и кладут в него очищенный от окиси кусочек металлического натрия размером с горошину.
Мел, асбест, окись кальция являются плохими проводниками тепла, и поэтому поджигают натрий, направляя на него сверху пламя горелки при помощи паяльной трубки. Чтобы обезопасить себя от брызг горящего натрия, на паяльную трубку надевают резиновую трубку.
Нагревание, плавление и поджигание натрия в воздухе производят над сосудом с кислородом.
Если натрий не загорается, то при помощи паяльной трубки удаляют образовавшуюся на поверхности металла корку, но делать это следует крайне осторожно из-за возможного разбрызгивания расплавленного натрия.
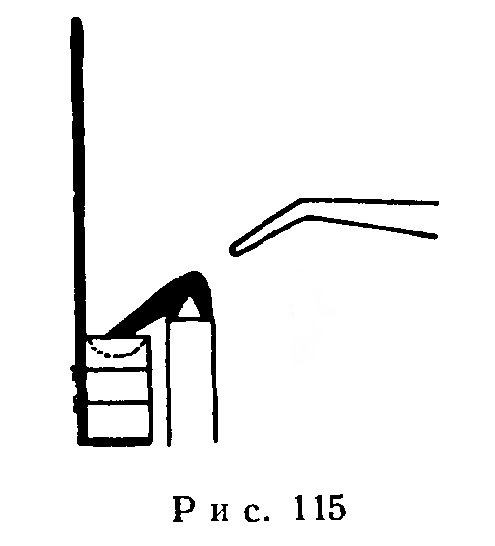 |
Опыт. Горение в кислороде металлического кальция. Уравнение реакции:
В небольшой тигель из асбестового картона кладут спичку, а сверху на нее - стружки кальция.
Зажигают спичку и вносят тигель со стружками кальция в сосуд с кислородом. Через защитные очки наблюдают воспламенение и сгорание металлического кальция ярким пламенем.
В сосуд с кислородом можно внести и зажженный кальций (как это делалось в предыдущем опыте с натрием).
Опыт. Горение магния в кислороде. Реакция протекает по уравнению:
К одному концу ленты магния длиной 20-25 см, скрученной в виде спирали, прикрепляют кусочек трута, а к другому - железную проволоку. Проволоку берут в руку и, держа ленту магния в вертикальном положении, поджигают трут и вносят ленту магния в сосуд с кислородом. Сквозь защитные очки наблюдают воспламенение и горение магния с образованием окиси магния.
По окончании опыта наливают в сосуд немного воды и при помощи индикатора убеждаются в щелочном характере раствора образовавшейся гидроокиси магния.
Опыт можно проделать и с порошком магния. Для этого берут ложечку порошка магния и вставляют в него половину спички с головкой. Поджигают спичку и вносят ложечку в сосуд с кислородом.
Горение магния на воздухе |
Впрочем, магний горит ослепительным пламенем и на воздухе, хотя здесь окислительные реакции кислорода значительно ослаблены в связи с тем, что в воздухе содержится большой процент азота.
Сосуд, в котором сжигают магний, может лопнуть, если вводить в него горящий магний недостаточно быстро или если горящий магний прикоснется к его стенкам.
Яркий свет горящего магния нашел применение для освещения фотографируемых объектов, а также в качестве инициатора некоторых реакций, протекающих под влиянием коротких световых волн, например синтеза НСl из элементов.
При рассмотрении свойств хлората калия описывался опыт горения его смеси с магнием.
Опыт. Горение в кислороде крупных опилок цинка. Уравнение реакции:
В трубку из тугоплавкого стекла длиной 15 см и внутренним диаметром 0,8-1 см насыпают крупных опилок цинка (за отсутствием их можно пользоваться и порошком, но таким образом, чтобы через него мог проходить кислород) и укрепляют ее за один конец в горизонтальном положении в зажиме штатива.
Укрепленный в штативе конец трубки соединяют с источником кислорода, а противоположный конец нагревают газовой горелкой.
При пропускании через трубку кислорода цинк воспламеняется и горит ярким пламенем с образованием окиси цинка (твердое белое вещество). Опыт проводится под тягой.
Опыт. Определение количества кислорода, расходуемого при горении меди. Реакция протекает по уравнению:
Прибор для опыта показан на рис. 116. В тугоплавкую трубку длиной 20 см и внутренним диаметром 1,5 см вставляют фарфоровую лодочку с 1 г тонкого порошка металлической меди. Промывную склянку с водой соединяют с источником кислорода (газометром или баллоном).
Газометр с колоколом, расположенный справа, наполняют водой, подкрашенной раствором индиго или фуксина. Кран газометра открывают, чтобы проходящий через прибор кислород мог поступать под колокол.
Открывают зажим между промывной склянкой и тугоплавкой трубкой и впускают под колокол около 250 мл кислорода. Закрывают зажим и отмечают точный объем кислорода.
При помощи горелки Теклу с "ласточкиным хвостом" нагревают ту часть трубки, в которой находится фарфоровая лодочка. Через несколько минут медь загорается, и сразу же повышается уровень воды в колоколе.
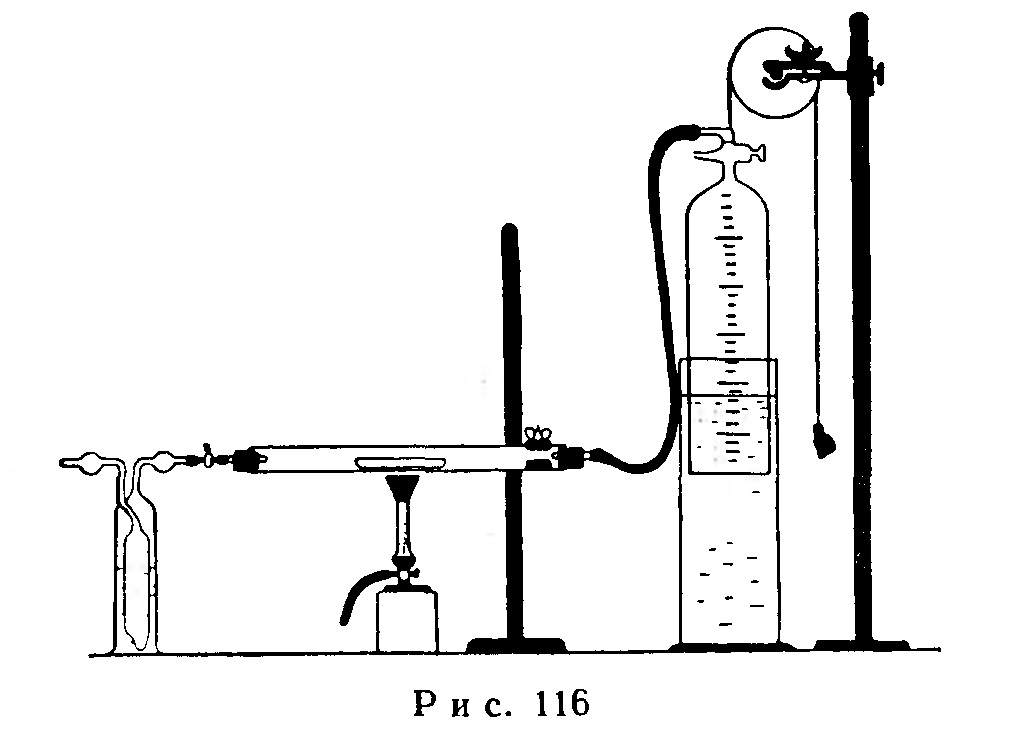 |
Нагревание продолжают 35-40 минут, пока объем газа в газометре не перестанет изменяться.
Дают остыть прибору; при этом устанавливается постоянный объем газа. Затем приводят воду к одному уровню и по делениям газометра определяют объем непрореагировавшего кислорода.
Опыт дает возможность точно определить количество кислорода, затраченного на окисление меди, взвешенной перед началом опыта.
Пользоваться этим прибором для сжигания порошка цинка, магния или кальция запрещается.
Опыт. Подтверждение закона постоянства состава. Точно, до сотых долей грамма, взвешивают пустой фарфоровый тигель с крышкой, который перед этим был тщательно очищен, прокален и охлажден в эксикаторе. Затем в тигель насыпают приблизительно 3-4 г тонкого порошка меди и точно взвешивают тигель с медью.
Кладут тигель в наклонном положении на фарфоровый треугольник и нагревают его на слабом огне в течение 15-20 минут. Затем снимают крышку и сильно нагревают окислительным пламенем горелки. Через 20-25 минут накрывают тигель крышкой и продолжают нагревание. После прекращения нагревания тигель охлаждают в эксикаторе и точно взвешивают.
Данные трех взвешиваний позволяют рассчитать количество кислорода, связанное с 1 г и 63,54 г (грамм-атомом) меди. Записывают:
- g1 = вес пустого тигля с крышкой;
- g2 = вес пустого тигля с крышкой и медью;
- g3 = вес пустого тигля с крышкой и окисью меди.
Повторив опыт с металлической медью и другими металлами, находят, что во всех случаях кислород соединяется с различными элементами в постоянном количественном соотношении, и на практике убеждаются, что отношение между весовым количеством веществ, вступающих в химическое соединение, всегда постоянно.
Опыт. Горение железа в кислороде. Уравнение реакции:
Для опыта пользуются тонкой проволочкой из отпущенной стали диаметром 7-8 мм, один конец которой втыкают в корковую пробку, а к другому ее концу прикрепляют кусочек трута или обматывают нитками и погружают в расплавленную серу (серный фитиль). При введении в сосуд с кислородом (на дне которого должен быть слой песка) стальной спирали с зажженным трутом (или серным фитилем) спираль сгорает, разбрасывая искры.

Горение железа в кислороде angelo.edu |

|

|

|

|

|

|

|
Опыт. Сгорание металлических порошков в воздухе. Над пламенем установленной под тягой газовой горелки высыпают по щепотке порошка меди, цинка, железа, магния, алюминия, сурьмы.
Опыт. Окисление металлов в закрытом сосуде. Опыт позволяет доказать, что при превращении металлов в окислы расходуется часть воздуха и что увеличение веса металлов при их окислении равно потере веса воздуха.
Пробирку с тонким порошком железа плотно закрывают резиновой пробкой, сквозь которую должна быть пропущена стеклянная трубка с надетой на нее резиновой трубкой, имеющей винтовой зажим (рис. 117). Пробка и зажим должны закрывать пробирку герметически.
После взвешивания собранного прибора пробирку нагревают пламенем газовой горелки при непрерывном потряхивании до тех пор, пока в порошке не образуются искры. После охлаждения пробирки взвешиванием на весах проверяют, изменился ли вес пробирки. Затем в резиновую трубку вставляют стеклянную трубку, конец которой опускают в стакан с водой.
При открывании зажима наблюдают, как поднимается по трубке вода. Это происходит вследствие того, что кислород воздуха израсходовался на окисление железа и поэтому в приборе понизилось давление.
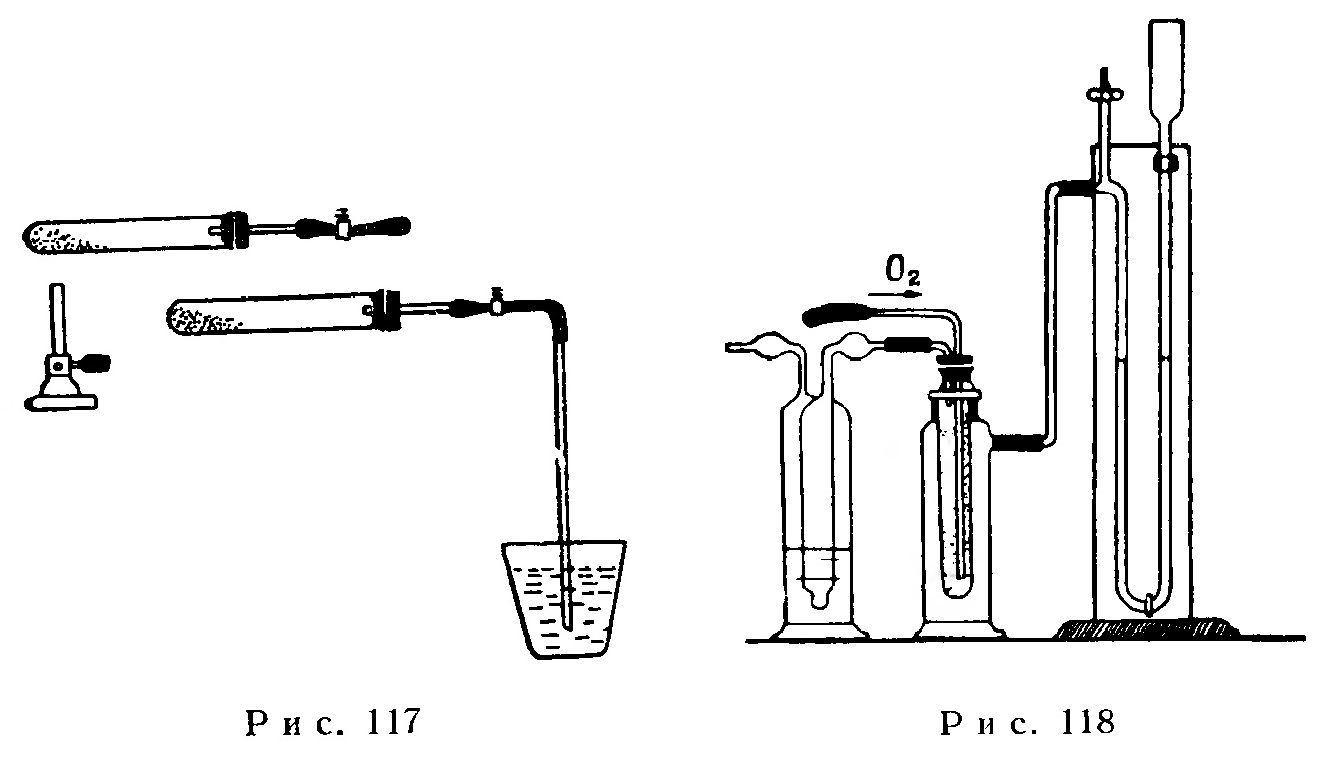 |
Выявить небольшую разницу между весом железа и весом окиси железа можно только с помощью достаточно чувствительных весов.
Вместо пробирки можно пользоваться ретортой или кругло-донной колбочкой, а вместо резиновой пробки - парафинированной корковой пробкой.
Аналогичные опыты были проделаны Ломоносовым и Лавуазье для доказательства закона сохранения материи.
Опыт. Медленное окисление влажного железа. Опыт позволяет установить, что при окислении влажного порошка железа выделяется тепло.
Прибор состоит из термоскопа, соединенного с манометром (рис. 118). В реакционное пространство термоскопа через плотно подогнанную резиновую пробку вводят две трубки. Первая трубка соединена с газовым баллоном и служит для подачи кислорода. Вторая трубка служит для удаления газа; она соединена с промывной склянкой Мюнке, в которую налита вода, подкрашенная индиго или фуксином.
В промывную склянку наливают такое количество воды, чтобы при всасывании во внутреннюю трубку и наполнении ее в склянке еще оставалась вода, которая закрывала бы выходное отверстие трубки.
Для изготовления термоскопа можно пользоваться внешней частью промывной склянки Дрекселя емкостью 300 мл с боковым тубусом. В сосуд вставляют пробирку длиной 23 см и диаметром 2,5 см с несколько суженной шейкой. Верхняя внешняя часть пробирки должна быть притерта к шейке сосуда. При отсутствии указанных выше деталей термоскоп можно изготовить из колбы Бунзена, в шейку которой при помощи резинового кольца вставляют большую пробирку. Термоскоп соединяют с U-образным манометром, в который наливают подкрашенную фуксином воду.
Манометр имеет Т-образный отвод с краном, который облегчает его регулирование.
В конической колбе смешивают 100 г железного порошка с бензолом, фильтруют его через складчатый фильтр, промывают эфиром и быстро (окисленный железный порошок не годится для опыта) просушивают на плитке из пористого керамического материала.
Железный порошок, тщательно смоченный 18 мл дистиллированной воды, рассеивают по стеклянной вате и заполняют ею все реакционное пространство термоскопа.
Для удаления из прибора воздуха через него продувают сильную струю кислорода. Наличие в приборе чистого кислорода устанавливают тем, что подносят тлеющую лучинку к выходному отверстию промывной склянки. Затем прекращают поступление кислорода и уравнивают жидкость в обеих трубках манометра (за манометром укрепляется миллиметровая бумага).
В реакционном сосуде кислород частично соединяется с железом, и уже через несколько минут наблюдают всасывание жидкости во внутреннюю трубку промывной склянки. В таком случае пропускают в термоскоп еще некоторое количество кислорода, чтобы выровнять уровни жидкости во внутренней и внешней трубках промывной склянки. Эту операцию повторяют два-три раза. Изменение давления, отмечаемое манометром, указывает на выделение тепла при окислении.
В разделе, посвященном фосфору, описаны опыты, показывающие медленное окисление белого фосфора.
Опыт. Каталитическое окисление метилового спирта в формальдегид. Реакция протекает по уравнению:
Прибор собирают в соответствии с рис. 119. В колбу Вюрца емкостью 150 мл с оттянутым до диаметра 1 мм концом боковой трубки наливают 50 мл чистого метилового спирта. В тугоплавкую трубку длиной 25-30 см и диаметром 1 см вкладывают валик из медной сетки длиной 10 см, намотанной на толстую медную проволоку. В промывную склянку слева наливают воды, а в склянку справа перед самым началом опыта наливают бесцветный раствор сернистой кислоты Н2SO3 с фуксином. Стакан, в который опускают колбу Вюрца, должен содержать нагретую до 30-40° воду.
Для проведения опыта нагревают воду в стакане до 45-48°, при помощи водоструйного насоса просасывают через прибор сильный ток воздуха и нагревают валик из медной сетки горелкой Теклу, сначала слабым пламенем, затем доводят до красного каления.
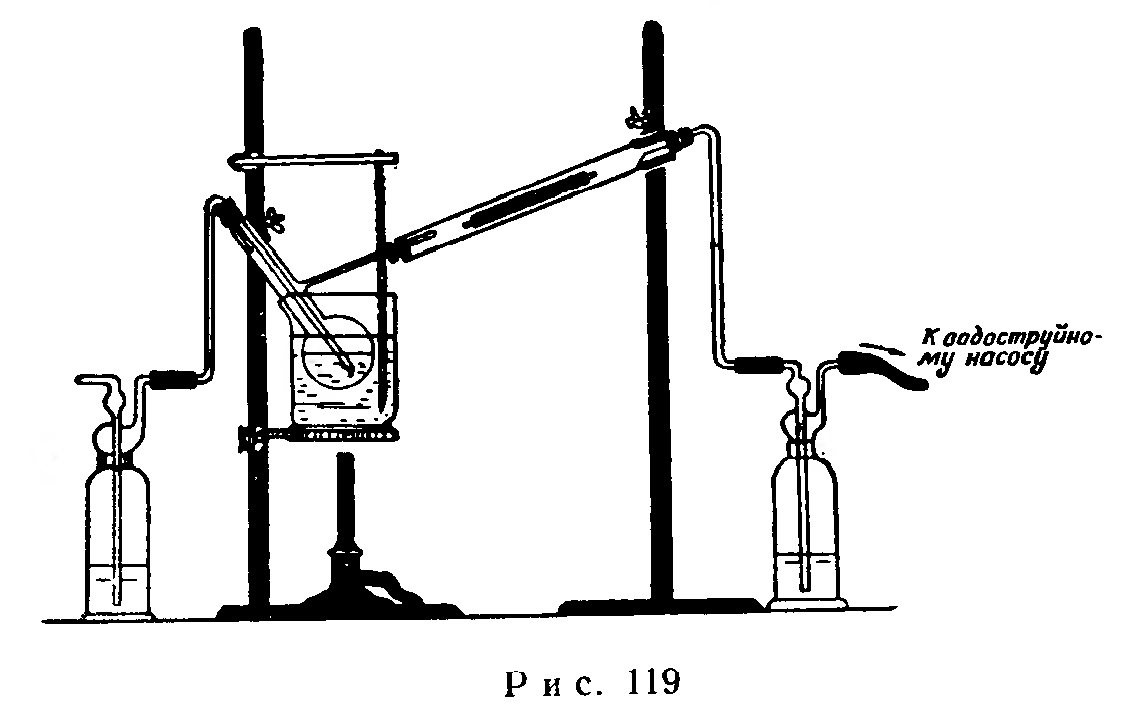 |
Ток воздуха регулируют таким образом, чтобы после того, как уберут горелку, валик из медной сетки оставался раскаленным без подогревания извне.
Через некоторое время смесь сернистой кислоты с фуксином в правой промывной склянке окрашивается в интенсивный красно-фиолетовый цвет.
Параллельно показывают, что реакция раствора формальдегида с бесцветным раствором сернистой кислоты и фуксина является характерной для альдегида.
Для получения бесцветного раствора сернистой кислоты с фуксином растворяют 0,1 г фуксина в 300 мл дистиллированной воды и через полученный раствор пропускают сернистый газ до исчезновения окраски фуксина. Полученный реактив хранят в сосуде с притертой пробкой. Весь опыт длится около пяти минут. По окончании опыта дают прибору остыть в слабом токе воздуха.
При пользовании этиловым спиртом образуется ацетальдегид по уравнению:
Восстановление окисленного валика из медной сетки метиловым спиртом описано в разделе, посвященном азоту (способ получения азота связыванием кислорода воздуха раскаленной медью).
Опыт. Анодное окисление, обесцвечивающее действие кислорода в момент его выделения. Стакан с раствором сульфата натрия накрывают пробочным кружком, сквозь который пропускают два угольных электрода диаметром 5-6 мм.
Анод обертывают несколько раз окрашенной в синий цвет хлопчатобумажной тканью и электроды соединяют с тремя последовательно включенными аккумуляторами.
После 2-3 минут пропускания тока первые два слоя ткани, непосредственно прилегающие к аноду, обесцвечиваются выделяющимся при электролизе атомарным кислородом. Второй и последующие слои ткани, через которые проходят уже устойчивые двухатомные молекулы кислорода, остаются окрашенными.
Опыт. Анодное окисление. Наливают в стакан 25%-ный раствор Н2SO4 и опускают в него два свинцовых электрода в виде пластин. Электроды соединяют с источником постоянного электрического тока напряжением 10 В. При замыкании цепи у анода появляется бурое окрашивание.
Электролиз продолжают до тех пор, пока станет видимой образовавшаяся на аноде двуокись свинца РbO2 бурого цвета.
Если пользоваться серебряным анодом, то на аноде выделяется черная окись серебра Ag2O.
Тушение огня. Зная, что собой представляет горение, легко понять, на чем основано тушение огня.
Огонь можно гасить твердыми веществами, газами и парами, жидкостью и пеной. Чтобы погасить очаг огня, следует изолировать его от воздуха (кислорода), для чего его и забрасывают песком, солью, землей или накрывают плотным покрывалом.
Часто при тушении пожаров пользуются огнетушителями, описание которых приводится в разделе, посвященном углекислому газу.
При тушении горящих дровяных складов, соломы, текстиля, бумаги пользуются так называемыми сухими огнетушителями, выбрасывающими твердый углекислый газ, имеющий температуру -80°C. В этом случае пламя гаснет из-за сильного снижения температуры и разбавления кислорода воздуха углекислым газом, не поддерживающим горения. Эти огнетушители удобны при пожарах на электростанциях, телефонных узлах, заводах по производству масел и лаков, спиртовых заводах и т.д.
Примером применения газов для тушения пожаров может служить использование сернистого газа, образующегося при сгорании бросаемой в печь или дымоход серы, для гашения загоревшейся в печном дымоходе сажи.
Наиболее распространенной и дешевой жидкостью для тушения пожаров является вода. Она понижает температуру пламени, а пары ее препятствуют доступу воздуха к горящим предметам. Однако водой не пользуются для гашения горящего масла, бензина, бензола, нефти и других горючих жидкостей легче воды, так как они всплывают на поверхность воды и продолжают гореть; применение воды в этом случае лишь способствовало бы распространению огня.
Для тушения бензина и масел пользуются пенообразующими огнетушителями; выбрасываемая ими пена остается на поверхности жидкости и изолирует ее от кислорода воздуха.
 |
ПРИМЕНЕНИЕ КИСЛОРОДА
Без кислорода ни одно животное не может существовать.
Пропитанные жидким кислородом уголь, нефть, парафин, нафталин и ряд других веществ применяются для приготовления некоторых взрывчатых веществ.
Смеси жидкого кислорода с угольным порошком, древесной мукой, маслом и другими горючими веществами получили название оксиликвитов. Они обладают очень сильными взрывчатыми свойствами и применяются в подрывных работах.
ОЗОН O3
В очень малых количествах озон содержится в атмосфере: у поверхности земли концентрация его составляет 10-7%, а на высоте 22 км от земной поверхности - 10-6%. На поверхности земли озон встречается главным образом у водопадов, на берегу моря (где он, как и атомарный кислород, образуется под влиянием ультрафиолетовых лучей), в хвойных лесах (здесь он образуется в результате окисления терпенов и других органических веществ); озон образуется при грозовых разрядах. На высоте около 22 км от земной поверхности он образуется из кислорода под влиянием ультрафиолетовых лучей солнца.
Озон получают из кислорода; при этом необходимо затратить внешнюю энергию (тепловую, электрическую, излучение). Реакция протекает по уравнению:
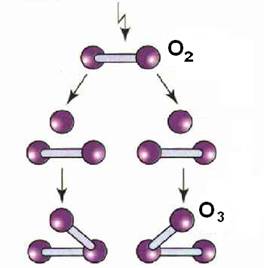 Схема образования озона из кислорода |
Таким образом, превращение кислорода в озон является эндотермической реакцией, при которой происходит уменьшение объема газов.
Молекулы кислорода под влиянием тепловой, световой или электрической энергии распадаются на атомы. Являясь более реакционноспособными, чем молекулы, атомы вступают в соединение с недиссоциированными молекулами кислорода и образуют озон.
Количество образующегося озона тем больше, чем ниже температура, и почти не зависит от давления, при котором протекает реакция. Оно ограничено скоростями распада получившихся молекул озона и их образования в результате фотохимического действия (при электрических разрядах, под влиянием излучения кварцевых ламп).
При всех способах получения озона в условиях, близких к обычной температуре, характерным является низкий его выход (около 15%), объясняющийся неустойчивостью этого соединения.
Разложение озона может быть частичным (когда оно протекает самопроизвольно при обычной температуре; в этом случае оно пропорционально концентрации) и полным (в присутствии катализаторов).
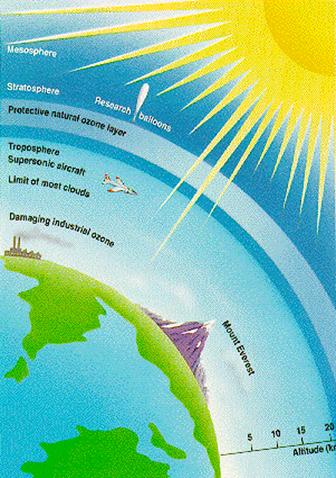 В стратосфере на высоте 15-35 км содержится озоновый слой, который защищает Землю от ультрафиолетового излучения. Многие слышали о так называемой "озоновой дыре". В реальности это лишь частичное уменьшение содержания озона, которое является существенным только над южным полюсом планеты. Но даже здесь разрушение озонового слоя является лишь частичным. Вполне возможно, что "озоновая дыра" образовалась еще задолго до возникновения человечества. Заметные количества озона также образуются вблизи поверхности планеты. Одним из основных источников является антропогенные загрязнения (особенно в больших городах). Этот озон далеко не безвреден – он представляет значительную опасность для здоровья людей и окружающей среды (прим. ред.) |
 Распределение озона над южным полушарием 21-30 сентября 2006 г. Синим, фиолетовым и красным обозначены участки с пониженным содержанием озона, зеленым и желтым – области с более высоким содержанием озона. Данные NASA. (прим. ред.) |
ХИМИЧЕСКИЕ СПОСОБЫ ПОЛУЧЕНИЯ ОЗОНА
Опыт. Получение озона действием концентрированной серной кислоты на перманганат калия. Уравнения реакций:
- 2KMnO4 + H2SO4 = 2НMnO4 + К2SO4 (реакция обмена),
- 2НMnO4 + Н2SO4 = Мn2O7 + Н2O + Н2SO4 (реакция дегидратации),
- Мn2O7 → 2МnO2 + 3O,
- Мn2O7 → 2МnО + 5O (обе реакции окислительно-восстановительного
разложения могут протекать одновременно; более энергичное разложение приводит к образованию МnО),
- 3O + 3O2 = 3O3 (реакция образования озона).
Образовавшийся согласно приведенным выше уравнениям марганцевый ангидрид Мn2O7 представляет собой тяжелую маслянистую жидкость зеленовато-бурого цвета, разлагающуюся при 40-50° на МnO2, МnO и атомарный кислород, который, соединяясь с молекулярным кислородом воздуха, образует озон.
Вместо ступки можно пользоваться фарфоровой чашкой, часовым стеклом или асбестовой плиткой.
Внесенный в атмосферу озона на кончике проволоки комок ваты, смоченный в эфире, немедленно воспламеняется. Вместо эфира вату можно смочить спиртом, бензином или скипидаром.
Смоченная водой иодкрахмальная индикаторная бумага окрашивается озоном в синий цвет. Это явление объясняется реакцией:
Иодкрахмальную бумагу получают смачиванием полосок фильтровальной бумаги в смеси бесцветного концентрированного раствора иодида калия и крахмального раствора.
Синяя окраска иодкрахмальной бумаги постепенно исчезает, поскольку между иодом и гидратом окиси калия протекает реакция:
В присутствии избытка озона свободный иод окисляется; при этом протекают реакции:
 Взаимодействие Мn2O7 с шерстью |
Опыт. Получение озона действием концентрированной азотной кислоты на персульфат аммония. Источником атомарного кислорода в этом опыте является надсерная кислота, образующаяся в результате реакции обмена между персульфатом аммония и азотной кислотой, а источником молекулярного кислорода — разлагающаяся при нагревании азотная кислота.
В основе этого способа получения озона лежат следующие реакции:

Необходимый для опыта прибор показан на рис. 120. Небольшую колбочку, содержащую 2 г персульфата аммония и 10 мл концентрированной азотной кислоты, посредством шлифа соединяют со стеклянной трубкой, конец которой опускают в пробирку с раствором иодида калия и небольшим количеством крахмала.
Через некоторое время после начала нагревания колбы на слабом огне раствор в пробирке окрашивается в синий цвет. Однако в результате взаимодействия иода с гидратом окиси калия синий цвет вскоре исчезает.
0,5%-ный раствор индигокармина или 1%-ный раствор индиго в концентрированной Н2SO4 изменяет цвет от синего до бледно-желтого из-за окисления озоном индиго в изатин по уравнению:
Вместо колбочки в этом опыте можно пользоваться пробиркой с газоотводной трубкой.
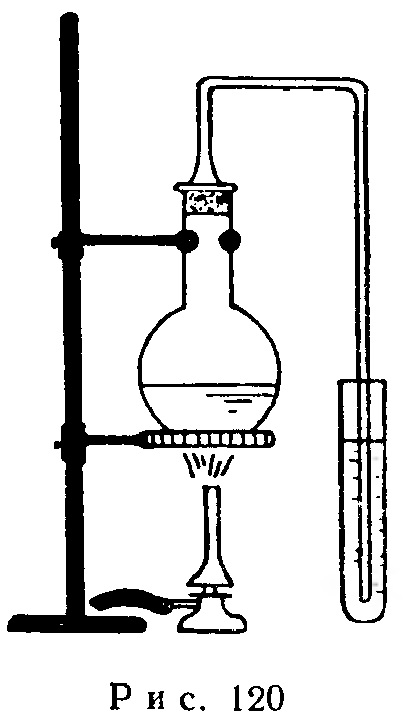 |
Опыт. Получение озона при самоокислении влажного белого фосфора. Медленное окисление белого фосфора кислородом воздуха протекает в две стадии. Сначала образуется фосфористый ангидрид и озон, а затем фосфористый ангидрид окисляется до фосфорного ангидрида.
 Индиго |
Предварительно очищенный под водой от поверхностной пленки белый фосфор кладут при помощи металлических щипцов в стеклянный цилиндр емкостью 1,5-2 л.
Наливают в цилиндр дистиллированной воды столько, чтобы она на 2/3 покрывала фосфорные палочки, и ставят его в кристаллизатор с водой, нагретой до 25°.
место цилиндра можно воспользоваться колбой емкостью 500 мл, в которой фосфор можно нагреть до его плавления (приблизительно до 44°) при непрерывном взбалтывании.
Присутствие озона обнаруживают приблизительно через два часа после начала опыта по характерному, напоминающему чеснок запаху и индикаторной иодкрахмальной бумагой; обнаружить озон можно приливанием в пробирку с взятым из цилиндра раствором нескольких капель сульфата титанила.
Сульфат титанила получают нагреванием под тягой в фарфоровой чашке 1 г двуокиси титана с двойным объемом концентрированной серной кислоты до начала выделения белых паров. После охлаждения содержимое чашки постепенно вводят в 250 мл ледяной воды. В воде сульфат титана Ті(SO4)2 переходит в сульфат титанила.
В присутствии озона бесцветный раствор сульфата титанила переходит в желто-оранжевый раствор пертитановой кислоты, реакция протекает по уравнению:
ПОЛУЧЕНИЕ ОЗОНА ЭЛЕКТРОЛИЗОМ КИСЛОТ
- Н2SO4 → НSO4- + Н+ (ионы концентрированной серной кислоты),
- Н2O ↔ ОН- + Н+ (ионы воды),
- На катоде: 2Н + 2e- → 2Н → Н2 (выделяется водород),
- На аноде: НSO4- - 2е- → Н2S2O8.
- Надсерная кислота разлагается в воде по уравнению:
Н2S2O8 + 2Н2O = 2Н2SO4 + Н2O + O (на аноде выделяется кислород).
В зависимости от условий (плотности тока и температуры) на аноде образуются надсерная кислота, озон и молекулярный кислород.
При электролизе подкисленной воды озон образуется в том случае, когда анод сделан из неокисляющегося металла, а вода не содержит веществ, способных поглощать кислород.
Прибор собирают в соответствии с рис. 121. В стакан емкостью 150 мл наливают 100 мл 20-50%-ного раствора серной кислоты, в которую погружают катод, сделанный из свинцовой пластинки (25 х 10 мм), и анод, которым служит платиновая проволока диаметром 0,5 мм, впаянная в стеклянную трубку длиной 9 см и диаметром 5 мм. Проволоку впаивают таким образом, чтобы свободный конец ее выходил из трубки на 1 см. Платиновую проволоку соединяют с внешним проводом при помощи нескольких капель ртути, вводимых в трубку. Анод сквозь парафинированную корковую пробку вводят в открытую трубку длиной 9 см и диаметром 1,5 см, которая в верхней части имеет боковую трубочку.
После замыкания электрической цепи, при силе тока в 1,5 А, у отверстия боковой трубочки по запаху или при помощи иодкрахмальной бумаги можно обнаружить озон.
Если пользоваться платиновым анодом и применять охлаждение электролизера до -14°, озон в небольшом количестве можно получить и при электролизе разбавленной Н2SO4.
Озон получают также и электролизом хромовой, уксусной, фосфорной и фтористоводородной кислот.
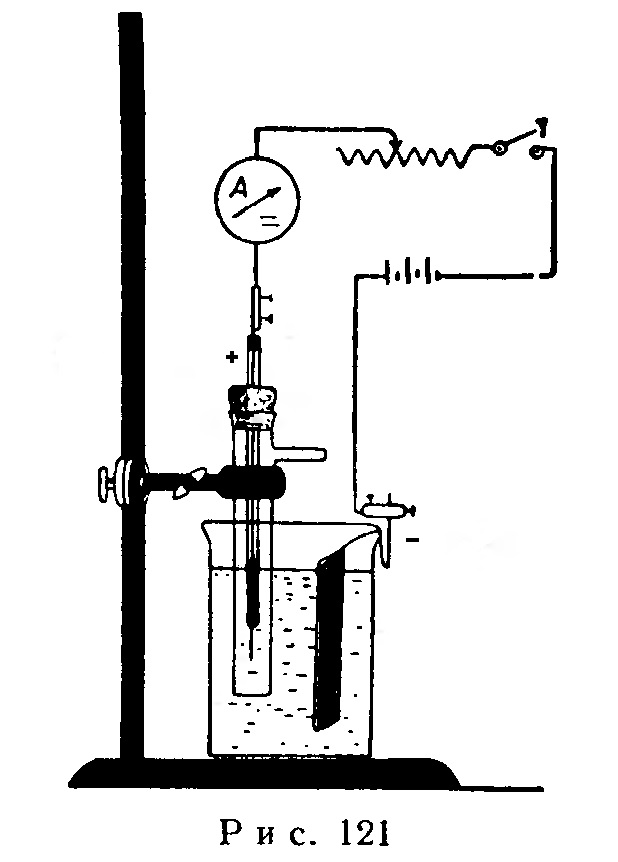 |
ПОЛУЧЕНИЕ ОЗОНА ПРИ ЭЛЕКТРИЧЕСКОМ РАЗРЯДЕ В КИСЛОРОДЕ
При соединении проводов эвдиометра с вторичными клеммами индукционной катушки между платиновыми проволочками проскакивают искры и подкрахмаленный раствор иодида калия начинает окрашиваться в синий цвет. Окисление озоном раствора иодида усиливается при его взбалтывании.
Вместо эвдиометра Бунзена можно пользоваться прибором, указанным на рис. 122, изготовленным из толстого стекла. Этот прибор мог бы озонировать весь введенный кислород, если бы не происходило нагревания при искровых разрядах, ускоряющего обратную реакцию разложения озона.
Раствор иодида калия с добавкой крахмала готовят следующим образом: растирают в ступке 0,5 г крахмала в небольшом количестве воды, полученное тесто вводят при помешивании в 100 мл кипящей воды; после остывания крахмального раствора в него добавляют предварительно растворенные в небольшом количестве воды 0,5 г КI.
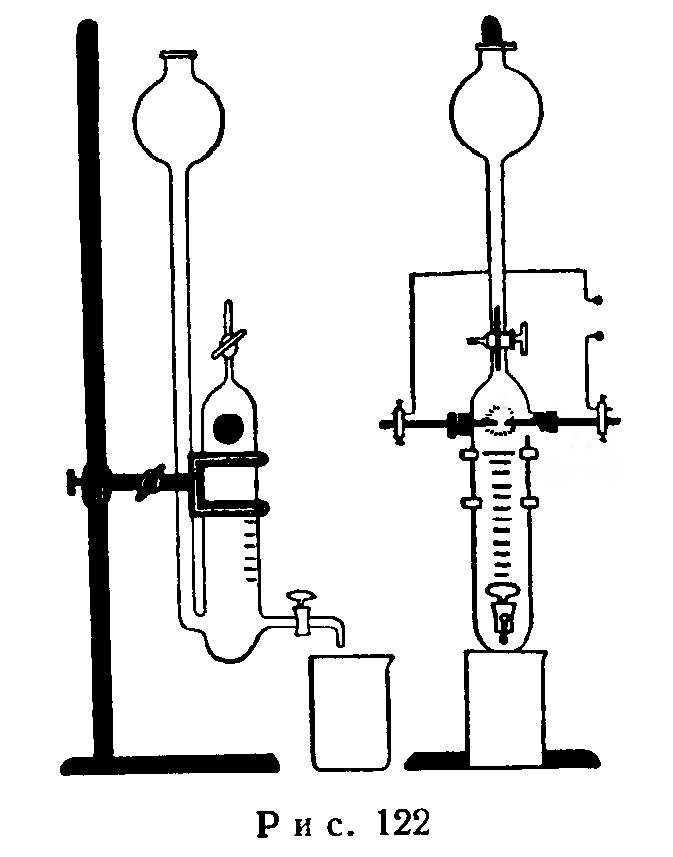 |
ПОЛУЧЕНИЕ ОЗОНА ДЕЙСТВИЕМ ТИХОГО ЭЛЕКТРИЧЕСКОГО РАЗРЯДА В ОЗОНАТОРАХ
 Тихий электрический разряд |
Озонатор - прибор для получения озона |
При пропускании тока чистого и сухого кислорода (воздуха) через озонатор под действием тихого электрического разряда электрических разрядов без искр) некоторая часть кислорода {максимум 12-15% по объему) превращается в озон.
Влажным и пыльным воздухом для этой цели пользоваться нельзя, так как при электрических разрядах в этом случае образуется густой туман, оседающий на электродах и стеклянных стенках озонатора; в результате вместо тихих разрядов в озонаторе начинают проскакивать искры, и образуется окись азота; окись азота в присутствии кислорода окисляется до двуокиси азота, разрушающей электроды.
Источником кислорода может быть газометр или кислородный баллон; поступающий в озонатор кислород предварительно пропускают через промывную склянку с концентрированной Н2SO4.
Под действием таких электрических разрядов в пространстве, занятом кислородом, образуются ионы и электроны, вызывающие при столкновении с молекулами кислорода их распад.
Присутствие озона обнаруживают описанными выше способами, а также способами, указанными при описании свойств озона.
Ниже приводятся описания некоторых типов озонаторов.
Озонатор Верховского (рис. 123) состоит из стеклянной трубки длиной 40-50 см и диаметром 2 см, закрытой с обеих сторон парафинированными корковыми пробками (резиновые разрушаются озоном). Через центр одной из пробок пропущена прямая железная проволока, проходящая вдоль оси трубки, и стеклянная трубка, по которой поступает в озонатор сухой кислород. Через вторую трубку пропущена еще одна стеклянная трубка, служащая для удаления газа из озонатора; эта же трубка служит опорой для второго конца проходящей через озонатор железной проволоки.
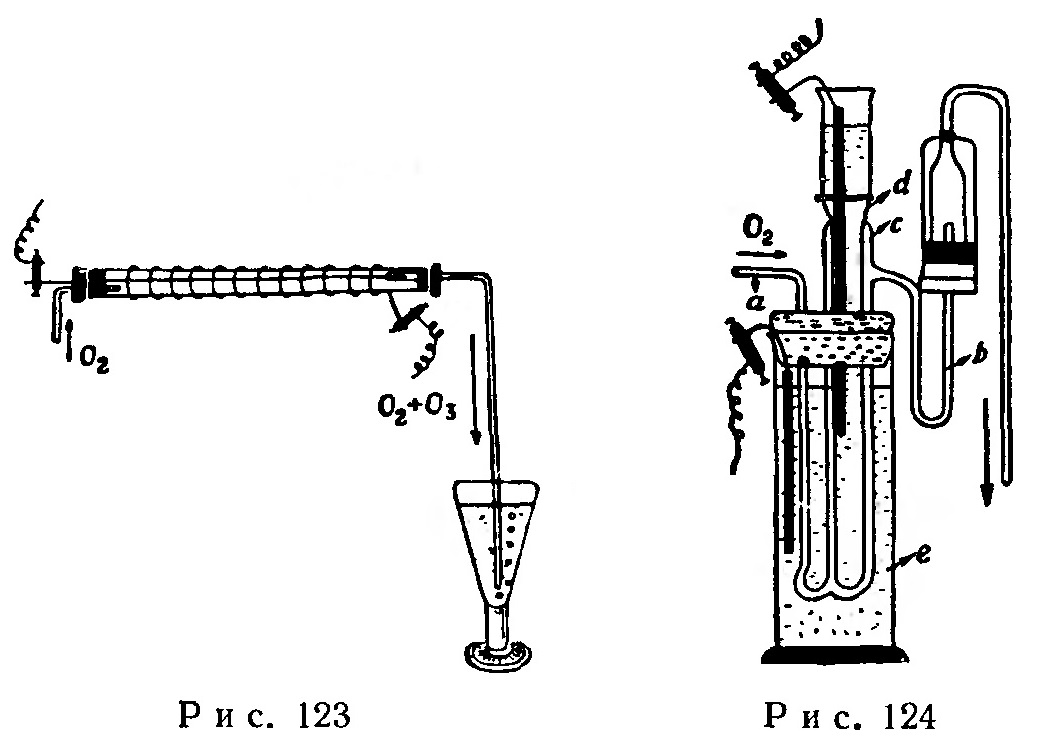 |
Снаружи трубка озонатора должна быть обмотана железной или медной проволокой (диаметр спирали 2-2,5 см); она может быть также оклеена оловянной, алюминиевой или свинцовой фольгой.
Концы внутренней проволоки и наружной спирали присоединяют к полюсам индукционной катушки (Румкорфа).
Пользоваться катушкой очень высокого напряжения не рекомендуется; катушка должна быть средней, дающей искры длиной 5-10 см.
Учитывая высокое напряжение, при работе с озонатором необходимо соблюдать осторожность. Ток включают только на время, необходимое для получения озона.
Питание электрическим током производят при помощи толстого медного провода; во избежание соприкосновения провода с поддерживающим озонатор штативом провод должен быть тщательно изолирован.

Катушка Румкорфа |
 |
Озонатор Бертло (рис. 124) состоит из широкой трубки с с припаянными к ней двумя стеклянными трубками а и b, по которым кислород поступает в прибор и удаляется из него. К трубке с припаивают либо присоединяют на шлифе входящую в нее более узкую трубку d. В трубку d наливают подкисленную серной кислотой воду. Один из проводов погружают во внутреннюю трубку d, а второй — в сосуд е. Погружаемый в сосуд е провод может иметь форму прямого стержня или спирали.
При действии прибора через трубку а кислород поступает в озонатор, а через b удаляется из него.
Для прибора необходима индукционная катушка, дающая ток в 0,05 А, напряжением 8000-10000 В.
Озонатор Сименса (рис. 125). В основу его положен шариковый стеклянный водяной холодильник с активной длиной 50 см.
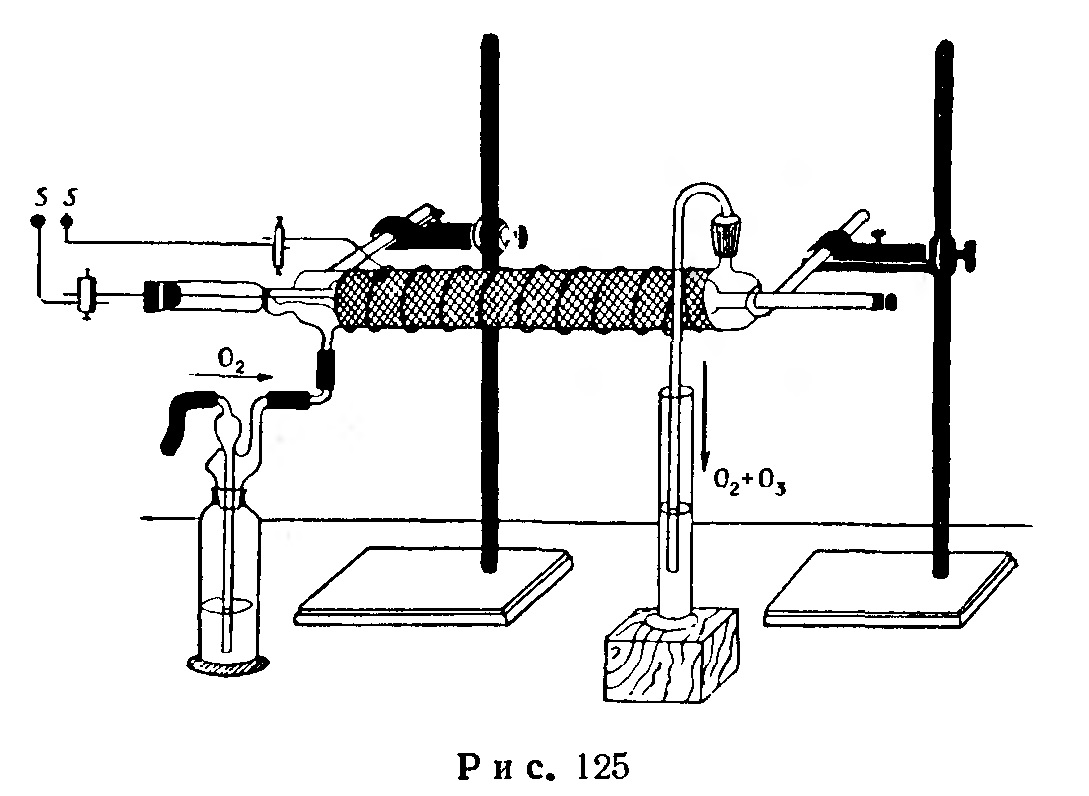 |
После того как один конец внутренней трубки будет закрыт резиновой пробкой, заполняют внутреннюю трубку водой, подкисленной серной кислотой, и закрывают ее также резиновой пробкой, через которую должна быть пропущена толстая медная проволока, доходящая до первого шарика. Пробку закрывают таким образом, чтобы в трубке не осталось пузырьков воздуха.
Внешнюю трубку холодильника обертывают оловянной (или алюминиевой) фольгой, на которую наматывают спираль из чистой медной проволоки. Конец спирали и пропущенной во внутреннюю трубку медной проволоки соединяют с индукционной катушкой, питаемой источником постоянного тока 4-6 А и создающей напряжение 30000-50000 В.
При помощи двух стеклянных палочек длиной 25 см и толщиной 8-10 мм, один конец которых загнут в виде крючка, а другой укреплен в зажиме штатива, озонатор подвешивают в горизонтальном положении.
Промывную склянку соединяют с источником кислорода и озонатором при помощи резиновых трубок, в которые встык должны быть вставлены стеклянные трубки. Вторую боковую трубку холодильника при помощи парафинированной корковой пробки соединяют с согнутой стеклянной трубкой, проходящей в нескольких сантиметрах от холодильника.
Выпускаются серийные озонаторы, в которых серная кислота заменена металлической фольгой. Прибор состоит из стеклянной или фарфоровой трубки, оклеенной снаружи металлической фольгой; внутри трубки находится закрытый пустой металлический цилиндр. Иногда применяют целые батареи, состоящие из 6-8 соединенных последовательно озонаторов. Трубки, по которым проходит озон, делают из неокисляемого материала.
ПОЛУЧЕНИЕ ОЗОНА ПРИ ЭЛЕКТРИЧЕСКИХ РАЗРЯДАХ В ВОЗДУХЕ И ОБЛУЧЕНИИ КИСЛОРОДА УЛЬТРАФИОЛЕТОВЫМИ ЛУЧАМИ
Образование озона ощущается по характерному чесночному запаху и устанавливается индикаторной иодкрахмальной бумагой, которую следует подносить сухими деревянными щипцами.
Образование озона вокруг излучающих ультрафиолетовые лучи кварцевых ламп объясняется фотохимическими реакциями. Каждый квант ультрафиолетового излучения с длиной волны 2090 Å может привести к образованию двух молекул озона. По закону эквивалентности Эйнштейна каждый поглощенный квант света способен активизировать одну молекулу кислорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ПРОВЕРКА УМЕНЬШЕНИЯ ОБЪЕМА ГАЗА ПРИ ПОЛУЧЕНИИ ОЗОНА ИЗ ЧИСТОГО СУХОГО КИСЛОРОДА ПОД ДЕЙСТВИЕМ ТИХОГО ЭЛЕКТРИЧЕСКОГО РАЗРЯДА
В манометр наливают такое количество слегка подкрашенной индиго концентрированной серной кислоты, чтобы она приблизительно наполовину заполнила короткое колено трубки. Уровень Н2SO4 перед началом опыта в обеих трубках должен быть одинаков. В манометр не наливают ртути, так как при соприкосновении с озоном она вступает с ним в химическую реакцию.
Из озонатора удаляют воздух продуванием сильного тока чистого и сухого кислорода, закрывают кран слева и присоединяют к отводной трубке широкую трубку с манометром.
Отмечают уровень Н2SO4 в манометре и включают ток.
Через некоторое время изменение уровня серной кислоты в манометре указывает на уменьшение объема газа.
При проведении этого опыта нельзя пользоваться резиновыми пробками и трубками, так как резина сильно поглощает озон.
Озон можно выделить из смеси его с кислородом сжижением и дробной перегонкой.
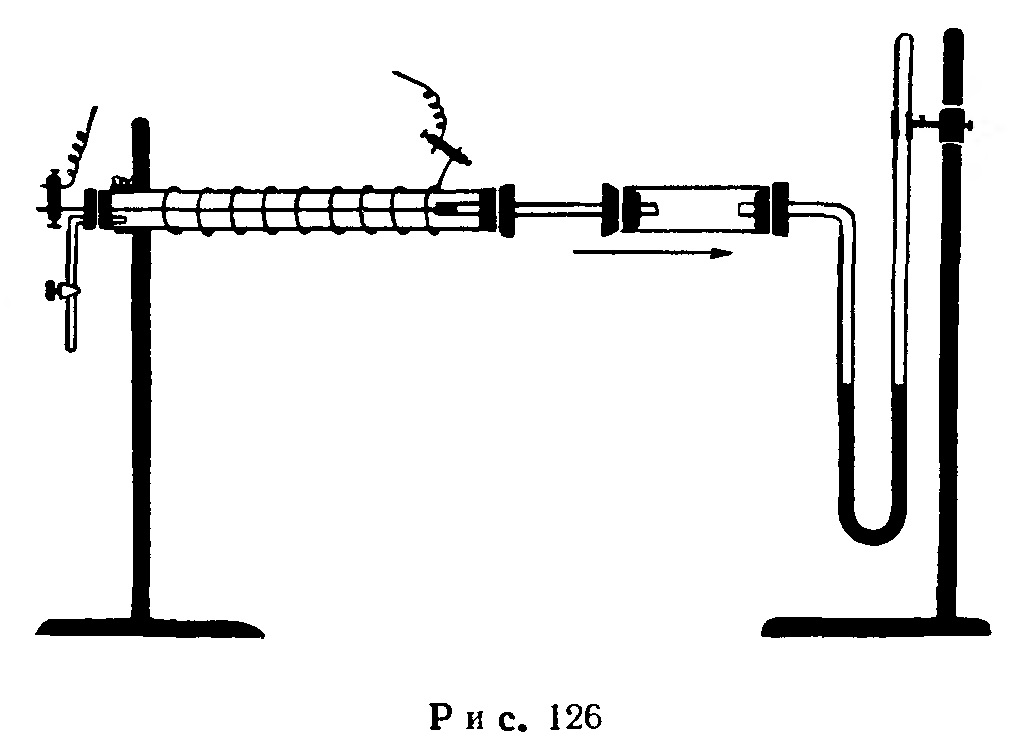 |
СВОЙСТВА ОЗОНА
В воде озон плохо растворяется, поэтому его можно собирать в ссуды, применяя способ вытеснения воды. Если газоотводную трубку озонатора опустить в стакан с водой, то можно заметить распространение запаха озона.
Сероуглерод СS2 растворяет озон, при этом раствор окрашивается в синий цвет. Самым лучшим растворителем озона является четыреххлористый углерод ССI4, один объем которого поглощает три объема озона; в этом случае растворение также сопровождается окрашиванием жидкости в синий цвет.
Температура кипения озона -112,5°; температура плавления -251,4°.
При охлаждении озона до -112,5° он превращается в жидкость сине-фиолетового цвета, взрывающуюся при взбалтывании, поэтому с ней следует обращаться очень осторожно. Удельный вес озона равен 1,78; жидкий озон с кислородом смешивается не в любых соотношениях и очень легко выделяется из смеси.
При охлаждении до -251,4° озон превращается в кристаллы темно-фиолетового цвета, взрывающиеся при простом прикосновении к ним.
Озон является сильным окислителем. Нормальный окислительный потенциал его Е0 = +1,90 B. Он реагирует при обычной температуре с теми веществами, с которыми кислород реагирует только при высокой температуре.
Об окислении озоном индикаторной иодкрахмальной бумаги (или иодкрахмального раствора иодида калия), сульфата титанила ТiOSO4 и индиго сказано в разделе получения озона.

Жидкий озон имеет фиолетовый цвет и легко взрывается |
 |
Опыт. Обесцвечивание лакмуса. При пропускании озона через синий или красный раствор лакмуса наблюдается обесцвечивание раствора из-за окисления лакмуса.
Опыт. Окисление ртути озоном. В пробирку со слегка подогретой ртутью пропускают через тонкую совершенно сухую стеклянную трубочку озон. Некоторое время спустя на поверхности ртути образуется тонкий слой черной закиси ртути, которая при встряхивании прилипает к стенкам пробирки.
Если пропускать озон через ртуть, то последняя окисляется и теряет подвижность; при опрокидывании пробирки ртуть остается на ее стенках.
Опыт. Окисление серебра озоном. Реакция протекает по уравнению:
К отверстию стеклянной трубки, по которой поступает озонированный кислород, при помощи щипцов подносят серебряную пластинку. Через некоторое время серебро окисляется, в результате чего на пластинке появляется темно-коричневое пятно.
Затем пластинку переносят в пламя с температурой 950° (не выше, чтобы не расплавился металл!) и наблюдают, что происходит с пятном.
Опыт. Окисление озоном гидрата окиси свинца. Уравнение реакции:
Если перед отверстием узкой стеклянной трубочки, по которой поступает озонированный кислород, подержать полоску фильтровальной бумаги, содержащей осадок гидрата окиси свинца, то индикаторная бумага окрашивается в коричневый цвет в результате окисления гидрата окиси двухвалентного свинца.
Гидрат окиси свинца получают взаимодействием 0,5 М раствора ацетата свинца и разбавленною раствора NaОН (или КОН).
Опыт. Окисление озоном сульфида свинца до сульфата. Уравнение реакции:
Фильтровальную бумагу, смоченную раствором ацетата свинца, держат до ее почернения над склянкой с раствором сероводорода, а затем подносят к узкой трубочке, по которой поступает озонированный кислород.
Под влиянием окисления озоном темный цвет сульфида свинца исчезает; однако бумага снова чернеет под действием сероводорода.

Галенит (свинцовый блеск) - сульфид свинца(II) PbS |
Опыт. Окисление резины озоном. При пропускании через узкую резиновую трубку озонированного кислорода озон, окисляя резину, разрушает ее макромолекулярное строение; на трубке появляются продольные трещины, и она начинает распадаться на куски.
Кроме резины, озон окисляет и другие органические соединения с двойной связью; окислению подвергаются жиры, корковые пробки и т.п.
Поэтому краны приборов, применяемых для получения озона, никогда не смазывают жирами, а при сборке прибора пользуются парафинированными корковыми пробками.
Опыт. Реакция Арнольда. Если поднести к отверстию узкой стеклянной трубки, из которой поступает озонированный кислород, полоску фильтровальной бумаги, смоченной раствором тетраметилдиаминодифенилметана в метиловом спирте, бумага окрашивается в фиолетовый цвет.
Для наглядного сравнения полоски фильтровальной бумаги, смоченной тем же раствором, держат над склянкой с хлорной водой (окрашивается в синий цвет), над склянкой с бромной водой (синий цвет), над пробиркой с раствором уксусной кислоты и нитрита натрия (желтый цвет) и над пробиркой с перекисью водорода (не окрашивается).
Опыт. Окисление озоном железистосинеродистого калия. Реакция протекает по уравнению:
При пропускании озонированного кислорода через желтый раствор железистосинеродистого калия происходит окисление озоном и окраска становится красновато-коричневой.
РАЗЛОЖЕНИЕ ОЗОНА
При работающем озонаторе с помощью индикаторной иодкрахмальной бумаги устанавливают присутствие озона. Если узкую стеклянную трубку нагревать, то присутствие озона не обнаруживается.
Опыт. Каталитическое разложение озона. Отводную трубку какого-либо озонатора (например, озонатора Сименса) при помощи узкой стеклянной трубки и двух парафинированных корковых пробок соединяют со стеклянной трубкой длиной 20 см и диаметром 12 мм, как показано на рис. 127.
Вводя в широкую трубку попеременно слой стеклянной ваты с порошком двуокиси марганца или свинца (10 см) или слой активированного гранулированного угля, убеждаются, что, проходя через них, озон разлагается.
Разложение озона сопровождается выделением тепла и увеличением объема газа.
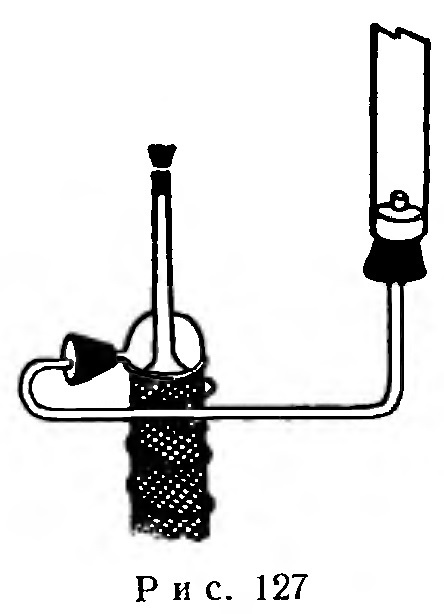 |
ПРИМЕНЕНИЕ ОЗОНА
ПЕРЕКИСЬ ВОДОРОДА Н2O2
 |
РАСПРОСТРАНЕНИЕ
ПОЛУЧЕНИЕ
Прибор собирают в соответствии с рис. 128. Электролитической ванной служит стакан емкостью 250-300 мл, заполненный серной кислотой (уд. вес 1,2-1,25) и накрытый асбестовой пластинкой.
Сквозь пластинку пропускают анод и стеклянный цилиндр диаметром 3 см, внутри которого находится катод, а также стеклянную трубку, по которой из газометра или баллона поступает чистый кислород. Подающая кислород трубка с оттянутым кончиком проходит снизу под цилиндр и заканчивается у самого катода.
Вблизи анода в асбестовой пластинке проделывают еще одно отверстие для удаления кислорода, выделяющегося у анода.
Анодом служит платиновая пластинка, расположенная на более высоком уровне по сравнению с катодом. Катод изготовляется из платиновой или палладиевой пластинки.
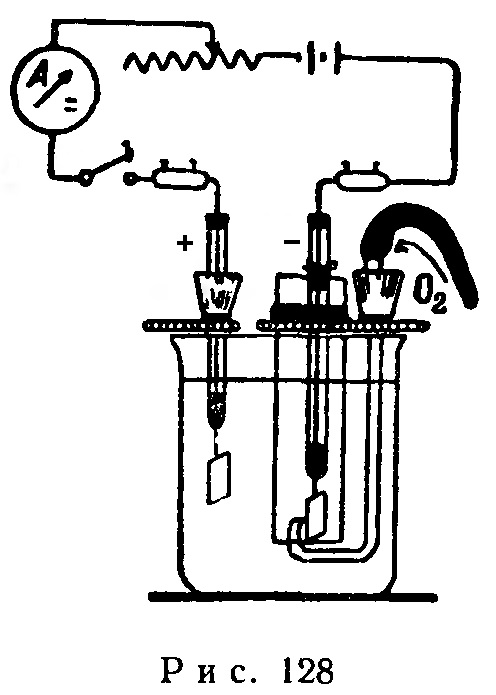 |
Источником электрической энергии является батарея аккумуляторов напряжением 10 В.
После сборки прибора берут пипеткой из анодного пространства 10 мл электролита, выливают его в стакан и добавляют несколько капель раствора сульфата титанила. Никакого окрашивания в этом случае не происходит.
Через 5-10 минут после начала электролиза при силе тока 4-5 А и пропускании сильной струи кислорода выключают ток и берут пробу электролита. На этот раз при добавлении сульфата титанила электролит окрашивается в желто-оранжевый цвет; это объясняется образованием пероксодисульфатотитановой кислоты:

При более длительном электролизе пробы на сульфат титанила дают более интенсивное окрашивание. При этом имеют место следующие реакции:
Опыт. Получение перекиси водорода действием на щелочные перекиси (Na2O2 или К2O2) разбавленных кислот. Реакция протекает по уравнениям:
Опыт проводят в пробирке. Получение этим способом перекиси водорода не очень удобно из-за трудности ее отделения от щелочных сульфатов.
Нельзя также рекомендовать получение перекиси водорода действием воды на щелочные перекиси, так как в этих реакциях перекись водорода является только промежуточным соединением, которое в присутствии щелочей разлагается на кислород и воду; поэтому реакция взаимодействия щелочных перекисей и воды лежит в основе одного из мокрых способов получения кислорода.
Опыт. Получение перекиси водорода из перекиси бария действием серной кислоты. Уравнение реакции:
В стакан наливают 120 мл воды, добавляют 5 мл концентрированной Н2SO4 (уд. вес 1,84) и погружают его в кристаллизатор со смесью льда и соли. Положив в стакан немного льда при 0°С, постепенно при непрерывном помешивании добавляют суспензию перекиси бария, которую получают растиранием в ступке 15 г ВаO2 с 30 мл ледяной воды. Суспензия является гидратом перекиси бария ВаO2•8Н2O.
После отфильтрования сульфата бария получают 3-5%-ный раствор перекиси водорода. Небольшой избыток кислоты не мешает получению перекиси.
Присутствие перекиси водорода открывают следующим образом: наливают в пробирку 2 мл испытываемого раствора и 2 мл Н2SO4, приливают эфира (слой толщиной 0,5 см) и добавляют несколько капель раствора хромата калия. В присутствии перекиси водорода в кислой среде хроматы (а также и бихроматы) образуют интенсивно окрашенные надхромовые кислоты, при этом протекает реакция:
Надхромовая кислота Н2CrO6 со структурной формулой

окрашена в синий цвет и разлагается уже при комнатной температуре; поэтому окраска раствора быстро исчезает. Эфир экстрагирует кислоту из раствора при встряхивании и делает ее более устойчивой.
Перекисные соединения хрома восстанавливаются до соединений трехвалентного хрома (зеленого цвета) с выделением кислорода.
Опыт. Перекись водорода можно также получить при гидролизе пербората натрия и перкарбоната бария. При этом реакция протекает по уравнениям:
СВОЙСТВА ПЕРЕКИСИ ВОДОРОДА
В максимальной концентрации — это сиропообразная жидкость с удельным весом 1,5. В толстом слое имеет голубой цвет.

Такие следы оставляет 30% раствор перекиси водорода при попадании на кожу |
В воде, этиловом спирте, этиловом эфире растворяется в любых соотношениях. В продаже перекись водорода обычно встречается в виде 3%-ного и 30%-ного раствора в дистиллированной воде. Последний носит название «пергидроль». Под давлением 26 мм рт. ст. кипит при 69,7°. Затвердевает при -2°.
Более устойчивыми являются разбавленные растворы перекиси водорода; что касается концентрированных растворов, то они разлагаются со взрывом по уравнению:
Разложению перекиси водорода благоприятствуют свет, тепло, некоторые неорганические и органические вещества, шероховатость стекла и следы пыли.
Из неорганических веществ перекись водорода разлагают окислы (MnO2, Fe2O3, Cr2O3), щелочные гидраты окислов NaOH, КОН, Ва(ОН)2 в присутствии примесей, гидратированные соли ионов Cu2+, Со3+, Pb2+, Mn2+ и др., ионы трехвалентных металлов Fe3+, Al3+, металлы в сильно измельченном, особенно в коллоидальном, состоянии (Au, Ag, Pt), соединения кремния, в том числе и входящие в состав стекла.
К органическим веществам, разлагающим перекись водорода, относится кровь, активизирующая разложение благодаря содержащемуся в ней ферменту каталазе, тогда как другой ее фермент, пероксидаза, содействует отщеплению от перекиси кислорода в присутствии окисляющихся веществ.
Каталитическое разложение Н2O2 в присутствии щелочей, двуокиси марганца и коллоидного раствора серебра описано в разделе «Получение кислорода мокрыми способами».
Опыт. Разложение перекиси водорода под влиянием тепла. Колбу емкостью 200-250 мл наполняют почти полностью раствором перекиси водорода; закрывают пробкой с газоотводной трубкой, кончик которой опускают в кристаллизатор с водой (рис. 129). После удаления из прибора воздуха нагревают колбу и собирают в наполненный водой цилиндр выделяющийся кислород.
Ток кислорода регулируют усилением или ослаблением нагревания колбы.
Присутствие кислорода открывают с помощью тлеющей лучинки.
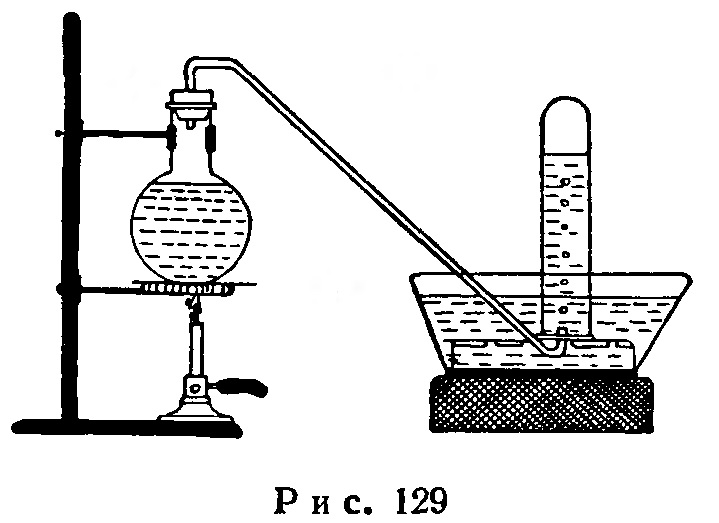 |
Опыт. Каталитическое разложение перекиси водорода. В три рюмки наливают примерно одинаковое количество пергидроля (30%-ного раствора перекиси водорода). В первую рюмку добавляют двуокиси марганца, во вторую — платиновой черни, а в третью — несколько капель крови.
Лучше всего идет разложение в третьей рюмке, куда была добавлена кровь. Если к крови добавить цианистого натрия, а затем пергидроля, кислород выделяется слабо.
 |
 Разложение H2O2 под действием KI (сверху) и каталазы крови (снизу). |
Экспериментально установлено, что коллоидная платина и каталаза отравляются одними и теми же веществами, например HCN, KCN, NaCN, СО, I2, Н2S, СS2 и др. Отравление катализаторов объясняется тем, что их большая поверхность адсорбирует значительное количество отравляющих веществ. В этом случае отравляющие вещества изолируют активную поверхность катализатора от реагирующего вещества и катализатор теряет способность ускорять реакцию.
Опыт. Каталитическое разложение перекиси водорода в щелочной среде. Для получения светящейся в темноте воды готовят четыре раствора:
- 1) растворяют 1 г порошка пирогаллола С6Н3(ОН)3 в
10 мл дистиллированной воды;
- 2) растворяют 5 г К2СO3 в таком же количестве дистиллированной воды;
- 3) берут 10 мл 35-40%-ного раствора формальдегида CH2O;
- 4) берут 15 мл 30%-ного раствора перекиси водорода (пергидроля).
 |
Когда глаза приспособятся к темноте, вливают в стакан пергидроль при непрерывном помешивании. Жидкость начинает как бы кипеть, пенится и светится желто-оранжевым светом, переливаясь блестящей пеной.
Выделение света при химических реакциях, протекающих без заметного выделения тепла, называется хемилюминесценцией. Выделяющийся при хемилюминесценции свет чаще всего бывает красного или желтого цвета. В настоящем опыте хемилюминесценция объясняется окислением пирогаллола перекисью водорода в щелочной среде. Выделяемая при окислении энергия почти целиком преобразуется в световую, хотя небольшое ее количество выделяется и в виде тепловой энергии, которая нагревает содержимое стакана и вызывает частичное испарение формальдегида (распространяется резкий запах).
Вместо пирогаллола можно пользоваться гидрохиноном, резорцином или фотографическими проявителями.
Перекись водорода можно сделать более устойчивой, если добавить к ней небольшое количество одного из следующих веществ (стабилизаторов): барбитуровой, мочевой, фосфорной, серной кислот, фосфата натрия, мочевины, фенацетина и др.
Перекись водорода — очень слабая кислота (слабее угольной). Кислотные свойства ее можно установить при помощи нейтрального раствора лакмуса.
Перекиси водорода соответствуют два вида солей: гидроперекиси (NaHO2, КНO2) и перекиси (Na2O2, К2O2, ВаO2).
В химических реакциях перекись водорода может выступать как в роли окислителя, так и в роли восстановителя.
Иногда очень незначительное изменение рН приводит к радикальному изменению окислительно-восстановительной функции перекиси водорода. В качестве примера можно привести следующие реакции:
Как окислитель перекись водорода распадается следующим образом:
(выделяющиеся атомы кислорода реагируют с восстановителем, переходя в отрицательно заряженный двухвалентный кислород).
ОКИСЛЕНИЕ ПЕРЕКИСЬЮ ВОДОРОДА В КИСЛОЙ СРЕДЕ
Опыт. Окисление перекисью водорода иона двухвалентного железа в ион трехвалентного железа. Уравнение реакции:
 FeSO4 |
 Fe2(SO4)3 |
В пробирку со свежеприготовленным зеленым раствором FeSO4 приливают разбавленной серной кислоты и 3%-ного раствора перекиси водорода. Благодаря окислению двухвалентного иона железа в трехвалентный цвет раствора изменяется и становится желтым. Присутствие трехвалентного иона железа можно установить с помощью иона роданида, так как роданид трехвалентного железа интенсивно окрашен в кроваво-красный цвет (реакция очень чувствительна).
Опыт. Окисление перекисью водорода сернистой кислоты (сульфитов) в серную кислоту (сульфаты). Реакция протекает по уравнению:
Если к водному раствору сернистого газа (сернистой кислоты) добавить перекиси водорода, то сернистая кислота окисляется в серную.
Для того чтобы убедиться в образовании серной кислоты, можно воспользоваться тем, что ВаSО3 растворяется в минеральных кислотах, в то время как ВаSO4 в них мало растворим.
Опыт. Окисление перекисью водорода железистосинеродистого калия. Уравнение реакции:
Если в пробирку с желтым раствором железистосинеродистого калия добавить немного разбавленной Н2SO4 и 3%-ного раствора Н2O2, то раствор в пробирке окрашивается в буро-красный цвет, характерный для железосинеродистого калия.
Опыт. Окисление перекисью водорода сернистого свинца. Реакция протекает по уравнению:
К раствору Рb(NО3)2 [или Рb(СН3СОО)2] добавляют водного раствора сероводорода; выпадает черный осадок сернистого свинца. Реакция идет по уравнению:
К тщательно промытому декантацией осадку сернистого свинца добавляют 3%-ного раствора перекиси водорода; окисляясь в сульфат свинца, осадок становится белым.
На этой реакции основано обновление почерневших от времени картин (из-за образования на них сернистого свинца).
Опыт. Окисление перекисью водорода индиго. При кипячении в пробирке 5-6 мл разбавленного раствора индиго и 10-12 мл 3%-ного или более крепкого раствора перекиси водорода наблюдается обесцвечивание раствора индиго.
ОКИСЛЕНИЕ ПЕРЕКИСЬЮ ВОДОРОДА В ЩЕЛОЧНОЙ СРЕДЕ
К зеленому раствору хромита щелочного металла приливают перекиси водорода; происходит окисление хромита в хромат, и раствор становится желтым.
Хромит щелочного металла получают действием щелочи (в избытке) на раствор соединения трехвалентного хрома (см. окисление бромной водой в щелочной среде).
Опыт. Окисление перекисью водорода солей двухвалентного марганца. Уравнение реакции:
К бесцветному (или слабо розовому) раствору какого-либо соединения двухвалентного марганца приливают щелочь. Выпадает белый осадок гидрата закиси марганца, который даже в присутствии следов кислорода окисляется в гидрат двуокиси марганца, и осадок становится бурым.
Гидрат закиси в присутствии гидрата двуокиси марганца образует окись марганца.
Описанные выше реакции протекают следующим образом:
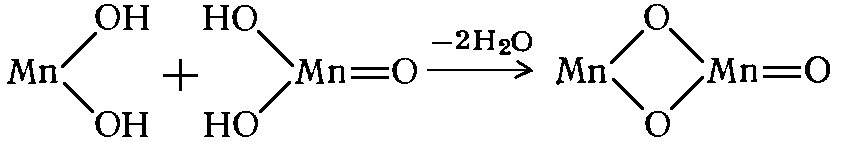
В присутствии перекиси водорода окисление гидрата закиси в гидрат двуокиси марганца протекает очень быстро.
При нагревании окисление солей двухвалентного марганца перекисью водорода идет до образования двуокиси марганца по уравнению:
В целом ряде реакций перекись водорода служит восстановителем как в щелочной, так и в кислой среде.
Как восстановитель перекись водорода разлагается следующим образом:
Так как перекиси могут быть как окислителями, так и восстановителями, электроны перекисей могут переходить от одной молекулы к другой:
Восстановление перекисью водорода КМnO4 и МnO2 в кислой среде и К3[Fe(СN)6] в щелочной среде описано в разделе получения кислорода мокрым способом.
 Реакция КМnO4 и Н2O2 в нейтральной среде |
Опыт. Восстановление перекисью водорода темно-бурой окиси серебра до металлического серебра. Реакция протекает по уравнению:
Наливают в пробирку 2 мл разбавленного раствора АgNO3, 4-6 мл 3%-ного раствора Н2O2 и 2-3 мл разбавленного раствора NaОН. Образуется черный осадок металлического серебра по суммарному уравнению реакции:
При действии щелочей на растворы солей серебра вместо неустойчивого гидрата окиси серебра выпадает темно-коричневый осадок окиси серебра (это свойство характерно и для гидратов окисей других благородных металлов).
В избытке щелочей окись серебра нерастворима.
Опыт. Восстановление перекисью водорода соединений золота. Восстановление может протекать как в кислой, так и в щелочной среде.
В пробирку с небольшим количеством раствора хлорного золота добавляют немного раствора щелочи и 3%-ного раствора перекиси водорода. Происходит мгновенное восстановление иона трехвалентного золота до свободного золота:
Опыт. Восстановление перекисью водорода гипохлоритов и гипобромитов. Уравнения реакций:
Эти реакции лежат в основе пробирочных опытов получения кислорода.
Продукты присоединения перекиси водорода. Таким веществом является пергидроль — продукт присоединения перекиси водорода к мочевине [K1]:

Это соединение в кристаллическом состоянии стабилизируется следами лимонной кислоты. При простом растворении в воде образуется перекись водорода.
Хранение перекиси водорода. Перекись водорода хранят в темном и холодном месте в парафиновых (или стеклянных парафинированных внутри) сосудах, закупоренных парафиновой пробкой.
ПРИМЕНЕНИЕ ПЕРЕКИСИ ВОДОРОДА
По сравнению с хлором перекись водорода как отбеливающее средство обладает большими преимуществами. Она применяется для производства перборатов (например, пербората натрия, являющегося активно действующим веществом в отбеливающих препаратах).
Сильно концентрированные растворы перекиси водорода (85-90%) в смеси с некоторыми горючими веществами применяются для получения взрывчатых смесей.
ВОДА Н2O
РАСПРОСТРАНЕНИЕ
Самой чистой природной водой является вода атмосферных осадков, самой загрязненной примесями является вода морей и океанов. По своей природе примеси могут быть неорганическими и органическими. В воде они могут находиться в растворенном и во взвешенном состоянии.
Примесями воды, являются: свободный углекислый газ, азот, кислород, СаСО3, Ca(HCO3)2, MgCO3, CaSO4, MgSO4, хлориды щелочных металлов, кремневая кислота и ее соли щелочных и щелочноземельных металлов, окислы железа, алюминия, марганца, соли щелочных и щелочноземельных металлов азотной, азотистой и фосфорной кислот, микроорганизмы и различные органические вещества в коллоидном состоянии.
 Накипь на спирали нагревателя – результат использования жесткой воды |
Минеральные воды, кроме этих примесей, содержат сероводород, сульфаты, соли борной, мышьяковой, фтористоводородной, бромистоводородной, иодистоводородной и других кислот.
Вода, содержащая бикарбонаты и сернокислые соли щелочноземельных металлов, называется жесткой.
Опыт. При помощи иона Ва2+ устанавливают в любой природной воде присутствие ионов SO42-, при помощи иона Ag+ — присутствие иона Cl-, а выпариванием в чашке 500 мл воды — наличие сухого остатка.
ПОЛУЧЕНИЕ
Воду можно получить при нагревании веществ, содержащих кристаллизационную воду, например: СuSO4•5Н2O, Nа2СO3•10Н2О, Nа2В4О7•10Н2О, Na2SО4•10Н2О, FеSO4•7Н2O; в качестве побочного продукта она образуется при реакциях нейтрализации, окислительно-восстановительных и других реакциях.
Для получения больших количеств химически чистой воды не пользуются ни одним из описанных выше способов ее получения, а прибегают к очистке различными способами очень распространенной природной воды.
ОЧИСТКА ПРИРОДНОЙ ВОДЫ
Для удержания примесей, сообщающих воде жесткость, воду пропускают через пермутитовые фильтры, а для освобождения от красящих веществ — через активированный уголь.
Удаление растворенных в воде примесей достигается в процессе дистилляции. На рис. 130 изображен простейший прибор для дистилляции, состоящий из колбы Вюрца, холодильника и приемника.
Чтобы не разбирать каждый раз прибор и избежать соединений при помощи пробок, рекомендуется пользоваться прибором, изготовляемым из иенского стекла (рис. 131).
Равномерное кипение при дистилляции достигается благодаря тому, что в колбу предварительно помещают немного пористого фарфора.
 |
Полученная таким способом вода содержит в растворенном состоянии газы, например СО2, и очень небольшое количество силикатов (образующихся в результате растворения стекла холодильника конденсатом воды).
Для удаления газов (например, СО2) наливают 750 мл дистиллированной воды в колбу емкостью 1000 мл, бросают в нее несколько кусочков капиллярных трубок и кипятят в течение 30-40 минут. По окончании кипячения закрывают колбу пробкой, в которую вставляют трубку с натронной известью (смесью СаО и NaОН). Натронная известь поглощает углекислый газ из воздуха, который может попасть в дистиллированную воду после ее охлаждения.
Поскольку в химической лаборатории на приготовление растворов и промывку осадков расходуется большое количество дистиллированной воды, ниже описываются несколько аппаратов непрерывной дистилляции.
 Дистиллятор |
 Дистиллятор |
Перегонный аппарат Калещинского (рис. 132) состоит из реторты с боковым тубусом и изогнутой шейкой, соединенной со спиральным холодильником.
Постоянный уровень воды в реторте и холодильнике поддерживается при помощи сифона.
Перед началом опыта через боковую трубку, на которую должна быть надета резиновая трубка, засасывают в сифон воду и закрывают резиновую трубку зажимом или плотно вставляют в нее стеклянную палочку.
Чтобы обеспечить равномерное кипение, перед началом перегонки в реторту кладут несколько кусочков пористого фарфора, а к концу боковой трубки сифона присоединяют колбу, в которую будут собираться пузырьки воздуха, попавшие в сифон при нагревании воды (пузырьки воздуха в сифоне могут нарушить нормальное питание реторты водой).
Этот небольшой аппарат может действовать непрерывно довольно длительное время, не требуя специального ухода.
Перегонный аппарат Верховского (рис. 133). Описание прибора: широкая трубка А служит для собирания пузырьков воздуха, выделяющихся из воды при ее нагревании. Она при наполнении сифона В, С, D почти полностью наполняется водой. Склянка F с отрезанным дном закрыта пробкой с пропущенной через нее трубкой Е (для удаления из склянки излишней воды). Все части аппарата соединяются между собой при помощи резиновых пробок и трубок. Вода из водопроводного крана попадает в холодильник, оттуда — в склянку F, затем — в сифон В, С, D к перегонную колбу. Одинаковый уровень воды в колбе и склянке поддерживается при помощи сифона В, С, D. Нормальное функционирование этого, как и предыдущего, аппарата обеспечивается непрерывным поступлением воды из водопроводного крана.
Кроме описанных, существует еще целый ряд других, более сложных аппаратов. Предпочтение отдается аппаратам, сделанным из иенского стекла, в которых отдельные части соединены не пробками, а шлифами. Можно пользоваться также металлическими аппаратами, нагреваемыми электричеством или газом.
Дистиллированная вода может быть однократной, двойной и многократной дистилляции.
 |
СВОЙСТВА ВОДЫ
Опыт. Различие между паром и туманом. В колбу емкостью 100 мл наливают небольшое количество воды; в шейку колбы вставляют стеклянную трубку длиной 5 см и диаметром 6 мм со слегка оттянутым внешним концом. Установив колбу на треножник, покрытый асбестовой сеткой, нагревают ее до интенсивного кипения воды. Образующиеся пары воды незаметны как в колбе, так и у отверстия трубки, но над колбой образуются клубы тумана (капелек конденсированного пара). Для равномерного кипения воды внутрь колбы помещают несколько кусочков пористого фарфора или стеклянных бусинок.
Конец трубки сильно оттягивать не надо, так как при этом может создаться высокое давление и тогда колба лопнет.
Чистая вода во всех агрегатных состояниях бесцветна. Водяные пары невидимы.
Опыт. Пары, видимые и невидимые. На столе устанавливают четыре большие склянки. В первую наливают немного воды, во вторую — брома, в третью — спирта и в четвертую — бензина.
Через некоторое время воздух в каждой склянке насыщается парами соответствующей жидкости. В склянке с бромом пары видимы, в склянках с водой, спиртом и бензином они невидимы; в склянках со спиртом и бензином их можно обнаружить по запаху.
. Плотность чистой воды при +4°С и давлении 760 мм рт. ст. принимают за единицу.
Опыт. Подтверждение того, что плотность теплой воды меньше, чем воды при +4°С. Для опыта пользуются стеклянной трубкой, согнутой в виде квадрата, с длиной каждой стороны около 25 см (рис. 134). Оба конца трубки соединяют при помощи двух кусочков резиновой трубки со стеклянной Т-образной трубкой. Весь прибор наполняют холодной водой, из которой предварительно кипячением должен быть удален воздух, и закрепляют в штативе в указанном на рисунке положении. В Т-образную трубку добавляют несколько капель чернил, раствора КМnO4, метиленовой сини или флуоресцеина и наблюдают, как диффундирует краситель в обе стороны. Затем нагревают прибор у одного из углов и замечают, как нагретая вода, став более легкой, начинает подниматься вверх и вся жидкость в трубке начинает перемещаться в направлении, обозначенном на рисунке стрелками. Краситель из Т-образной трубки начинает перемещаться в сторону, противоположную нагреванию. Если теперь перенести газовую горелку к левому углу, окрашенная вода начинает перемещаться слева направо. Этот прибор служит моделью центрального отопления.
Плотность льда меньше, чем воды при +4°С, поэтому он плавает на жидкой воде.
Опыт. Проверка слабой теплопроводности воды. Взяв пробирку за нижний конец, нагревают в ней воду. Вода у отверстия пробирки начинает кипеть, оставаясь холодной в нижнем ее конце, за который держат пробирку рукой.
 Демонстрация низкой теплопроводности воды |
Электропроводность чистой воды очень низкая, т.е. чистая вода — плохой проводник электричества.
Опыт. Для изучения электропроводности чистой воды и растворов различных электролитов и неэлектролитов пользуются специальным прибором.
Основными частями прибора для определения электропроводности жидкостей являются: два электрода, ламповый цоколь с электрической лампой, штепсельная розетка, штепсельная вилка, прерыватель, источник электрического тока и электропровод.
 |
Электроды могут быть платиновыми, угольными или медными; лампы могут быть разной мощности, но предпочитают пользоваться лампами, применяемыми для карманных фонарей; источником тока могут быть 1-2 аккумулятора или выпрямители, а также трансформаторы, соединенные с электрической сетью и дающие напряжение 3-4 В.
Электроды включают при помощи штепсельной вилки. Вместо цоколя с электрической лампой можно использовать электрический звонок. Обычно прибор (цоколь с электрической лампой, штепсельную розетку и прерыватель) монтируют на одной доске по схеме, показанной на рис. 135.
Платиновые электроды (рис. 135). Берут электрический медный шнур длиной 1 м и очищают один конец от изоляции (на 2 см). К очищенным концам провода припаивают платиновые проволочки длиной 1,5-2 см и диаметром 0,5 мм.
Припайку платиновых проволочек к медным производят с помощью буры Na2В4O7 и расплавленного серебра (пластинки). Оба медных провода с платиновыми кончиками вводят (каждый отдельно) в стеклянные трубки длиной 20 см. Стеклянные трубки подбирают такого диаметра, чтобы провод с изоляцией заполнил трубку. Платиновые проволочки на 1 см выводят из стеклянных трубок и загибают в противоположные стороны. Кончики трубок закрывают тонко измельченным асбестом и запаивают.
На расстоянии 8 см снизу обе стеклянные трубки плотно соединяют одной резиновой трубкой и вставляют в стеклянную трубку длиной 20 см и диаметром 12 мм с таким расчетом, чтобы пара стеклянных трубок с проводами на 12 см выходила из широкой трубки.
На нижний конец широкой трубки надевают резиновое кольцо, а верхний конец закрывают резиновой пробкой, через которую пропускают электрический шнур, согнув его в верхнем конце широкой трубки перед тем, как пропустить его через пробку, чтобы при натяжении не сорвать платиновую проволочку. На внешнем конце шнура прикрепляют штепсельную вилку. Чтобы защитить платиновые электроды от порчи, после опыта на них надевают предохранительную трубку или пробирку.
Угольные электроды. В качестве электродов служат угольные стержни длиной 10-12 см и диаметром 0,6-0,8 см с металлическим колпачком в верхнем конце для соединения с источником электрического тока.
Электроды укрепляют в пробковом кружке (или резиновой пробке), в который вставляют также небольшую капельную или простую воронку (рис. 136).
На нижнем конце электродов делают метку, до которой необходимо наливать в сосуд жидкость при погружении в нее электродов.
Медные электроды. Две медные проволоки длиной 10-12 см и диаметром 0,5-0,8 см.
Оба электрода, как и предыдущие, укрепляют в пробковый кружок, в который вставляют также и капельную воронку.
Для определения электропроводности жидкость можно налить в пробирку, стакан, цилиндр, склянку или банку в зависимости от размеров применяемых электродов.
Для проведения опыта электроды погружают в жидкость и включают в электрическую цепь, соединенную последовательно с электрической лампой (звонком) и через выключатель с источником электрической энергии.
Если при включении тока лампочка загорается (или звонит звонок), значит жидкость является хорошим проводником электричества.
Всякий раз перед испытанием электропроводности новой жидкости электроды, сосуд, в который наливают испытываемую жидкость, и воронку тщательно промывают дистиллированной водой, спиртом, эфиром, хлороформом, толуолом или иным растворителем и протирают фильтровальной бумагой.
Обычно в лаборатории проверяют электропроводность следующих жидкостей: дистиллированной воды, разбавленных растворов HCl, H2SO4, NaOH, Ва(ОН)2, NаСl и сахара.
 |
Чтобы показать, что электропроводность связана с присутствием ионов, достаточно продемонстрировать следующее:
- раствор Ва(ОН)2 + фенолфталеин проводит электрический ток;
- раствор H2SO4 проводит электрический ток.
При атмосферном давлении (760 мм рт. ст.) вода кипит при 100°. Если изменяется давление, изменяется и температура кипения воды.
Опыт. Кипение воды при пониженном давлении. Прибор собирают в соответствии с рис. 137. Он состоит из холодильника Либиха с внутренней трубкой из толстого и прочного стекла, заканчивающейся внизу небольшой колбочкой. В противоположном от колбочки конце трубки должен быть крючок для подвешивания термометра.
В колбочку холодильника наливают немного воды, подвешивают термометр таким образом, чтобы его шарик с ртутью находился в воде колбочки, и укрепляют холодильник в вертикальном положении на штативе.
Внутреннюю трубку холодильника через предохранительный сосуд и манометр соединяют с водоструйным насосом.
В начале опыта пропускают через холодильник воду и слегка нагревают колбочку, внимательно наблюдая за температурой и давлением, при которых начнет кипеть вода. Очень сильного вакуума в этом опыте допускать не следует во избежание растрескивания трубок.
Упрощенный вариант опыта: нагреваем воду в колбе до кипения, снимаем колбу с плитки и герметично закрываем ее пробкой – кипение прекращается, помещаем колбу под струю холодной воды – возобновляется бурное кипение. |
Опыт. Кипение воды при давлении выше атмосферного. Прибор собирают в соответствии с рис. 138.
Колбу для прибора берут широкогорлую, круглодонную, из толстого и высококачественного стекла емкостью 500 мл.
В колбу наливают 250 мл предварительно прокипяченной воды. Колбу закрепляют в штативе и закрывают резиновой пробкой, через которую пропускают две стеклянные трубки. Одна трубка, диаметром 6-7 мм, заканчивается пузырьком такого размера, чтобы он прошел через горло колбы. Вторая трубка, диаметром 6 мм начинается у нижнего обреза пробки; снаружи она согнута под углом 90° и при помощи толстостенной резиновой трубки соединена с другой, согнутой под прямым углом стеклянной трубкой, опущенной почти до дна в цилиндр со ртутью высотой 90-100 см и диаметром 1,5-2 см.
В пузырек помещают несколько кусочков пористого фарфора и наполняют до половины водой.
При указанном количестве ртути воздух в колбе находится под давлением более двух атмосфер.
Чтобы трубку, опущенную в цилиндр со ртутью, не выбросило, ее закрепляют в зажиме штатива.
После сборки прибора нагревают колбу с водой. В начале закипает вода в пузырьке, находящаяся под атмосферным давлением, и гораздо позднее закипает вода в колбе, находящаяся под давлением более двух атмосфер.
Для опыта пользуются круглодонными колбами, так как они более устойчивы к повышенному давлению.
При проведении опыта работают осторожно, ведя наблюдение на некотором расстоянии, так как при давлении 2-3 атм колба может лопнуть.
Вода участвует в следующих химических реакциях: в реакциях, в которых она проявляет окислительные свойства, в реакциях гидролиза, гидратации, присоединения, замещения и в реакциях, в которых вода играет роль катализатора.
В опытах получения водорода рассматривалось окислительное действие воды на натрий, калий, кальций, магний, алюминий, железо и углерод.
В разделах, посвященных брому и иоду, описаны опыты получения бромистого и йодистого водорода путем гидролиза галогенидов фосфора.
При рассмотрении свойств хлора, брома и хлористого водорода говорилось о гидратации, которая протекает как реакция присоединения.
В опытах, иллюстрирующих соединение водорода с хлором или иода с цинком, показаны каталитические свойства воды.
Химические реакции, протекающие с участием воды, встречаются во многих из описанных опытов.