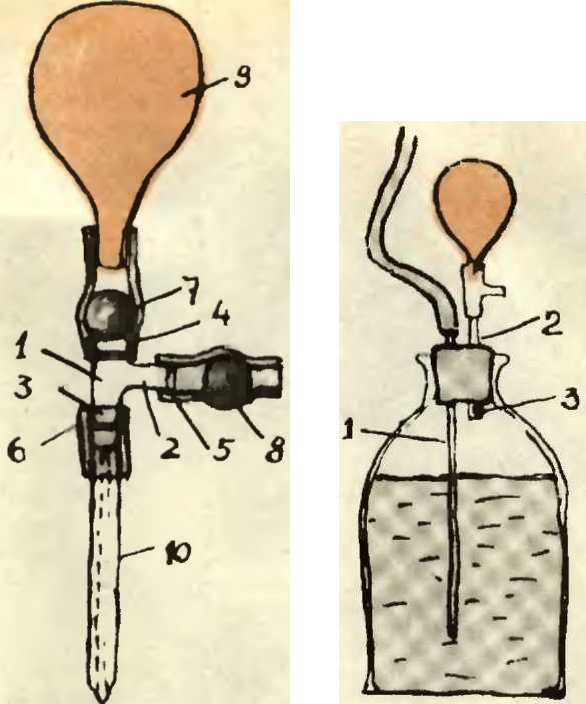
Можно ли набирать жидкость в пипетку, втягивая ее ртом? Обязательно ли пользоваться резиновой грушей?
Легко убедится, что втягивать жидкость в пипетку ртом значительно удобнее и быстрее, чем грушей, особенно если нужно много раз отмерить точный объем. Сейчас, правда, появились хорошие груши с 2 клапанами и специальные поршневые устройства для набора, но раньше, то их не было (да и ртом набирать все равно удобнее). Как известно, за всякое удобство приходится платить (а в данном случае - расплачиваться). Причем цена довольно значительно превышает полученные выгоды.
Во многих пособиях делаются оговорки, что ртом нельзя втягивать в пипетку ядовитые и летучие жидкости. Проблема состоит в том, что химик обычно именно с таковыми и работает. Кроме того, если вы привыкли втягивать в пипетку ртом дистиллированную воду, то потом появится большое искушение проделать ту же процедуру с растворами кислот, щелочей, солей тяжелых металлов или чего поопаснее...
Чем это грозит? Прежде всего - двумя вещами. Во-первых, существует большая вероятность попадания жидкости в полость рта. Особенно, при активной работе. Наиболее распространенная причина неприятностей - засасывание воздуха в пипетку во время набора. Случается это если пипетку (во время всасывания) поднять над поверхностью жидкости или если в результате набора упадет уровень жидкости в колбе. В пипетку попадает воздух, и содержимое пипетки выплескивается прямиком в рот. Кроме того, на обратный конец пипетки (который контактирует со слизистой рта) также может попасть набираемая жидкость. Например, когда вы положите пипетку с остатками жидкости на стол.
Во-вторых, довольно важно не вдыхать пары набираемой жидкости. Это очень распространенная ошибка. Ведь втягивать жидкость и не вдыхать ее пары довольно трудно. Особенно в случае больших пипеток.
Какие можно сделать выводы?
Приучите себя с самого начала набирать жидкости исключительно грушей. Даже если имеете дело с дистиллированной водой - иначе всасывать жидкости ртом войдет в привычку. И берегитесь паров кислот - для этого есть вытяжка.
К чему может привести несоблюдение этой рекомендации?
Сижу сейчас перед компьютером и в перерывах между набором статьи наблюдаю, как крошатся те зубы, которые еще остались. Первый зуб я потерял после того, как случайно набрал в рот сернокислотный раствор фосфата никеля с довольно высокой концентрацией H2SO4. Задумался, увлекся анализом. Хотел выполнить работу побыстрее. А в результате вышел из строя на два дня - пришлось "проведать" стоматолога. Кроме того, умудрился еще несколько раз набрать в рот растворы солей кобальта, цинка, меди. Втягивал ртом аммиак, конц. азотную и серную кислоты (правда, без последствий). Даже эти "подвиги" не идут ни в какое сравнение с тем, что делали коллеги. Приходилось видеть человека, который втягивал ртом хромовку, а в один прекрасный момент напился солей кадмия.
Но дело тут не только в наборе кислот пипетками. Абсолютное большинство людей, которые работают с летучими кислотами (HCl, HNO3 CH3COOH, HCOOH, аэрозоль H2SO4), имеют проблемы с зубами. Помните, что любые виды химических работ невозможны без хорошей вытяжки. Вернее возможны, но за счет вашего здоровья. А оно может оказаться не безграничным. Держитесь по дальше от людей, которые утверждают обратное.
Некоторые личности демонстративно нарушают ТБ, чтобы окружающие считали их не новичками, а опытными химиками. Но дело обстоит как раз наоборот - подобные действия вам совсем не добавят авторитета в глазах старших коллег. Период, отведенный человеку для сознательной творческой работы, весьма невелик - около 30-40 лет. И совсем не обязательно его сокращать, особенно, когда риск ничем не оправдан.
Как правильно отсчитывать уровень жидкости?
Во многих практикумах можно прочитать, что при отсчете объема жидкости глаз работающего должен быть на одном уровне с ее мениском (вогнутая поверхность раствора). Но как это достичь на практике? Хорошие пипетки, бюретки, а также любые мерные колбы имеют деления, которые нанесены вдоль всей окружности. В некоторых случаях вместо этого используют две шкалы: спереди и сзади. Так вот, если круговое деление, на котором лежит нижний край мениска, проецируется в линию, то глаз находится точно на уровне мениска (рис.1). Другими словами, нужно совместить ближний и дальний край одного и того же деления. В случае наличия двух шкал - их соответствующие деления тоже должны совмещаться. Если же глаз находится не на одном уровне с поверхностью жидкости, то мы видим одновременно ближний и дальний край одного и того же деления.
Как правило, объем жидкости отмечают по нижнему уровню мениска (рис.2), но если жидкость непрозрачна (раствор перманганата или йода) используют верхний уровень мениска.
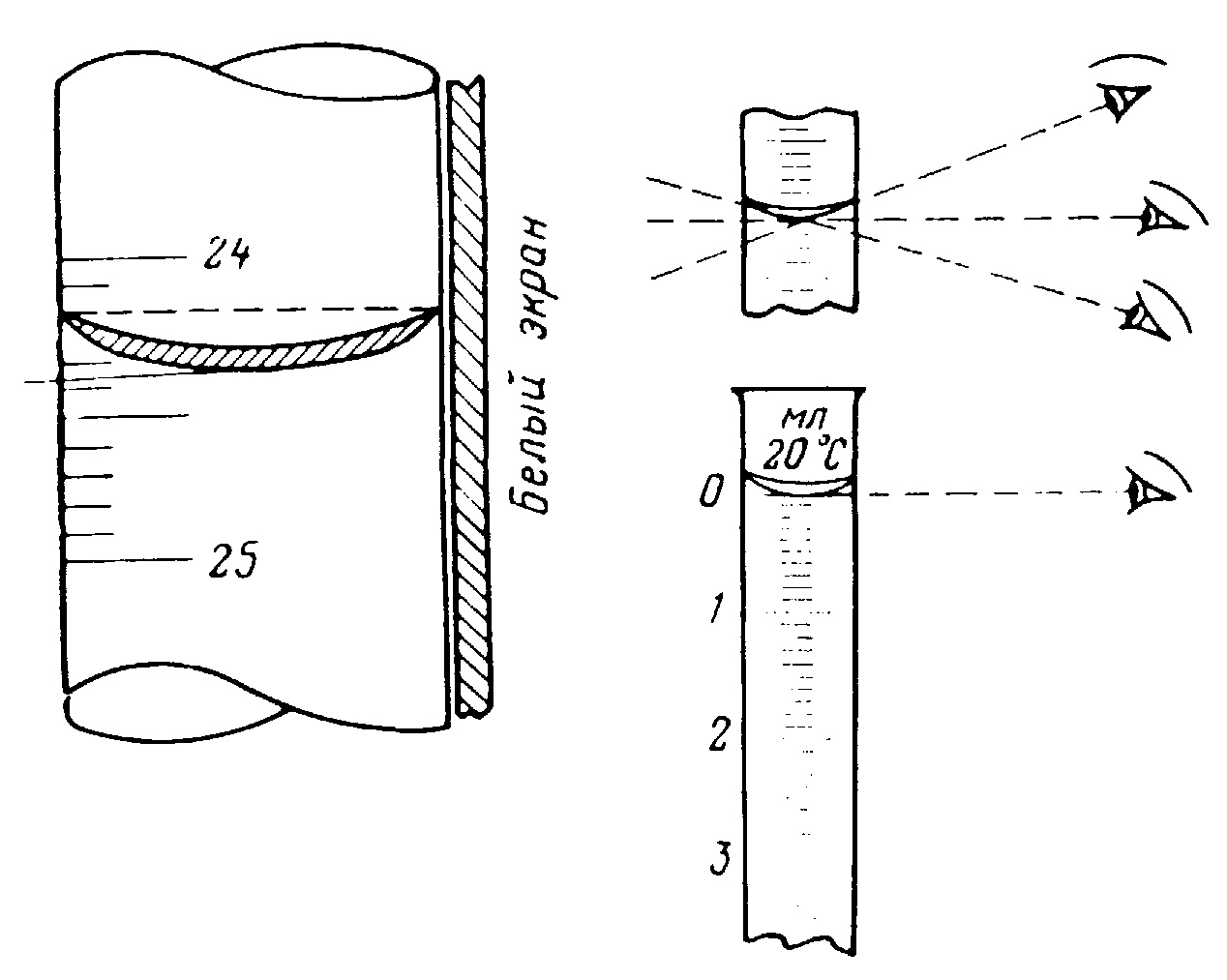 Рис. 1 |
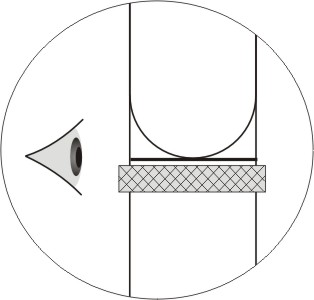 Рис. 2 |
 Рис. 3 |
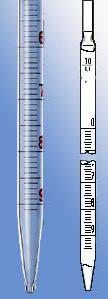 Рис. 4-1
Рис. 4-1
 Рис. 4-2
Рис. 4-2
|
Хотелось бы обратить внимание, что пипетки бывают разными. Пипетки Мора (рис. 3) имеют одно деление и рассчитаны на измерение только определенного объема, например, 5 мл. Не трудно догадаться, что ни 3 ни 4 мл отмерить такими пипетками не удастся. Соответственно среди химиков они не пользуются особым уважением.
Значительно более удобны градуированные пипетки. С их помощью можно отмерять разные объемы жидкостей, но и тут есть свои нюансы. Во всех хороших пипетках максимальная емкость соответствует полному опорожнению всей пипетки. Такие пипетки часто называют пипетками на полный слив. На рис. 4-1 показана пипетка на полный слив (объем - 10 мл). Однако, еще в советские времена были придуманы "шедевры" (рис. 4-2), в которых полная емкость пипетки соответствует ее нижнему делению (пипетки на неполный слив). Если дрогнет рука и жидкость опустится ниже последнего деления - это уже передозировка. Нетрудно догадаться, что работать такими пипетками не только неудобно, но и весьма накладно.
Обязательно ли пользоваться при титровании микробюреткой?
Для достижения хорошей точности титрования микробюретки просто необходимы. Обыкновенные бюретки на 25-100 мл. служат в основном для технических анализов или учебных целей. Их точность (0.05-0.1 мл) для целого ряда работ является довольно грубой. Но как быть, если микробюретки под рукой нет, а необходимо провести титрование с точностью измерения объема 0.01-0.02 мл? Ответ довольно прост: химика выручит старая добрая пипетка. Ее с успехом можно использовать вместо микробюретки.
Техника титрования внешне проста. В правой руке вы держите колбу с титруемым раствором, в левой - пипетку из которой постепенно добавляете титрант. При этом не стоит забывать о перемешивании содержимого колбы и необходимости держать пипетку вертикально. На практике такой способ титрования требует навыков, но все приходит со временем.
В ряде случаев пипетку закрепляют в штатив, соединяют ее с пустым шприцом (резиновая трубка, шприц тоже закреплен), а поршень шприца плавно двигают с помощью винтового механизма.
Неприятным обстоятельством является то, что обычно объем капли составляет около 0.04 мл. Уменьшить его можно двумя способами. 1) Сделать носик бюретки (пипетки) гидрофобным, окунув его в расплавленный парафин и выдув избыток жидкости. 2) В конце титрования (вблизи точки эквивалентности) не капайте титрант напрямую в раствор, а прикасайтесь каплей, которая свисает с отверстия пипетки к колбе. При этом капля прилипнет к поверхности колбы, не успев сформироваться. Далее ее смывают в титруемый раствор (с помощью промывалки).
Как довести объем воды в мерной колбе "до метки"?
Эффективность данной процедуры в значительной мере зависит от сноровки. С самого начала полезно потренироваться, используя обыкновенную воду. Если у вас слишком часто возникают "переливы", добавляйте последние порции воды с помощью пипетки или капельницы. Если же вы добавили лишнюю воду (выше метки) в колбу с важным образцом, то существует несколько способов. Мерную колбу можно поставить в термостат, чтобы жидкость упарилась ниже метки, охладить ее до комнатной температуры (не менее 10-ти часов) и со второй попытки довести раствор до метки. В некоторых случаях лишнюю воду быстро отбирают с помощью пипетки. Но при работе с окрашенными растворами четко видно, что при этом теряется и анализируемое вещество. Допустимо такое или нет - зависит от требований к точности анализа.