ВВЕДЕНИЕ
1. Если ты нагреваешь пробирку в пламени, то она должна быть снаружи абсолютно сухой, иначе при соприкосновении с огнем она может лопнуть. Держи пробирку в руках с помощью пробиркодержателя, передвигая ее в пламени вверх и вниз так, чтобы жидкость могла нагреваться равномерно. Вместо пробиркодержателя вполне подойдет и деревянная прищепка.
Запомни! 1. Открытый конец пробирки отводи при нагревании от себя и других лиц.
2. При работе с соляной кислотой и раствором едкого натра соблюдай осторожность, следи за тем, чтобы они не попадали на руки и одежду. Если случайно прольешь соляную кислоту на руки, смой ее немедленно водой и протри руки слабым раствором соды. Если на руки попадает раствор едкого натра, сразу смой его водой и протри это место слабым раствором уксуса.
3. Если хочешь проверить запах газа, жидкости или реактива, никогда не подноси сосуд прямо к лицу, а, удерживая его на некотором расстоянии, направь, помахивая рукой, воздух над сосудом по направлению к себе и одновременно нюхай воздух. Так ты безопасно для себя определишь запах интересующих тебя веществ.
4. Всегда используй реактивы в небольшом количестве. Избегай оставлять реактивы в посуде без соответствующей надписи (этикетки) на склянке, из которой должно быть ясно, что находится в склянке.
5. Если хочешь сделать фильтр, сложи круглый лист фильтровальной бумаги, как показано ниже (Опыт 12).
6. Если ты хочешь вставить стеклянную трубку в резиновую пробку, предварительно смочи трубку в воде, и тогда она без труда войдет в пробку.
7. Если ты хочешь набрать жидкость с помощью трубочки (пипетки), опусти ее во флакон, подожди, пока она заполнится жидкостью, затем зажми ее верхнее отверстие указательным пальцем и подними пипетку; убери палец с отверстия, чтобы вылить набранную жидкость.
8. Если ты хочешь, чтобы у тебя получились все опыты, которые мы предлагаем, следи, чтобы лабораторная посуда была чистой, мой ее после каждого опыта, используй для этой цели ерш.
9. Если ты используешь в своей работе спиртовку, не ставь ее непосредственно на стол, а обязательно подложи под спиртовку несгораемый материал (лист жести, кафельную плитку и т.п.).
 |
 |
 |
О САХАРЕ И СОЛИ
1. ЖАРИМ САХАР
 Да, сахар можно жарить, хотя тебе для этого не понадобится ни сковорода, ни сливочное масло.
Да, сахар можно жарить, хотя тебе для этого не понадобится ни сковорода, ни сливочное масло.Несколько кусочков сахара поместим в фарфоровую чашку и смочим аккуратно при помощи пипетки водой так, чтобы они пропитались ею. Фарфоровую чашку поставим на огонь.
Сахар постепенно начнет растворяться и скоро в чашке образуется вязкая желтоватая жидкость. Это и есть жареный сахар. Долго нагревать сахар нельзя: он станет коричневым и загорится.
2. ПОЛУЧАЕМ ЛЕДЕНЦЫ
Как только сахар превратился в светло-желтую жидкость, накапаем из чашки небольшое количество на тарелку или на лист бумаги и дадим жидкости остыть. Когда сахар затвердеет, приподнимем с помощью ножа светло-желтую прозрачную массу и попробуем ее на вкус - получился сладкий леденец. Теперь ты можешь научить своих товарищей делать дома такие леденцы.3. ГОРИТ ЛИ САХАР?
Попробуем это проверить. Возьмем пинцетом кусочек сахара и подержим его в пламени спиртовки.Сахар потемнеет, начнет плавиться и капать, как свечка, но гореть не будет. А теперь насыпем на этот кусочек сахара пепел от сигареты и опять поместим в пламя спиртовки. Сахар загорается ярким пламенем и сгорает до тла, как смоченное бензином дерево. Такое действие оказали соли химического элемента - лития, содержащиеся в табачной золе.
4. МОЖЕТ ЛИ САХАР СТАТЬ НЕВИДИМЫМ?
Разобьем кусок сахара и высыпем эти мелкие кусочки в пробирку, на 3/4 заполненную водой. Закроем пробирку пробкой и хорошенько встряхнем ее. Сахар постепенно растворится, и теперь только на вкус можно узнать о том, что в воде содержится сахар.
5. ИСЧЕЗНУВШАЯ ПОВАРЕННАЯ СОЛЬ
Если в другую пробирку насыпать соли и, залив ее водой, хорошенько встряхнуть, соль тоже растворится. И, только попробовав на вкус, можно узнать о присутствии соли в воде.6. ИСКУССТВЕННЫЙ "СНЕГ"
Положим в тарелку несколько камешков, между ними укрепим сухие веточки (рис.).
Каждый день пипеткой надо добавлять к смеси в тарелку 1-2 ложки воды, и уже на второй день появится "снег" на камешках, а через 15 дней он уже покроет ветки у стенки тарелки.
Сущность явления заключается в том, что сухая соль, впитывая воду, растворяется в ней. Полученный концентрированный раствор в силу капиллярности проникает в промежутки между камнями, в трещины коры, в сосуды веточек, образуя тонкую пленку. Вода испаряется, а соль остается.
Этот процесс протекает непрерывно, и поэтому "снег" растет в течение нескольких дней.
7. САХАР И СОЛЬ ПОЯВЛЯЮТЯ ВНОВЬ
Выльем сладкую воду из пробирки в фарфоровую чашку и поставим ее в теплое место. Через несколько дней вода испарится и на дне чашки останется сахарная корка, внутри которой блестят кристаллы сахара.Аналогичный опыт можно провести и с поваренной солью, если половину соленого раствора подогревать в чашке до полного растворения воды. На дне чашки останется корка сухой поваренной соли, которую можно соскоблить.
8. О "ГЕОМЕТРИИ" ПОВАРЕННОЙ СОЛИ
Поставим чашку с соленой водой на некоторое время в теплое место. Вода постепенно испарится, а поваренная соль выпадает на дне чашки в виде блестящих кубических кристаллов. |
 |
При кристаллизации поваренная соль всегда принимает форму кубиков. Другие вещества кристаллизуются в других геометрических формах.
9. ВЫРАЩИВАЕМ КРИСТАЛЛЫ САХАРА
Можно сделать так, что кристаллы будут не только образовываться в растворе, но и постепенно расти.Попробуем, например, вырастить кристаллы сахара. Для этого растворим как можно больше сахара в пробирке с теплой водой и выльем раствор в стакан. Затем привяжем короткие нитки к карандашу и положим его на стакан.
На нитках в жидкости со временем образуются кристаллы, которые будут постепенно становиться все больше и больше.
 |
 |
О ВОДЕ
Во многих из них вода принимает непосредственное участие с образованием новых веществ.
10. "ЧИСТАЯ" ВОДА
Водопроводная вода только на первый взгляд кажется прозрачной и чистой. Химики хорошо знают, что в такой воде всегда присутствуют минеральные соли. Нальем в чашку немного воды и будем нагревать ее на спиртовке до полного испарения. Вместо воды на дне чашки останется пятно серовато-белого осадка. Это и есть растворенные в воде минеральные соли. Воду, содержащую минеральные соли кальция и магния, химики называют "жесткой".Эта вода имеет свойство препятствовать образованию мыльной пены.
11. МЫ ПОЛУЧАЕМ ЧИСТУЮ ВОДУ
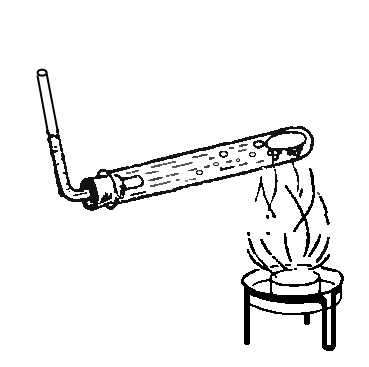
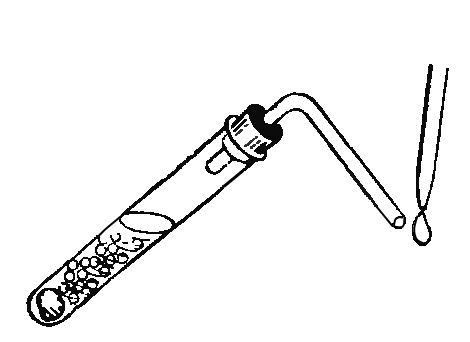
Попробуем очистить воду от минеральных солей. Нальем в реторту немного воды, закроем ее пробкой с вставленной в нее стеклянной изогнутой трубкой, опущенной в пробирку, охлаждаем ее в стакане с холодной водой (рис.). При кипении вода испаряется, а пары ее, по изогнутой трубке попадая в пробирку, охлаждаются и превращаются снова в воду. Этот процесс в химии называют перегонкой или дистилляцией, а вода, сконденсированная в пробирке, называется дистиллированной водой. Если попробовать эту воду на вкус, она покажется "пресной", так как не содержит минеральных солей. Следует обратить внимание на то, что в реторте должно остаться небольшое количество неперегнанной воды, иначе реторта может лопнуть.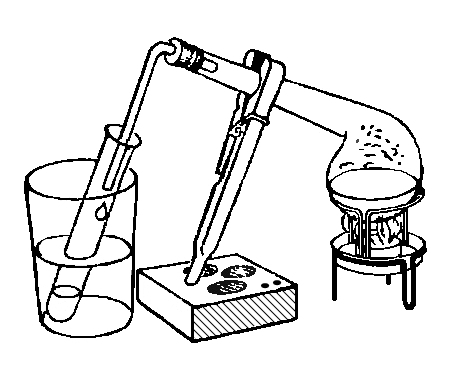
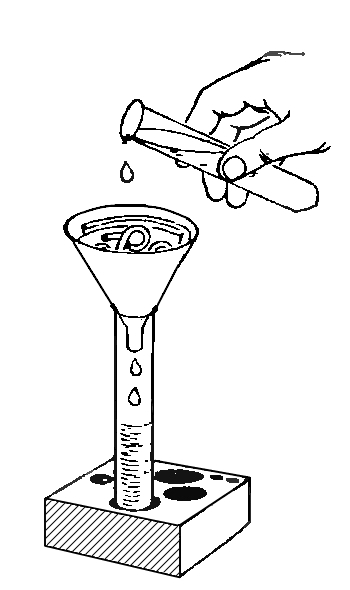
12. ФИЛЬТРУЕМ ЗАГРЯЗНЕННУЮ ВОДУ
Очистить воду можно и другим способом. Положим в стакан с водопроводной водой немного земли и хорошенько размешаем. Вода станет грязной и мутной. Теперь возьмем лист фильтровальной бумаги, сложим его так, как это показано на рисунке, и вложим в полиэтиленовую воронку. Фильтр готов.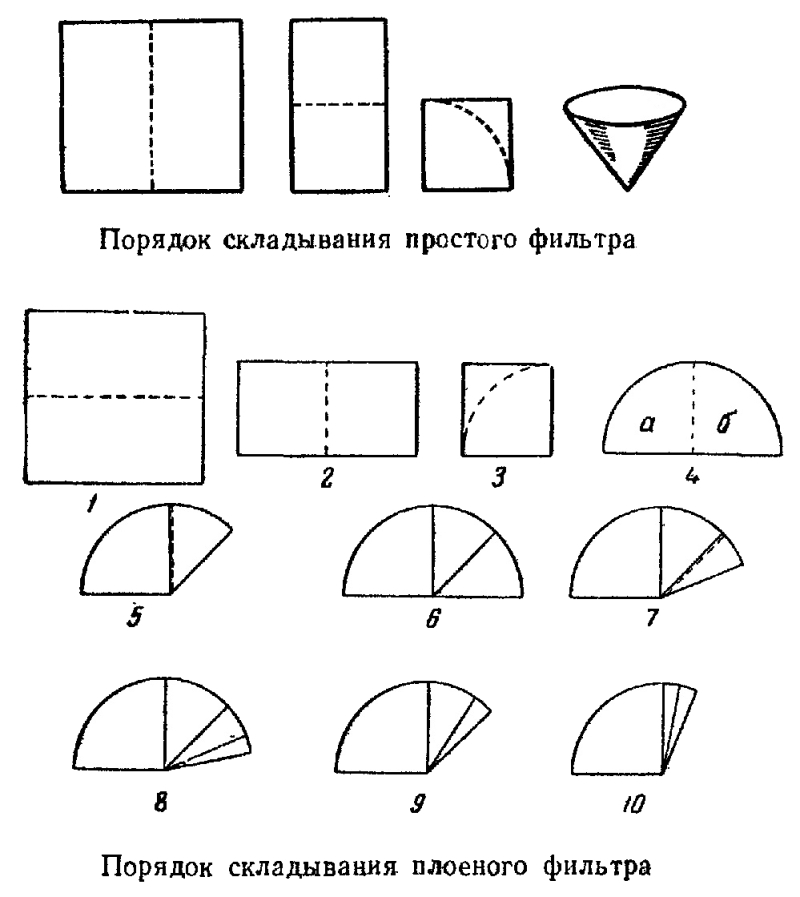
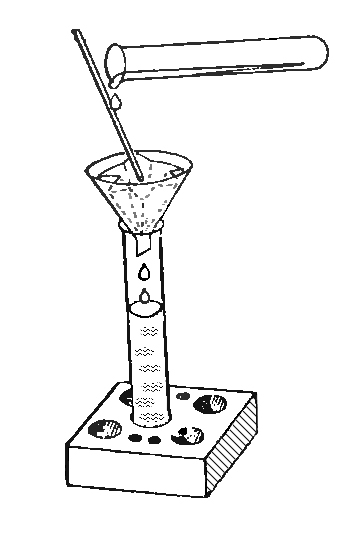
13. ФИЛЬТР ДЛЯ КОФЕ
Такую бумажную воронку, которую ты сделал для предыдущего опыта, можно использовать в качестве фильтра для свежеприготовленного кофе. Утром, когда мама сварит кофе, ты можешь отфильтровать его от кофейной гущи.14. МНОГО ЛИ ВОДЫ В ОВОЩАХ И ФРУКТАХ?
Да, много. Убедимся в этом на опыте. Если в доме есть весы, взвесьте 100 г листьев салата, щавеля или другого овоща. Затем поместите взвешенные листья в теплое сухое место и полностью высушите. После повторного взвешивания убедитесь, что вес листьев стал меньше на столько, сколько весила испарившаяся из них вода. В салате было столько процентов воды, сколько граммов он потерял в результате высушивания. Если после высушивания он стал весить 5 грамм, то воды в нем содержалось 95%. Если в доме нет весов, их можно изготовить самим из двух спичечных коробок, карандаша и крепких ниток.На карандаше делаются три засечки: одна в центре и две по краям. На центральной засечке закрепляется нитка в виде петли, а на боковых - с помощью ниток спичечные коробки. Получается нечто вроде аптекарских весов (рис.).
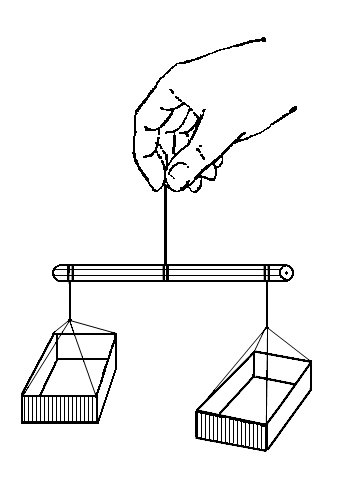
Для сравнения проделаем опыты с растертым картофелем, яблоком, огурцом и убедимся, что содержание воды в овощах и фруктах колеблется от 75 до 97%.
И, хотя в овощах и фруктах так много воды, тем не менее они вкусны и содержат в себе ценные, необходимые для нашего питания вещества.

15. ИСПЫТЫВАЕМ ВОДОПРОВОДНУЮ ВОДУ
Возьмем чашку с осадком, полученным при упаривании воды, и капнем на него из стеклянной пипетки каплю соляной кислоты. Произойдет реакция, сопровождающаяся выделением газа.В состав осадка входят карбонаты - соли угольной кислоты, которые реагируют с соляной кислотой, выделяя углекислый газ.
16. КАК УСТРАНИТЬ НАКИПЬ В ЧАЙНИКЕ?
В чайнике, в котором всегда кипятят воду, образуется толстая корка накипи, подобная тому, как на дне чашки оседает углекислый кальций из воды при выпаривании.Эту накипь нельзя удалить обыкновенной водой, а вот разбавленная соляная кислота быстро ее растворяет. Однако так можно очистить только эмалированный чайник, алюминиевую посуду кислота может разрушить.

17. КАК ОЧИСТИТЬ ПРОБИРКУ ПОСЛЕ ВЫПАРИВАНИЯ В НЕЙ ВОДЫ?
Аналогично мы можем устранить мутный налет на стенках пробирки, в которой выпаривали воду. Ополоснем ее небольшим количеством соляной кислоты, и мутный налет исчезнет. Если после этого дополнительно ополоснуть ее водой (лучше дистиллированной), мы можем считать пробирку чистой. Запомни это как практический совет для нашей работы.18. КАК ОЧИСТИТЬ ЖИРНУЮ ПРОБИРКУ?
Пробирку, в которой находились животные или растительные масла, нельзя очистить водой. А вот горячий содовый раствор хорошо очищает жирную посуду. Сода образует с жиром мыло, которое растворяется в воде.Пробирки, которые ты используешь для опытов, должны быть всегда чистыми. Теперь ты уже знаешь два способа очистки сильно загрязненных пробирок: содовым раствором, если в пробирке был жир, и соляной кислотой, если пробирка загрязнена известью.
19. ИЗВЕСТКОВАЯ ВОДА
Приготовим известковую воду. Для этого поместим в пробирку на 1/5 ее высоты гидроокиси кальция (гашеной извести, гидроксида кальция) и прильем воды такое количество, чтобы, закрыв пробирку пробкой, можно было хорошо перемешать содержимое пробирки энергичным встряхиванием. Поставим полученный в пробирке раствор на несколько часов отстаиваться. Когда все твердые частицы осядут на дно, прозрачную жидкость из пробирки сольем в банку. Это и будет известковая вода.20. ИЗВЕСТКОВАЯ ВОДА И МЫЛЬНАЯ ВОДА
Приготовим немного мыльной воды, растворив некоторое количество мыльной стружки в стакане с водой. Дадим сутки отстояться получившейся мутной жидкости и отфильтруем в пробирку. Отфильтровавшуюся слегка мутную жидкость постепенно добавляем в пробирку с прозрачной известковой водой. Раствор сразу мутнеет. Это образовалась нерастворимая в воде соль - стеарат кальция. Чем больше стеарата кальция в растворе, тем плотнее образовавшаяся муть.Затем в другую пробирку с известковой водой опустим стеклянную трубочку и будем выдыхать воздух через нее. Прозрачный раствор также помутнеет. Это происходит от того, что мы выдыхаем углекислый газ, который с известковой водой образует другую нерастворимую соль кальция - карбонат или углекислый кальций.
21. ДОЖДЕВАЯ ВОДА НЕ СОДЕРЖИТ СОЛЕЙ КАЛЬЦИЯ
Свободной от солей кальция может быть только вода, которая не соприкасалась с известковыми породами. Это дождевая вода.Если мы соберем немного дождевой воды в чистую банку и добавим к ней мыльный раствор, помутнения не произойдет.
22. РОДНИКОВАЯ ВОДА СОДЕРЖИТ СОЛИ КАЛЬЦИЯ
Родниковая вода в отличие от дождевой, соприкасаясь с земными породами, захватывает примеси, в том числе и соли кальция.Это можно установить испытанием с мыльным раствором.
23. ВОДА И МАСЛО
Вода и масло плохо смешиваются друг с другом. Если в воду налить растительного масла, оно разливается на поверхности воды тонкой радужной пленкой.24. МАСЛЯНАЯ КАПЛЯ
Нальем в пробирку примерно 1 см по высоте пробирки спирта. С помощью пипетки капнем в него 1 каплю растительного масла. Капля падает на дно пробирки. Добавляем в пробирку 1 см (по высоте пробирки) воды и встряхнем полученную смесь. Масляная капля повисает в смеси спирта с водой в виде желтого прозрачного шарика. Растительное масло, спирт и вода имеют различную плотность (удельный вес). Наименьшая - у спирта, наибольшая - у воды.У полученной смеси спирта с водой плотность стала равной плотности растительного масла, поэтому капля масла в ней повисает.
25. ВОДА ПОКРЫТА ПЛЕНКОЙ
Если наполнить стакан почти до краев водой и осторожно положить на поверхность воды кусочек фильтровальной бумаги с иголкой, то бумага, как только намокнет, утонет, а игла останется на поверхности. Можно даже наблюдать, как поверхность воды прогибается под иглой. Игла не тонет потому что поверхность воды покрыта пленкой, которая не прорывается, благодаря малому весу иглы.Эта водная пленка при стирке препятствует удалению грязи и жира. Ее разрушают добавлением моющих средств.
26. КАК РАЗРУШИТЬ ПОВЕРХНОСТНУЮ ПЛЕНКУ ВОДЫ
Если около иглы, плавающей на воде, насыпать из чайной ложечки стирального порошка, игла вскоре утонет.А если опыт с иглой и бумажкой провести в воде, к которой предварительно добавлен стиральный порошок - игла совсем не удержится на поверхности воды.
Это происходит от того, что поверхностная пленка воды разрушается при добавлении к воде моющих средств для стирки.
27. ВОЗДУХ В ВОДЕ
Человек, попав в воду без специального снаряжения, может погибнуть, задохнувшись от недостатка воздуха. А вот рыба не задыхается под водой, потому что вода содержит небольшое количество воздуха, достаточного для дыхания рыб.Попробуем сами обнаружить воздух в воде. Наполним пробирку до краев водой и закроем ее пробкой с изогнутой трубкой (рис.). В пробирке не должно быть пузырьков, и вода должна заполнить часть изогнутой трубки. Удерживая пробирку горизонтально и слегка наклонно (так, чтобы дно пробирки было чуть выше отверстия пробирки), нагреем воду в пробирке. Пузырьки воздуха начнут подниматься и собираться в верхней части пробирки в один большой пузырь. Нельзя воду нагревать до кипения, так как образующийся при этом пар может выбросить всю воду через трубку.
Пузырек воздуха, который образовался в пробирке после нагревания, содержит кислород, которым дышат рыбы и другие живущие в воде организмы.
28. ИЗ ЧЕГО СОСТОИТ ВОДА?
 |
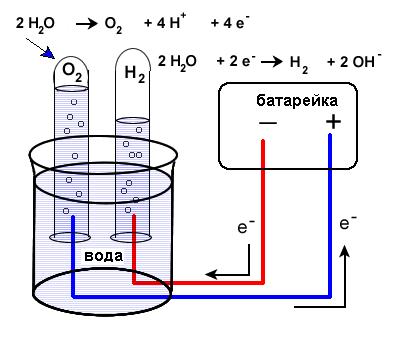 |
Обыкновенная прозрачная вода состоит из двух химических элементов: водорода и кислорода, которые связаны между собой химическими связями. Получить эти химические элементы из воды в виде простых веществ (газообразных: кислорода и водорода) можно с помощью электрического тока. Дистиллированная (и дождевая вода) электрического тока не проводит, так как в ней нет солей. Содержащиеся в водопроводной воде соли распадаются и существуют в ней в виде заряженных частиц: положительных (+) и отрицательных (-), поэтому она проводит электрический ток. Попытаемся разложить воду на газообразные кислород и водород при помощи электрического тока. Для этого нам потребуется: плоская батарейка, два изогнутых под острым углом металлических стержня или гвоздя (6 см), которые являются электродами, два проводника, изоляционная лента.
Для проведения опыта собери установку, изображенную на рисунке. Будем пользоваться водопроводной водой. Для лучшей проводимости электрического тока в нее следует добавить немного раствора гидроокиси натрия (едкого натра, гидроксида натрия), который также распадается в воде на заряженные частицы (+) и (-). (На стакан в 200 мл - 3-4 мл раствора едкого натра). Полученным раствором наполнить пластмассовую ванночку так, чтобы вертикальные части гвоздей (электродов) были покрыты раствором.
Этим же раствором заполнить две пробирки, закрыть их поочередно резиновой пробкой, опрокинуть в ванночку с раствором, под водой открыть пробку и надеть пробирки на вертикальные части электродов. Пробирки дополнительно укрепить в деревянном пробиркодержателе и штативе. Провода, идущие к батарее, накрутить на гвозди. Участок гвоздя от пробирки до присоединения гвоздя к проводу обмотать изоляционной лентой. Затем соединить проводники с батарейкой. Во избежание разряда батарейки от короткого замыкания, ее нужно подключать в последнюю очередь, убедившись, что электроды между собой не соприкасаются.
Наблюдать за собиранием газов в пробирках. В пробирке, надетой на электрод, соединенной с отрицательным полюсом батарейки, должно собираться газа в два раза больше, чем в другой пробирке.
Продолжать опыт до полного заполнения пробирок. Отключить батарейку. Поочередно закрыть пробирки резиновой пробкой под водой, поставить в штатив и испытать полученные газы.
К отверстию пробирки с отрицательного полюса поднести горящую лучинку, быстро открыв пробку. Легкий хлопок указывает на присутствие водорода. К отверстию второй пробирки, также быстро открыв пробку, поднести тлеющую лучинку. Вспыхивание указывает на присутствие кислорода.
(Кислород - газ, поддерживающий горение).
29. ТЕПЛО ПОВЫШАЕТ РАСТВОРИМОСТЬ
Положим в пробирку немного меди сернокислой (сульфата меди, медного купороса) из нашего набора так, чтобы высота слоя была около 1,5 см и добавим 2 см воды по высоте пробирки. Для того, чтобы купорос растворился скорее, пробирку встряхнем несколько раз, предварительно закрыв ее пробкой. Раствор окрасится в синий цвет, однако, еще не весь медный купорос растворился. Часть его останется на дне. Такой раствор можно назвать насыщенным. Теперь пробирку осторожно нагреем. Медный купорос растворится полностью, и цвет раствора станет темно-синий. Следовательно, тепло способствует растворению. Если горячему раствору дать остыть, то на дне пробирки осядут кристаллики медного купороса. Такой раствор стал пересыщенным.
30. КАК ВЫРАСТИТЬ КРИСТАЛЛИКИ ДЛЯ ПОСЛЕДУЮЩЕГО ВЫРАЩИВАНИЯ БОЛЬШИХ КРИСТАЛЛОВ МЕДИ СЕРНОКИСЛОЙ (МЕДНОГО КУПОРОСА)
Полученные в предыдущем опыте кристаллы химики называют монокристаллами.Монокристаллы различных веществ, например, кварца, широко применяются в оптике и электротехнике.
Можно устроить соревнование с товарищами по выращиванию самого большого кристалла медного купороса. Для этого приготовим раствор медного купороса: в 1/2 пробирки воды растворим при постоянном встряхивании медный купорос, имеющийся в наборе, до получения интенсивной окраски раствора. Полученный раствор перельем в стакан и оставим его до тех пор, пока вода не испарится. На дне стакана останутся кристаллики медного купороса. Они похожи на косоугольники (ромбоэдры).
Отберем несколько наиболее правильных по форме кристалликов, которые и будут зародышами для выращивания больших кристаллов.

31. ПРОЦЕСС ВЫРАЩИВАНИЯ БОЛЬШИХ КРИСТАЛЛОВ МЕДИ СЕРНОКИСЛОЙ (МЕДНОГО КУПОРОСА)
Прежде всего, необходимо приготовить раствор медного купороса, в котором кристаллики будут расти. Возьмем 3/4 пробирки воды и поместим туда немного медного купороса. Пробирку встряхиваем до тех пор, пока купорос не растворится. Затем добавляем постепенно еще купороса до тех пор, пока даже после встряхивания он не растворится. Теперь раствор нужно нагреть. Избыток медного купороса в теплой воде растворится. Оставим раствор до следующего дня, и купорос снова выпадает в осадок. Жидкость над осадком или, так называемый маточный раствор, сольем в стакан. Положим в маточный раствор 2-3 кристаллика, отобранные в предыдущем опыте, так, чтобы они не касались друг друга на дне стакана. Стакан закроем листом бумаги или картона, чтобы вода не испарялась слишком быстро, и каждый день кристаллики будем переворачивать. Помни, они всегда должны быть полностью покрыты раствором, поэтому время от времени необходимо изготавливать и доливать новый маточный раствор. Выращивание новых кристаллов проводится довольно долго, 5-ти сантиметровые кристаллы нужно выращивать полгода. Наберись терпения, и ты сможешь сам вырастить крупные кристаллы. |
 |
 |
32. ОПРЕДЕЛЕНИЕ КРИСТАЛЛИЗАЦИОННОЙ ВОДЫ В МЕДИ СЕРНОКИСЛОЙ (МЕДНОМ КУПОРОСЕ)
Насыпем в пробирку немного медного купороса. Пробирку укрепим в штативе наклонно (рис.).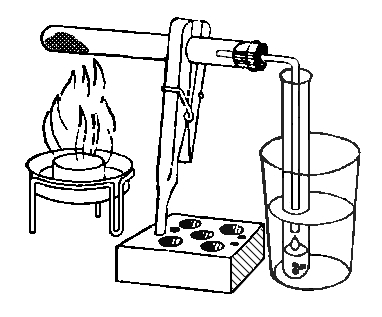
Закроем пробирку пробкой с газоотводной трубкой. Трубку опустим в другую пробирку, в которую положим несколько кристалликов перманганата калия (калия марганцовокислого).
Пробирку с медным купоросом нагреваем в пламени спиртовки. Через некоторое время в пробирке появляется вода, которая по трубке стекает в пробирку с марганцовокислым калием, постепенно растворяя его. Откуда эта вода?
Только из медного купороса, который из голубого вещества, содержащего воду, превращается в серовато-белый безводный порошок.
Следовательно, кристаллы медного купороса содержат воду, которая именно поэтому получила название кристаллизационной. После окончания опыта необходимо дать пробирке остыть и тогда только вынуть из держателя.
33. КАК ВЫДЕЛИТЬ ЧИСТУЮ ВОДУ ИЗ РАСТВОРА?
Мы уже знаем, что растворенное вещество (например, поваренная соль) можно выделить из раствора, выпаривая воду. Чтобы собрать испаряющуюся воду, необходимо ее пары направить в холодную камеру, где они опять сконденсируются в воду. Закрепим пробирку с раствором меди сернокислой (медного купороса) в наклоном положении при помощи держателя, который вставляется в наклонное отверстие в штативе, имеющемся в наборе. Пробирку закроем пробкой, сквозь которую проходит изогнутая трубочка, опущенная почти до дна другой пробирки, погруженной в холодную воду. Эта пробирка служит для охлаждения пара и для сбора конденсирующихся капелек воды (рис.).
Во время опыта необходимо следить за тем, чтобы вода в нагреваемой пробирке сильно не кипела и не попадала в охлаждающую пробирку. Для этого на дно пробирки следует положить несколько стеклянных бусинок или кусочков битого стекла. (Если тебе нужно разбить кусочек стекла - заверни его предварительно в бумагу).
Если опыт произведен правильно, то мы получим совершенно чистую воду.
УГЛЕРОД
 |
 |
 |
 |
Углерод - широко распространенный в природе химический элемент. В свободном состоянии углерод образует такие хорошо известные нам простые вещества, как уголь (сажу), графит, алмаз.
Он входит в состав очень многих сложных веществ, например, парафина, спирта, эфира и многих других.
Углерод входит также в состав многих пищевых продуктов. В этом можно убедиться, проделав опыты, которые приведены далее.
34. УГЛЕРОД - СОСТАВНАЯ ЧАСТЬ САХАРА
Возьмем небольшой кусочек сахара, положим его на жесткую крышку, накроем колпачком или наперстком (попроси у мамы) и сильно нагреем. Скоро из-под колпачка начнет выделяться едкий дым, который горит на воздухе, если к нему поднести спичку. Когда дым перестанет выделяться, снимем колпачок и на крышке увидим черную массу. Это уголь, который входит в состав сахара как элемент углерод.35. КАК СДЕЛАТЬ МАСЛЯНУЮ ЛАМПУ ИЛИ СВЕТИЛЬНИК?
Растительное масло слегка подогреем в фарфоровой чашке. Опустим в нее вату, свернутую в виде фитиля. Один конец при помощи пинцета поднимаем на край чашки и осторожно подожжем его. У нас получился светильник или масляная лампа.Если над пламенем этой лампы поддержать жестяную крышку или чашку, мы увидим, как крышка покроется сажей.
Сажа - тоже углерод.
Значит, масло тоже содержит углерод.
36. В СОСТАВ СВЕЧИ ТОЖЕ ВХОДИТ УГЛЕРОД
Возьмем парафиновую свечу. Поставим ее в стакан или для большей устойчивости закрепим с помощью зажима для пробирок в штативе.Подожжем фитиль свечи и внесем в пламя ее, как и в предыдущем опыте, жестяную крышку или фарфоровую чашку. Чашка покроется сажей (рис.).
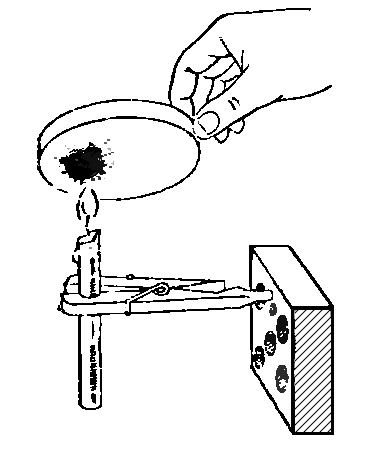
Следовательно, в состав парафина, из которого состоит свеча, также входит углерод, который выделяется из него в виде сажи при сгорании.
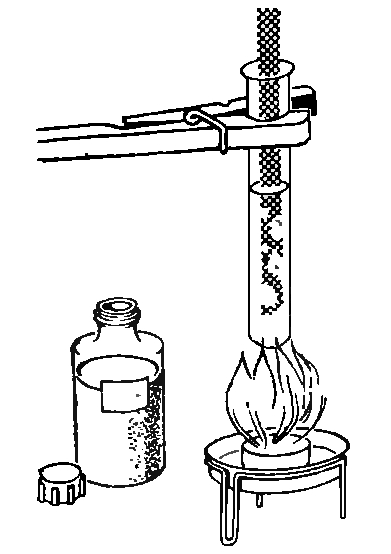
37. ГАЗ ИЗ ДЕРЕВА
Положим в горизонтальную укрепленную пробирку немного сухих кусочков дерева, закроем отверстие пробкой с отводной трубкой (рис.). Теперь нагреем пробирку с древесиной (помни, что нельзя пробирку долго нагревать в одном месте, иначе она лопнет!). Из верхнего отверстия отводной трубки начнет выделяться белый дым, который можно зажечь. Получающееся пламя внизу голубое, вверху желтое - такой же вид имеет пламя газовой горелки. Аналогичный газ можно получить из каменного угля.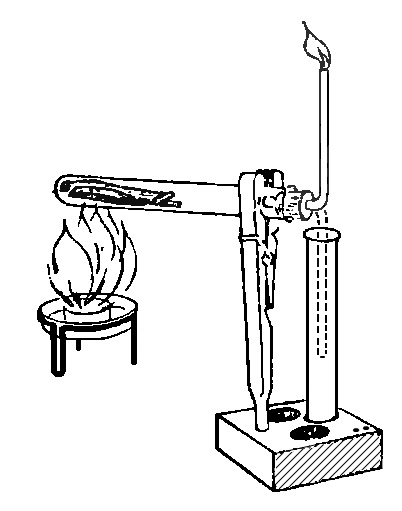
38. ДЕГОТЬ
Если отводную трубку с выделяющимися при нагревании дерева газом опустить концом вниз в пустую пробирку, то там образуется коричневая жидкость с характерным запахом - это деготь.39. ДРЕВЕСНЫЙ УГОЛЬ
В пробирке, где нагревалось дерево, после отделения газа и смолы остается черный древесный уголь. Им можно рисовать на белом листе, а при внесении в пламя он тлеет, как угли в печке.40. СВЕЧА ВЫДЕЛЯЕТ ГАЗ, СПОСОБНЫЙ ГОРЕТЬ
Горящая свеча выделяет газ, который тут же сгорает в ее пламени. Если подержать стеклянную трубочку наклонно, одним концом в нижней части пламени у самого фитиля горящей свечи, то вскоре у другого ее конца начнет выделяться известный уже нам газ, который можно поджечь (рис.).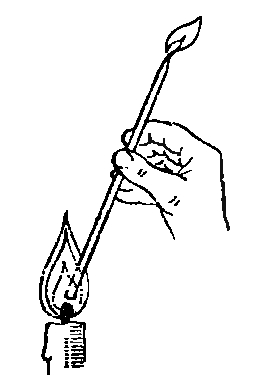
КИСЛОТЫ И ОСНОВАНИЯ. ИНДИКАТОРЫ
Этими веществами пропитывают бумагу.
Существует много видов различных индикаторных бумаг.
В нашем наборе имеются следующие: лакмусовая нейтральная (окрашена в сиреневый цвет), лакмусовая синяя и лакмусовая красная, фенолфталеиновая, метиловая оранжевая, конго.
41. ОПРЕДЕЛЕНИЕ КИСЛОТ
Поставим в штатив две пробирки. Нальем в одну из них немного 10% раствора соляной кислоты, а в другую - такое же количество уксусной. (Для этого используйте имеющийся в домашнем хозяйстве столовый уксус, который представляет 9% раствор уксусной кислоты).В каждую пробирку опустим по половине нейтральной лакмусовой бумажки (она имеет фиолетовый цвет). В пробирке с соляной кислотой бумажка изменила свой цвет на красный, а с уксусной на розовый.
Существуют другие кислоты, в которых фиолетовая бумажка меняет свой цвет на красный. Это серная кислота, азотная и др. Эти кислоты называются сильными кислотами. А такие кислоты, как уксусная, лимонная, винная и др., относящиеся, главным образом, к большому классу химических веществ - органических, называются слабыми.
Следовательно, с помощью индикаторной бумажки (не только лакмусовой) можно определить сильную и слабую кислоту, если они имеют раствор примерно одинаковой концентрации.

Соляная кислота. Важнейший продукт химической промышленности и незаменимый реактив. В промышленности соляную кислоту получают сжиганием смеси хлора и водорода и растворением полученного хлороводорода в воде |
 Серная кислота |
 Индикторная бумага |
42. ОПРЕДЕЛЕНИЕ ОСНОВАНИЙ
В нашем наборе есть кристаллический едкий натр (гидроокись натрия) - это очень ценное основание, широко использующееся и в лабораториях и в промышленности.Прежде всего, приготовим раствор этого основания. К кристаллам едкого натра прильем воды (полный флакон), закроем его пробкой и тщательно взболтаем. Мы видим, что едкий натр очень хорошо растворим в воде. Все основания называются гидроксадами. Они могут быть растворимы в воде и не растворимы.
Растворимые в воде основания, как уже вам известно, называются щелочами. К щелочам относится известковая вода и нашатырный спирт, который неправильно назван "спиртом". Это его бытовое название. Правильно это вещество называется раствор аммиака (гидроксид аммония).
Испытаем нейтральной лакмусовой бумажкой растворы перечисленных выше веществ: гидроксид натрия, гидроксид кальция (известковой воды), гидроксида аммония, налив растворы этих веществ в пробирки и опустив в них по полоске фиолетовой лакмусовой бумажки.
Во всех пробирках фиолетовая бумажка изменила свой цвет на синий.
Следовательно, нейтральный лакмус в щелочной среде становится синим.
При работе со щелочами соблюдайте осторожность!
Не случайно они названы едкими (едкий натр, едкий калий).
Не забывайте, от щелочей надо оберегать глаза и руки, они оставляют на столе несмываемые пятна, портят краску.
Попадание щелочи в глаза может привести к потере зрения!
Растворы щелочей растворяют подкожный слой жира, оставляя на теле долгонезаживающие язвы.
43. ИССЛЕДУЕМ ДРУГИЕ ИНДИКАТОРЫ
Кроме нейтральной лакмусовой бумаги есть синяя и красная. При действии кислот па синюю бумагу она резко изменяет свой цвет на красный, еще отчетливее, чем нейтральная бумага.Изменения в окраске других индикаторов приведены в таблице.
| Индикаторные бумаги | в нейтральной среде | в кислой среде | в щелочной среде |
| лакмусовая нейтральная | фиолетовая | красная | синяя |
| лакмусовая синяя | синяя | красная | синяя |
| лакмусовая красная | красная | красная | синяя |
| фенолфталеиновая | белая | белая | малиновая |
| метилоранжевая | оранжевая | красная | желтая |
| конго | красная | сине-фиолетовая | красная |
44. ЕЩЕ ОДИН ПОМОЩНИК, КОТОРЫЙ СПОСОБЕН ОПРЕДЕЛИТЬ КИСЛОТУ И ЩЕЛОЧЬ (растворимое основание)
Он содержится в листьях красной капусты. Красящее вещество называют антоциан. Опустим листья красной капусты в кипящую воду, и вода окрасится в красно-фиолетовый цвет. Этот раствор поможет нам в определении кислот.45. КАК ОПРЕДЕЛИТЬ КИСЛОТЫ И ЩЕЛОЧИ ПРИ ПОМОЩИ КРАСЯЩЕГО ВЕЩЕСТВА КРАСНОЙ КАПУСТЫ (АНТОЦИАНА)?
Добавим к раствору антоциана немного кислоты, и фиолетовый раствор покраснеет. Если же к раствору добавить щелочь, например, немного гидроксида аммония, то раствор станет синим, даже зеленым.46. ИЗ ЧЕГО ЕЩЕ МОЖНО ПОЛУЧИТЬ РАСТВОР АНТОЦИАНА?

47. РАСТВОР ПИТЬЕВОЙ СОДЫ ИМЕЕТ ЩЕЛОЧНУЮ СРЕДУ
Приготовим раствор питьевой соды: растворим небольшое количество (2-3 ложечки, которые имеются в наборе) натрия углекислого кислого (гидрокарбоната натрия, питьевой соды) в 1/2 пробирки воды. Полученный раствор разделим на 2 пробирки.В одну пробирку опустим красную лакмусовую бумажку. Бумажка меняет свой цвет на синий.
В другую пробирку добавим 1-2 капли раствора фенолфталеина, который нужно предварительно приготовить, как это указано в начале руководства. Раствор в этой пробирке становится малиновым.
Следовательно, раствор питьевой соды в воде действует на индикаторы как основание.
48. ЛИМОННАЯ КИСЛОТА

Бумажка меняет свой цвет. Из фиолетовой она становится розовой. Следовательно, в состав лимонного сока входит слабая кислота, которую химики называют лимонной кислотой.
Можно воспользоваться и другими индикаторами.
Аналогичный опыт с соком яблока показывает, что в яблоке тоже есть кислота, только это другая кислота, яблочная.
49. ИССЛЕДУЕМ СОК ИЗ ЛИСТЬЕВ ЩАВЕЛЯ И КЛЕВЕРА
Если растереть между пальцами лист щавеля или клевера и капнуть образовавшимся при этом соком на лакмусовую бумажку нейтральную, то лакмус окрасится в розовый цвет. Щавель и клевер содержат кислоту, которая называется щавельной кислотой.
50. ТВЕРДЫЕ КИСЛОТЫ
Но не надо думать, что кислота всегда бывает жидкой.Например, винная кислота имеет вид твердых бесцветных кристаллов.
Чтобы убедиться в том, что эти бесцветные кристаллы являются кислотой, следует растворить их в воде и испытать полученный раствор индикатором. Щавельная кислота, которая находится в соке листьев щавеля и клевера и др., тоже представляет собой белые кристаллы, но в листьях она находится в растворенном состоянии. Аналогично обстоит дело и с лимонной кислотой.
51. СВЕЧА МОЖЕТ СОСТОЯТЬ ИЗ КИСЛОТЫ
Белая стеариновая свеча не покажется кислой на вкус, если ее лизнуть языком, несмотря на то, что она состоит из стеариновой кислоты. Если уронить каплю расплавленной свечи на синюю или нейтральную лакмусовую бумагу, можно убедиться в кислотных свойствах белой свечи: лакмусовая бумага покраснеет. Стеариновая кислота - тоже твердая кислота.Но таким свойством не обладает парафиновая свеча.

52. ЛИМОНАД СОДЕРЖИТ УГОЛЬНУЮ КИСЛОТУ
Некоторые разбавленные кислоты безвредны, их можно пить или употреблять в пищу, например: уксусная и лимонная кислоты, которые используются в домашнем хозяйстве. Угольная кислота содержится в минеральной воде и лимонаде.В том, что в газированной воде содержится кислота, можно легко убедиться. Капнем газировку (не минеральную воду т.к. она содержит растворенные соли!) на полоску синей или нейтральной лакмусовой бумажки.
Но если немного газированной воды прокипятить с минуту в пробирке и после этого вновь испытать на кислоту, то мы увидим, что изменение окраски лакмуса не происходит. Это объясняется тем, что нагревание разрушает угольную кислоту (при этом образуется вода и углекислый газ), поэтому ее нужно хранить на холоду, т.е. при пониженной температуре.
53. КИСЛОТА... В МУРАВЕЙНИКЕ
Если ты окажешься летом в лесу, то наверняка найдешь там хоть один муравейник.Не забудь захватить с собой в лес верного помощника юного химика - индикаторные бумажки, и тогда ты сможешь узнать еще об одной кислоте.
Нельзя трогать муравейник руками, муравьи, защищая свой дом, больно кусаются, это ты знаешь. Но ты можешь осторожно с помощью палочки нажать синей лакмусовой бумажкой на хвою так, чтобы побеспокоить муравьев. Бумажка вскоре покроется красными точками от муравьиных укусов.
При укусе муравей впрыскивает в ранку кислоту, которая и вызывает боль. Эта кислота так и называется: муравьиная.

54. КИСЛОТА В ЖЕЛУДКЕ ЧЕЛОВЕКА
Желудочный сок, который помогает переваривать пищу в желудке человека, содержит в небольшом количестве настоящую соляную кислоту. Если по каким-то причинам в желудке выделяется больше соляной кислоты, чем это необходимо для пищеварения, то избыточная кислота вызывает изжогу или желудочную боль. Многие люди в качестве противодействующего средства в этом случае принимают ложечку питьевой соды. Она нейтрализует избыточную кислоту.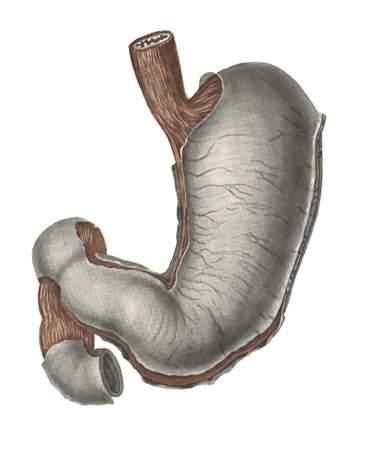
55. ЗНАКОМИМСЯ С НОВОЙ КИСЛОТОЙ
Если нейтральную или синюю лакмусовую бумажку опустить в фарфоровую чашку с раствором железа (II) сернокислого 7-водного (сульфата железа (II), железного купороса), через который пропущен ток от карманной батарейки, то бумажка окрасится в красный цвет. Следовательно, в растворе присутствует кислота, которая образовалась в результате пропускания электрического тока. Медь сернокислая (сульфат меди, медный купорос) под действием воды (при растворении) распадается на заряженные частицы:Группа SO42- переходит в состав образовавшейся кислоты. Эта группа называется кислотный остаток. В него входит сера, поэтому новая кислота называется серной. Кроме кислотного остатка в состав кислоты обязательно входит водород. От него зависит красная окраска лакмуса.
56. ЖИДКОСТЬ ИЛИ ГАЗ?
Нальем в пробирку немного раствора соляной кислоты и нагреем ее на спиртовке, а над отверстием пробирки подержим влажную лакмусовую бумажку (нейтральную или синюю). При нагревании из соляной кислоты будет выделяться газ, который постепенно окрасит бумажку в красный цвет. Этот газ называется хлороводород. Причем, хорошо известная нам соляная кислота представляет собой не что иное, как раствор хлороводорода в воде. Гидроксид аммония - это водный раствор аммиака (нашатырный спирт). Аммиак - это газ, который легко обнаружить по его резкому запаху и по действию на предварительно смоченную водой лакмусовую бумажку нейтральную или красную, которая становится синей, если ее подержать над пробиркой с раствором аммиака.При работе с соляной кислотой будь очень осторожен! Соляная кислота относится к сильным кислотам.
В нашем наборе это уже разбавленная кислота. Но даже с разбавленной кислотой следует обращаться очень осторожно. Не оставляй флакон с кислотой на виду, чтобы он не попал в руки твоим младшим братьям и сестрам.
57. ОПЫТЫ С ШЕЛКОМ
Возьмем небольшой кусочек ткани из натурального шелка (например, крепдешина), положим его в чистую сухую пробирку и осторожно нагреем над пламенем спиртовки. Над отверстием пробирки подержим влажную лакмусовую бумажку нейтральную или красную. Вскоре бумажка станет синей от присутствия аммиака, который легко обнаружить по его характерному запаху. Такой же опыт можно провести с кусочком искусственного (ацетатного) шелка, используя в этом случае влажную нейтральную или синюю лакмусовую бумажку. Лакмус окрасится в красный цвет под действием паров кислоты, выделяющейся из искусственного шелка. Так можно отличить искусственный шелк от натурального.58. ЧТО ТАКОЕ ХЛОРИСТЫЙ АММОНИЙ (ХЛОРИД АММОНИЯ)?
Нальем в пробирку раствор аммиака (нашатырный спирт) и опустим туда кусочек нейтральной лакмусовой бумажки, который тут же окрасится в синий цвет. Можно использовать метилоранжевую бумажку, которая станет желтой. Теперь с помощью пипетки начнем приливать к раствору аммиака соляную кислоту (соблюдай осторожность) и будем это делать до тех пор, пока лакмусовая бумажка не примет свой первоначальный цвет. Если мы теперь потрогаем пробирку рукой, то убедимся, что пробирка нагрелась, потому что реакция кислоты и основания протекает с выделением тепла. В химии эта реакция называется реакцией нейтрализации, потому что в результате ее, как показывает лакмус, образовалось вещество, не обладающее ни свойствами кислот, ни свойствами оснований - т.е. вещество с нейтральными свойствами. А теперь попытаемся его выделить. Для этого жидкость из пробирки выльем в чашку и выпарим на спиртовке. На дне чашки мы увидим белое кристаллическое соединение, которое называют хлористым аммонием (хлоридом аммония).
59. ИССЛЕДУЕМ ХЛОРИСТЫЙ АММОНИЙ
Поместим в стеклянную Г-образную трубку небольшое количество хлорида аммония. Набирать его следует непосредственно Г-образной трубкой, ее длинным концом, а затем постукиванием по трубке продвинуть его к изгибу трубки, не утрамбовывая сильно. Трубку закрепить с помощью зажима для пробирок в штативе. Для того, чтобы трубка не вращалась, обернуть ту ее часть, которая будет закреплена в зажиме, бумагой (рис.).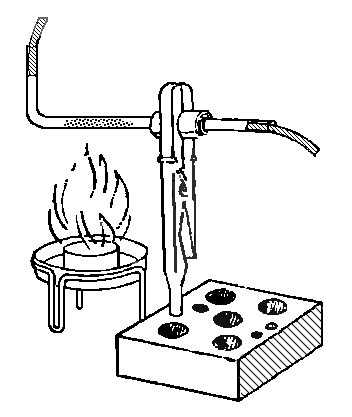
В отверстия трубки вставить влажные нейтральные лакмусовые бумажки. Нагревать соль в пламени спиртовки. Через некоторое время наблюдаем изменение окраски лакмусовых бумажек. У верхнего отверстия трубки - на синюю, а у нижнего - на красную. Хлорид аммония - вещество очень непрочное и разлагается при нагревании на два газа: аммиак и хлороводород. Аммиак, более легкий газ, выходит через верхнее отверстие трубки, попадает на влажную лакмусовую бумагу, растворяется в том незначительном количестве воды, которое содержится на бумажке и изменяет цвет лакмусовой бумаги с фиолетового на синий. То же самое происходит и с хлороводородом. Как более тяжелый газ, он выходит через нижнее отверстие трубки, на влажной лакмусовой бумажке он образует соляную кислоту, которая изменяет цвет бумажки с фиолетового на красный.
Аммиак и хлороводород очень хорошо растворяются в воде.
60. НАШАТЫРНЫЙ СПИРТ - ОБЕЗБОЛИВАЮЩЕЕ СРЕДСТВО ПРИ МУРАВЬИНОМ И ПЧЕЛИНОМ УКУСАХ
При укусе муравей впрыскивает в ранку муравьиную кислоту, вызывающую резкую боль. Если место укуса смочить нашатырным спиртом - боль пропадет, так как нашатырный спирт - это основание. Он нейтрализует кислоту. Пчелиный яд тоже содержит муравьиную кислоту, поэтому при пчелином укусе нашатырный спирт также смягчает боль. |
 |
61. ХЛОРИСТЫЙ АММОНИЙ (ХЛОРИД АММОНИЯ, НАШАТЫРЬ) для пайки металлов.
Действие хлорида аммония мы поясним на следующем опыте. Прокалим в пламени спиртовки медную проволоку. Медь покроется черным слоем оксида меди, который препятствует хорошему соединению металлов при пайке, и, следовательно, этот слой нужно удалить.Если посыпать прокаленную поверхность медной проволоки хлоридом аммония и снова прокалить, то медная проволока очистится от черного оксидного слоя.
Под действием температуры из хлорида аммония выделяется хлороводород, который, растворяясь в парах воды, находящихся в воздухе, образует соляную кислоту. Соляная кислота вступает в химическую реакцию с оксидом меди.
ПЛОДЫ И ФРУКТЫ
62. СЛАДКОЕ И КИСЛОЕ В ВИНОГРАДЕ
Капля виноградного сока оставляет на синей или нейтральной лакмусовой бумажке красное пятно. Это значит, что в винограде есть кислота. Но он содержит также сахар. Проба на сахар с основанием и сернокислой медью (медным купоросом) покажет наличие сахара.
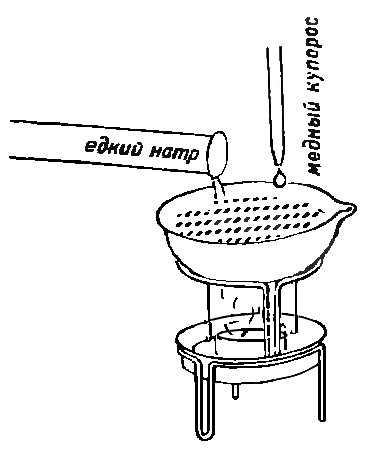
63. ПРОБА НА САХАР
Налей в пробирку немного раствора гидроокиси натрия (едкого натра). Затем добавь по каплям раствор сернокислой меди (медного купороса). Образуется голубой студнеобразный осадок. Этот осадок осторожно нагрей.При этом ты будешь наблюдать изменение окраски осадка от бурого до черного. Вещество черного цвета - это оксид меди (II) СuО.
А теперь немного видоизменим опыт. Налей в пробирку виноградного сока (3 см по высоте пробирки). Прибавь столько же раствора едкого натра, а затем по каплям раствор медного купороса.
Раствор окрашивается в красивый синий цвет. Получившийся раствор нагрей на спиртовке.
Постепенно раствор меняет окраску: синий - зеленый - желтый - красный.
Появление красной окраски (цвет томатного сока) свидетельствует о том, что в виноградном соке содержится глюкоза.
Глюкоза - один из видов сахара, виноградный сахар. Это и есть проба на глюкозу.
64. МЫ НАХОДИМ САХАР В ЯГОДАХ
Несколько капель сока, выжатого из смородины или малины, подвергаем вышеописанной пробе, желто-красная окраска подтверждает, что эти ягоды тоже содержат виноградный сахар.
65. МЕД И ВАРЕНЬЕ СОДЕРЖАТ ВИНОГРАДНЫЙ САХАР
Растворим в небольшом количестве воды в отдельных пробирках понемногу варенья и меда. Сделаем, как описано выше, пробу на сахар.В обеих пробирках находим сахар.
Таким образом, в меде и варенье содержится виноградный сахар.

66. ВЫРАБАТЫВАЮТ ЛИ ПЧЕЛЫ САХАР?
Итак, мед содержит виноградный сахар. Интересно, берут ли пчелы виноградный сахар из цветов готовым или они вырабатывают его сами?Чтобы в этом разобраться, сделаем пробу на глюкозу с соком клевера, с головок которого пчелы и собирают его. В клевере содержится виноградный сахар, значит пчелы извлекают сахар из цветов.

67. ГДЕ ЕЩЕ СОДЕРЖИТСЯ ВИНОГРАДНЫЙ САХАР?
Проверим, есть ли сахар в изюме, инжире, яблокеИз яблока выжать сок, а из изюма и инжира нужно приготовить вытяжку: вскипятить в одной пробирке воду с несколькими ягодами изюма, а в другой - воду с несколькими кусочками инжира. Затем слить воду с изюма и инжира в другие пробирки и проверить в полученных вытяжках и в соке наличие сахара с помощью описанной выше реакции (с гидроксидом натрия и медным купоросом).
68. САХАР ДВУХ ВИДОВ
Если проделать опыт с кусковым сахаром, который мы употребляем в пищу, то красного окрашивания не получится, как в присутствии виноградного сока. Это происходит потому, что кусковой сахар вырабатывают из сахарной свеклы или сахарного тростника, а сахар, содержащийся в свекле и сахарном тростнике, отличается от сахара фруктов. Химики называют его сахарозой.69. ТРОСТНИКОВЫЙ САХАР (САХАРОЗА) ПРЕВРАЩАЕТСЯ В ВИНОГРАДНЫЙ

Кусочек сахара растворяем в чашке с водой, добавляем 10 капель соляной кислоты и кипятим 3 минуты (рис.). Если потом сделать пробу на сахар, получим красное окрашивание. Дело в том, что свекольный (тростниковый) сахар при обработке его кислотой частично превращается в виноградный сахар.
70. ЕСТЬ ЛИ САХАР В ХЛЕБЕ?
В обычном хлебе сахара нет, но если кусочек хлеба пожевать и поместить получившуюся кашицу в пробирку и сделать пробу на сахар, то можно обнаружить в хлебе виноградный сахар. Он образуется из крахмала хлеба в результате воздействия слюны.71. НЕСПЕЛОЕ И СПЕЛОЕ ЯБЛОКО
Неспелое яблоко не содержит сахара; зато в нем много крахмала. В созревшем яблоке раствором йода можно показать отсутствие крахмала; а сахарной пробой - наличие виноградного сахара. Созревание фруктов представляет собой химический процесс, при котором происходит превращение крахмала в сахар.
72. КРАХМАЛ ПРЕВРАЩАЕТСЯ В САХАР
Нальем в эмалированную тарелку крахмальной клейстер (примерно 1 объем пробирки) и добавим немного соляной кислоты (одну ложку). Смесь нагреем и в самом начале нагревания отберем пипеткой немного клейстера и добавим к нему каплю настойки йода. Синяя окраска покажет, что крахмал еще находится в растворе. В ходе опыта время от времени будем брать пробы раствора из тарелки, охлаждая их и добавляя каплю настойки йода. После нескольких минут нагревания отбираемая проба станет окрашиваться в фиолетовый цвет. Теперь пробы нужно отбирать чаще. Последующие пробы уже будут окрашиваться йодом в красный цвет, и, наконец, окраска станет желтой. Можно с уверенностью сказать, что в тарелке крахмала уже нет. Возьмем еще одну пробу, добавим к ней щепотку соды (чтобы нейтрализовать кислоту), проведем испытание на сахар, и мы его обнаружим.73. КРАХМАЛЬНЫЙ ЗАВОД НА ДОМУ
Очищенный картофель нужно растереть на терке и полученную массу хорошо размешать в воде, затем положить в чистый мешочек (узелок) из редкого полотна и отжать. Остаток массы в полотне следует вновь перемешать с водой и отжать (рис.). Повторить этот процесс несколько раз. Дать жидкости отстояться. Зерна крахмала осядут на дно посуды. Сольем жидкость, а осевший крахмал вновь размешаем в чистой воде. Снова повторим операцию несколько раз до тех пор, пока крахмал не станет чистым и совершенно белым. Просуши его и можешь отдать маме, она обязательно его использует.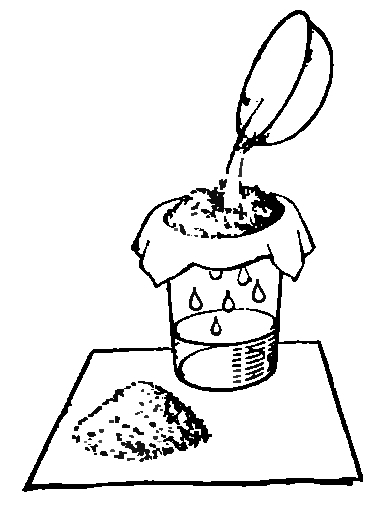
74. СОЛНЕЧНЫЙ СВЕТ В ПРИРОДЕ
Без солнечного света не происходит образование крахмала в зеленых листьях растений. Покажем это на опыте.Выберем для опыта растение с широкими, не слишком толстыми и твердыми листьями. Выбранный лист должен хорошо освещаться солнцем в течение дня. Вечером прикрепим к листу булавкой два пробочных диска так, чтобы они находились друг против друга на верхней и нижней стороне листа (рис.).
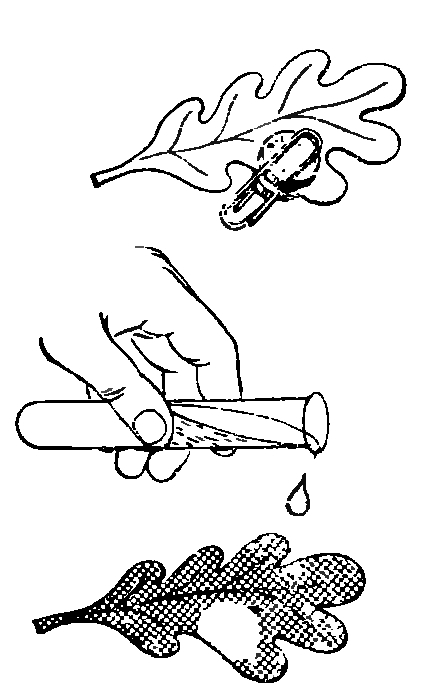
На следующий вечер сорвем лист, снимем пробки и погрузим лист на несколько секунд в кипящую воду. После этого положим лист в спирт (водку) и оставим его там в течение нескольких часов, пока вся зеленая краска листа не исчезнет. Вынем лист из спирта, протрем затемненный кружок и окружающую поверхность листа йодной настойкой. Вокруг кружка лист окрасится в черно-синий цвет - там есть крахмал. Кружок, который был закрыт от света, не темнеет. Крахмала там нет. Почему?
Днем, под действием солнечного света, в листьях растений образуется крахмал, который ночью превращается в сахар. На затемненном месте листа крахмал не образовался, и характерного окрашивания не произошло.
75. "ОГНЕОПАСНАЯ" АПЕЛЬСИНОВАЯ КОЖУРА
Фрукты содержат не только кислоты и сахар, но и жир или маслянистые вещества. Если взять кусочек апельсиновой корки и выжать ее над листом бумаги, то на бумаге появляются жирные пятнышки. Они получаются от масла, которое содержится в кожуре. Если выжать кожуру около пламени спиртовки, то брызги масла образуют маленький сноп огня.
76. КАКИЕ ПЛОДЫ СОДЕРЖАТ ЖИР?
Если на лист бумаги положить кусочек сливочного масла или маргарина и растереть его, останется жирное пятно. Капля подсолнечного масла тоже оставляет жирное пятно.Ядро грецкого или другого ореха также содержит жир, если его раздавить на бумаге - получится жирное пятно.
77. ПОЧЕМУ БЕНЗИНОМ ВЫВОДЯТ ПЯТНА?
В бензин (5 см по высоте пробирки) положи кусочек масла, закрой пробирку пробкой и встряхни. Масло скоро растворится. Значит, бензин растворяет жир. Вот поэтому бензином можно вывести с одежды жирное пятно, которое не может смыть вода.78. БЕНЗИН ЛЕТУЧ
Но если надолго оставить бензин с растворенным в нем маслом в открытой чашке, то со временем ты увидишь, что в чашке осталось только масло, а бензин испарился.УГЛЕКИСЛЫЙ ГАЗ
79. ПОЧЕМУ МУТНЕЕТ ИЗВЕСТКОВАЯ ВОДА?
Нальем немного известковой воды в пробирку и оставим ее на воздухе. На следующий день бесцветная известковая вода покроется белым налетом. Это происходит от того, что в известковой воде содержится кальция гидроокись (гашеная известь, гидроксид кальция), которая взаимодействует с углекислым газом с образованием мела (карбоната кальция). Это доказывает, что в воздухе в свободном состоянии всегда присутствует углекислый газ, который химики называют оксидом углерода (IV).
80. УГЛЕКИСЛЫЙ ГАЗ ИЗ МРАМОРА
Приготовим раствор винной кислоты (2-3 ложечки кислоты па 1/2 пробирки воды). Поместим в полученный раствор кусочек мрамора, представляющий собой карбонат кальция.Закроем пробирку пробкой с изогнутой стеклянной трубочкой. Происходит вспенивание с выделением углекислого газа, который можно определить с помощью известковой капли (рис.).
81. ПОЛУЧЕНИЕ КАРБОНАТА МЕДИ
Приготовим в отдельных пробирках растворы меди сернокислой (сульфата меди) и натрия углекислого кислого (гидрокарбоната натрия, питьевой соды) и смешаем их. Образуется голубой осадок карбоната меди. Отфильтруем этот осадок через бумажный фильтр и промоем несколько раз водой, заливая воду в воронку с фильтром. Потом фильтровальную бумагу с осадком разложим на чистом листе бумаги и поместим лист с осадком на несколько дней в теплое место.Вода испарится, и на фильтре останется порошок голубого цвета. Это карбонат меди СuСО3. Соберем его в пробирку, так как он понадобится для следующих опытов.
82. УГЛЕКИСЛЫЙ ГАЗ ИЗ КАРБОНАТА МЕДИ
Насыпем в чистую сухую пробирку небольшое количество карбоната меди, полученного в предыдущем опыте. Укрепим пробирку при помощи зажима для пробирок в штативе и закроем пробкой со вставленной в нее газоотводной трубкой. Свободный конец газоотводной трубки опустим в пробирку с известковой водой. Начнем нагревать пробирку с карбонатом меди на спиртовке (рис.).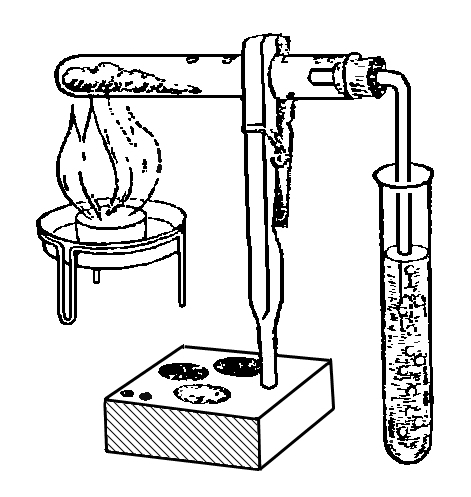
Через некоторое время наблюдаем пробулькивание пузырьков газа через известковую воду и ее помутнение, а голубой порошок меди постепенно становится черным. Черный порошок - это оксид меди (II). Следовательно, карбонат меди при нагревании разложился на оксид меди (II) и оксид углерода (IV) (или углекислый газ).
 Малахит - одна из разновидностей карбоната меди |
83. УГЛЕКИСЛЫЙ ГАЗ, ПОЛУЧЕННЫЙ ИЗ НАТРИЯ УГЛЕКИСЛОГО КИСЛОГО (ПИТЬЕВОЙ СОДЫ)
а) Слегка нагреем горизонтально установленную пробирку с порошком питьевой соды, не опуская конец изогнутой трубки в пробирку с водой, иначе вода поднимается в горячую пробирку и она лопнет. Затем, продолжая нагревать, опустим конец трубки в пробирку с водой и увидим пузырьки выделяющегося газа. Как только мы заметили выделение газа, заменим пробирку с обычной водой на пробирку с известковой водой. Известковая вода вскоре помутнеет, значит, из соды выделяется углекислый газ.б) Капнем на щепотку питьевой соды уксусной кислотой. Происходит обильное вспенивание с выделением газа. Поместим соду в пробирку с уксусной кислотой и выделяющийся газ через газоотводную трубку пропустим в известковую воду. Она мутнеет. Это еще раз подтверждает, что из соды можно получить углекислый газ.
84. КАК ПИТЬЕВАЯ СОДА СПОСОБСТВУЕТ ВЫПЕЧКЕ ХЛЕБА?

Вначале приготовим искусственные дрожжи. Для этого перемешаем две небольшие равные части винной (или лимонной) кислоты и натрия углекислого кислого (питьевой соды). Потом попросим у мамы муки для нашего опыта. Насыпем муки в фарфоровую чашку, добавим к ней приготовленный порошок и основательно перемешаем. После этого добавим немного воды и вновь как следует перемешаем так, чтобы получилось полужидкое тесто. Теперь будем нагревать тесто на слабом пламени спиртовки. Мы знаем, что при нагревании из соды выделятся углекислый газ, и за счет этого тесто поднимается и после выпечки становится рыхлым. Однако наше печенье нельзя сравнить с маминым и пробовать его не стоит.
Этот опыт мы провели только для того, чтобы убедиться, как сода помогает при изготовлении хлебных и кондитерских изделий придать им рыхлость и пышность.
85. ИССЛЕДУЕМ ДРОЖЖИ

Попросим у мамы небольшой кусочек дрожжей (лучше свежих), положим его в пробирку, наполовину заполненную сладкой водой. Пробирку закроем пробкой с газоотводной трубкой, свободный конец которой опустим в другую пробирку - с известковой водой.
Через некоторое время (5-7 минут) наблюдаем вспенивание жидкости в пробирке с дрожжами и помутнение известковой воды. Следовательно, мы наблюдаем выделение углекислого газа.
Дрожжи - это грибковые микроорганизмы. Углекислый газ - это продукт их жизнедеятельности, а сахар (сладкая вода) является для них питательной средой.
86. ГАЗ В ЛИМОНАДЕ - УГЛЕКИСЛЫЙ ГАЗ
Если открыть лимонад, предварительно встряхнув бутылку, из него выделяется много газовых пузырьков.Закроем бутылку с лимонадом пробкой с изогнутой трубкой. Длинный конец трубки опустим в пробирку с известковой водой. Известковая вода быстро помутнеет (рис.). Следовательно, в лимонаде содержится знакомый нам углекислый газ.
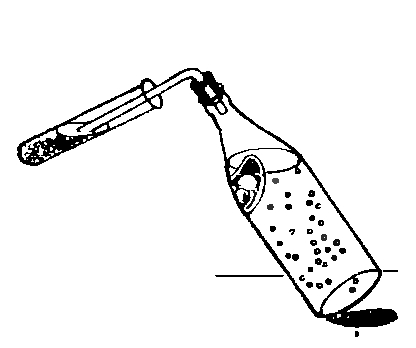
87. ПИВНАЯ ПЕНА СОДЕРЖИТ УГЛЕКИСЛЫЙ ГАЗ
Чтобы это доказать, надо, как в предыдущем опыте, вставить в бутылку с пивом пробку с газоотводной трубкой, свободный конец которой опустить в пробирку с известковой водой.Пиво специально насыщают углекислым газом, чтобы повысить освежающий вкус.
88. ПРИГОТОВИМ... ЛИМОНАД!
Можно самим приготовить пенящийся лимонад. Насыпем в пробирку порошок винной (лимонной) кислоты и соды (по 2 см по высоте пробирки) и порошок растолченного сахара или сахарный песок (6 см по высоте). Затем, насыпав эту смесь на лист бумаги или в сухую чистую чашку, основательно перемешаем и разделим на несколько приблизительно равных частей. Каждую часть можно упаковать в пакетик, подобный аптечному для порошков. Если один такой порошок высыпать в стакан и налить в него воды, получится шипящий и пенящийся напиток, освежающий, как лимонад.89. НЫРЯЮЩЕЕ ЯЙЦО
В стакан с раствором соляной кислоты опускаем яйцо, оно тонет, но через некоторое время оно всплывает на поверхность, а потом снова ныряет. Почему?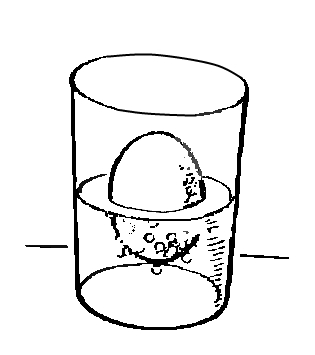
На поверхности яйца в растворе начинается процесс между содержащимся в скорлупе углекислым кальцием и соляной кислотой, в результате чего получается углекислый газ, пузырьки которого пристают к скорлупе и поднимают яйцо вверх. На поверхности пузырьки срываются и уходят в воздух, яйцо снова погружается на дно, а потом опять поднимается. Так яйцо ныряет, пока не растворится скорлупа.
90. УГЛЕКИСЛЫЙ ГАЗ И МЫЛЬНЫЙ ПУЗЫРЬ
Заполним углекислым газом стеклянную банку, с помощью соломинки выдуем мыльный пузырь, который осторожно опустим в стакан. Так как углекислый газ - тяжелый газ, он останется внизу банки, а мыльный пузырь будет держаться на невидимой для нас поверхности газа (рис.).
91. УГЛЕКИСЛЫЙ ГАЗ ГАСИТ ПЛАМЯ
В углекислом газе ничто не горит, он не поддерживает горения. Если поставить свечу в широкий сосуд и долгое время наполнять этот сосуд углекислым газом, газ поднимается постепенно до верха свечи и погасит ее (рис.).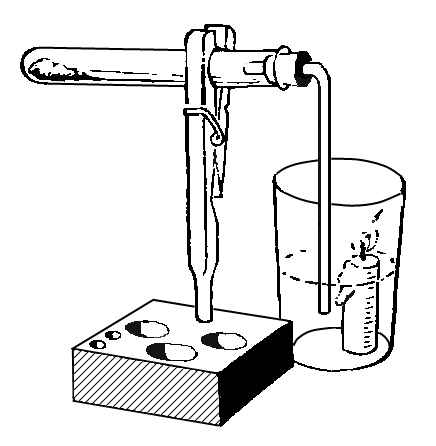
 Углекислотные огнетушители - одни из наиболее распространенных |
92. УГАСАЮЩЕЕ ПЛАМЯ
Если накрыть горящую свечу перевернутым стаканом, она продолжает некоторое время гореть, затем мерцает и гаснет. В воздухе под стаканом содержится кислород и, как только он израсходуется, пламя потухнет.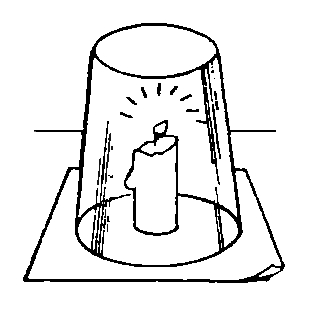

КАРБОНАТЫ
93. ЧТО ТАКОЕ СОДА?
Растянем кусочек нихромовой спирали от электроплитки. Сделаем из нее петельку с очень маленьким отверстием. Петельку закрепим на деревянной палочке или на карандаше.На петельку поместим кусочек стиральной соды и внесем ее в пламя спиртовки. Пламя окрасится в желтый цвет.
Такую же окраску будет иметь пламя, если в него внести натрий углекислый кислый (питьевую соду) и чтобы питьевая сода не проваливалась в петельку, нужно смочить ее водой, а затем опустить в сосуд с содой. Частички соды прилипнут к влажной петельке.
Кроме того, мы обнаружим, что из соды выделяется углекислый газ.
Стиральную соду называют углекислый натрий или карбонат натрия.
В состав питьевой соды входит еще элемент - водород.
Питьевую соду называют гидрокарбонат натрия. Это сода, содержащая водород.
Латинское название водорода - гидрогениум.
 |

Соли натрия окрашивают пламя в желтый цвет |
94. ОПЫТ С КУСОЧКОМ МЕЛА
Если мы обработаем соляной кислотой кусочек мела, то по вспениванию можно определить, что мел тоже выделяет углекислый газ. Вещество, из которого состоит мел, называется углекислый кальций или карбонат кальция.95. РАКОВИНА УЛИТКИ
Наверно, ты не раз видел раковину улитки. Это домик, в котором живет улитка, и возле реки часто можно найти пустую раковину улитки.Если соскоблить с раковины темное покрытие и затем капнуть на это место кислотой, происходит вспенивание. Значит, раковина улитки содержит углекислый кальций.

96. ЧТО СОДЕРЖИТСЯ В ЗУБНОМ ПОРОШКЕ И ЗУБНОЙ ПАСТЕ?
При помощи столового уксуса попробуй исследовать зубной порошок и зубную пасту.Насыпь немного зубного порошка в фарфоровую чашку и прилей немного уксуса. Ты наблюдаешь бурное вспенивание. Это выделяется углекислый газ. Следовательно, зубной порошок содержит углекислый кальций СаСО3.
То же самое проделай с зубной пастой.

97. О МРАМОРЕ, МЕЛЕ И ГИПСЕ
Мрамор, как и мел, состоит из карбоната кальция и при действии на них соляной кислотой - происходит вспенивание. Гипс внешне похож на мел, но при действии на него соляной кислотой вспенивания не происходит.В этом можно убедиться, если на кусочек гипса и кусочек мрамора или мела подействовать соляной кислотой.
Помни о правилах работы с соляной кислотой.
Гипс - это сернокислый кальций (или сульфат кальция).

98. ГИДРОКАРБОНАТ КАЛЬЦИЯ
Небольшой кусочек мела положим в пробирку, добавим соляной кислоты. Пробирку закроем пробкой с газоотводной трубкой, свободный конец которой опустим в другую пробирку - с известковой водой. При поступлении углекислого газа (оксида углерода (IV)) происходит помутнение известковой воды. Это образовался карбонат кальция (углекислый кальций). Продолжаем пропускать углекислый газ. Помутневшая известковая вода постепенно светлеет и скоро становится совсем прозрачной. В растворе образовалось новое вещество - гидрокарбонат кальция. (Сохраним полученный раствор гидрокарбоната кальция для следующих опытов).ЕЩЕ РАЗ О ВОДЕ
99. ВОДА, НЕ СОДЕРЖАЩАЯ ПРИМЕСЕЙ - "МЯГКАЯ" ВОДА
В отличии от "жесткой" воды "мягкая" вода не препятствует пенообразованию. Нальем в пробирку немного прозрачного раствора гидрокарбоната кальция и прокипятим его. Раствор становится мутным. При нагревании гидрокарбонат кальция превращается в нерастворимый карбонат кальция. Отфильтруем полученную жидкость и добавим в полученный фильтрат ("мягкая" вода) немного мыла. Встряхнем пробирку и увидим обильную пену, которой не образовалось бы так много, если бы вода была "жесткой", т.е. содержала бы примеси.100. "ЖЕСТКАЯ" ВОДА И РАСТВОР АММИАКА
"Жесткую" воду можно сделать "мягкой" с помощью раствора аммиака, если к прозрачному раствору гидрокарбоната кальция добавить немного раствора аммиака и отфильтровать образовавшийся осадок.101. "ЖЕСТКАЯ" ВОДА И СОДА
Добавим в раствор гидрокарбоната кальция водный раствор стиральной соды (карбонат натрия). Смесь помутнеет. Это показывает, что гидрокарбонат кальция превратился в карбонат кальция, а "жесткая" вода стала "мягкой". Вот почему раньше при стирке в воду добавляли раствора аммиака или соду.О КУРИНОМ ЯЙЦЕ И БЕЛКЕ
102. ОТВЕРСТИЕ В ЯЙЦЕ

Если накапать несколько капель соляной кислоты на скорлупу яйца, происходит вспенивание, с этим мы уже знакомы. Скорлупа состоит из углекислого кальция, который растворяется в кислоте. Если капать кислотой на одно и то же место, то постепенно в скорлупе образуется отверстие, через которое видно содержимое яйца.
103. ИССЛЕДУЕМ ЯЙЦО
|
Строение куриного яйца 1. Скорлупа, 2, 3. Подскорлуповая оболочка, 4, 13. Канатик (халазы), 5, 6, 12. Белок (разный по консистенции), 7. Желточная оболочка, 8, 10 и 11. Желток, 9. Зародышевый диск, 14. Воздушная камера (пуга), 15. Кутикула |
Сварим яйцо и убедимся, что оно состоит из двух частей: из желтка и белка, который в сыром яйце имеет вид слизистой массы и только лишь при нагревании становится белым и сравнительно твердым. Осторожно разобьем сырое яйцо так, чтобы не повредить желтка, а потом отделим от слизистой массы небольшую часть и поместим ее в две пробирки.
Если пробирку с белком нагреть на огне, слизистая масса скоро станет белой и твердой, как это бывает при приготовлении яичницы-глазуньи. Об этом явлении говорят так: белок свернулся.
104. ПРОБА НА БЕЛОК
Белок во второй пробирке разбавим вчетверо водой и хорошенько встряхнем. Прозрачную белковую жидкость нагреем, но только в верхней половине пробирки с тем, чтобы появившееся изменение можно было сравнить с ненагретым белком. Нагретая часть жидкости скоро мутнеет, что свидетельствует о способности белка свертываться при нагревании.
105. ПОПРОБУЕМ СЖЕЧЬ БЕЛОК
На металлической проволоке сожжем крошку свернувшегося белка и потом понюхаем ее. По характерному запаху, который напоминает запах жженого рога, мы всегда узнаем белок.106. ЕЩЕ О ПРОБЕ НА БЕЛОК
107. СОДЕРЖИТСЯ ЛИ БЕЛОК В МЯСНОМ СОКЕ?
Это можно проверить, если попросить у мамы немного мясного сока от сырого мяса и попробовать нагреть его в пробирке, причем нагреть нужно только верхнюю часть пробирки. Сильное помутнение показывает, что мясной сок содержит белок. Мясо почти полностью состоит из белка.108. ИССЛЕДУЕМ ПЕРЬЯ И ВОЛОСЫ

Из яиц курица выводит цыплят. В тканях живого цыпленка так же, как и в яйце, из которого он вылупился, содержится много белка. Если подержать на огне птичье перо или наш волос, мы почувствуем знакомый запах жженого рога. Это говорит о том, что перо и волосы содержат белок.
109. НОГОТЬ С ПАЛЬЦА И ЛОШАДИНОЕ КОПЫТО
Подержим кусочек срезанного ногтя в огне и потом понюхаем его. Ноготь состоит из рогового вещества, в котором содержится один из видов белка. Из этого же вещества состоит и копыто лошади.110. КАК РАЗЛИЧИТЬ ШЕРСТЬ И ХЛОПОК?
 |
 |
Шерсть получают из волосяного покрова овец, коз и т.п. Значит, шерсть так же. как волосы, содержит белок. Хлопок же получают из растений, и если мы подожжем хлопок, то почувствуем совершенно иной запах — запах сожженной бумаги. Испытаем кусочек какой-нибудь ткани. Сделать это очень просто — нужно выдернуть несколько ниток и сжечь. Таким образом, по запаху легко узнать, шерстяная это или хлопчатобумажная ткань.
111. КАК ЕЩЕ МОЖНО ОТЛИЧИТЬ ШЕРСТЯНУЮ ТКАНЬ ОТ ХЛОПЧАТОБУМАЖНОЙ
Поместим в пробирку с раствором гидроокиси натрия (едкого натра) кусочек шерстяной ткани и будем осторожно нагревать раствор. Через некоторое время мы увидим, что ткань растворилась. Если проделать такой же опыт с хлопчатобумажной тканью — это не произойдет.
112. НАТУРАЛЬНЫЙ ШЕЛК ИЛИ ИСКУССТВЕННЫЙ ШЕЛК?
Натуральный шелк ткут из шелковых нитей, которые разматывают из коконов шелковичных гусениц; так как шелковые нити — животного происхождения, то они содержат белок. Искусственный шелк получают из древесины, как бумагу. Поэтому при сжигании искусственный шелк пахнет горелок бумагой, а настоящий шелк пахнет, как жженый белок. Чтобы отличить настоящий шелк от искусственного, нет необходимости сжигать кусочек ткани, достаточно выдернуть из ткани нитку и ее испытать.113. ПОЛУЧЕНИЕ ИСКУССТВЕННОГО ШЕЛКА

Для получения искусственного шелка нам понадобится так называемый реактив Швейцера, который можно приготовить следующим образом. Небольшой кусок медного провода или проволоки из набора свернем в клубок и положим на дно воронки с фильтром, вставленной в пробирку. Нальем в воронку нашатырного спирта, и через фильтр в пробирку потечет жидкость голубго цвета. Воронку вставим в чистую пробирку, а голубую жидкость из пробирки снова нальем в воронку. Так повторяем эту операцию до тех пор, пока не получим жидкость темно-синего цвета. Это и есть реактив Швейцера. Теперь бросим в полученный реактив кусочек ваты и помешаем раствор стеклянной палочкой. Вата растворится, т.к. реактив Швейцера обладает способностью растворять целлюлозу, из которой состоит хлопок. Теперь в раствор целлюлозы капнем соляную кислоту, и на дне пробирки появятся белые бесформенные хлопья. Это вещество — один из видов искусственного шелка.

О МОЛОКЕ
114. В СОСТАВ МОЛОКА ВХОДИТ БЕЛОК

Если молоко закипает, убегает через край и пригорает, то при этом сразу же распространяется характерный для жженого белка запах. Следовательно, в молоке тоже есть белок. Такой запах можно воспроизвести, если несколько капель молока нагреть на жестяной крышке.
115. ЕСТЬ ЛИ В МОЛОКЕ КИСЛОТА?

Если оставить молоко на ночь в теплом месте, оно может скиснуть. Тогда утром вместо молока можно увидеть жидкую белую массу с белым хлопьевидным осадком и отстоявшейся водой (молочная вода или сыворотка). Если с помощью стеклянной трубки или пипетки отобрать несколько капель жидкости и попробовать на язык, то обнаружим, что сыворотка на вкус кислая. Нейтральная или синяя лакмусовая бумага ею окрашивается в красный цвет. Это говорит о том, что в молоке есть кислота. Это молочная кислота. Она образуется благодаря деятельности маленьких живых организмов — молочнокислых бактерий.
Если накануне прокипятить молоко, т.с. уничтожить микроорганизмы, то молоко может сохраняться до утра свежим. Молоко хорошо сохраняется в холодильнике, так как на холоде бактерии не вызывают процесса скисания.
116. КАК ЛУЧШЕ ПРЕДОХРАНИТЬ МОЛОКО ОТ СКИСАНИЯ?
Мы знаем, что лакмусовая бумага в состоянии обнаружить самые незначительные количества кислоты. Нальем молоко в три пробирки и испытаем его через несколько часов лакмусом (рис.). Для проведения опыта молоко в первой пробирке оставим стоять до скисания. Во вторую пробирку добавим для разрушения молочной кислоты немного порошка натрия углекислого кислого (питьевой соды) и будем наблюдать, насколько сода задержит процесс скисания молока. В третьей пробирке молоко предварительно прокипятим. Через несколько часов молоко сохранилось свежим. Следовательно, едва станут заметны первые следы присутствия молочной кислоты, кипячением можно приостановить процесс скисания.
117. МАСЛО И СЛИВКИ
Молоко состоит из легких сливок и более тяжелого снятого молока. Более легкие сливки (жир) находятся на поверхности молока. Осторожно, маленькой ложечкой отберем сливки с отстоявшегося молока и перенесем их в другую пробирку или чашку. Часть снятых сливок можно взбить ложечкой, как это делает мама.118. ВЗБИТЫЕ СЛИВКИ
При взбивании сливки смешиваются с пузырьками воздуха и образуют пышную пену. Поэтому, когда мы едим взбитые сливки, мы в основном «едим воздух».
119. ПОЛУЧАЕМ МАСЛО!
Если мы захотим сделать масло из сливок, то придется долго и терпеливо встряхивать сливки (в течение хотя бы 1/2 часа) в пробирке, закрытой пробкой, пока не образуется масляный комочек).120. ИЗ КИСЛОГО МОЛОКА ПРИГОТОВИМ ТВОРОГ

Мы уже знаем, что молоко, благодаря деятельности молочных бактерий, становится кислым. Можно ускорить этот процесс. Молоко в чашке немного подогреваем так, чтобы оно стало только чуть теплым, и добавляем в него уксус. Молоко тотчас же свертывается, образуя большие хлопья, и отслаивается сыворотка, которую нужно отфильтровать не через фильтровальную бумагу, а через марлю или льняную ткань. Ткань кладем сверху на стакан и, придерживая ее, выливаем на фильтр содержимое чашки. Если потом соединить концы ткани, приподнять над стаканом и отжать, то на фильтре останется густая масса — творог.

121. МЫ ДЕЛАЕМ СЫРОК
Полученную в предыдущем опыте творожную массу можно спрессовать в круглой чашечке и высушить. Получим маленький сырок, который следовало бы предварительно подсолить, а после сушки еще и выдержать, чтобы он стал вкуснее.
122. ЕСТЬ ЛИ БЕЛОК В СЫРЕ?
Долго лежащий сыр приобретает неприятный запах. Возьмем кусочек сыра на проволоку и подержим на огне до обугливания.Если потом понюхать его. то обнаружим тоже резкий запах, но другого характера, а именно — так пахнет белок, содержащийся в сыре. Сыр состоит почти полностью из белка, который называется: казеин.
Существует еще казеиновый клей, который состоит тоже из казеина и которым обычно склеивают деревянные предметы.
123. ИССЛЕДУЕМ СЫВОРОТКУ ОТ КИСЛОГО МОЛОКА
Полученную при изготовлении творога сыворотку профильтруем еще раз через бумажный фильтр и нагреем ее почти до кипения (но, как и в предыдущем опыте с белком яйца, нагреваем только верхнюю часть жидкости в пробирке). Наблюдаем помутнение. Это значит, что в молоке тот же вид белка, что и в яйце. Ученые называют его альбумином.
Белок творога (сыра) — казеин, в сравнении с белком яйца при нагрева нии не свертывается, но он свертывается при воздействии слабых кислот. Это мы уже наблюдали в опыте с молоком. Итак, в молоке содержится два вида белка: казеин и альбумин.
124. МОЛОКО СОДЕРЖИТ САХАР
Возьмем для опыта сыворотку, полученную при отделении творога и дополнительно отфильтрованную. В этой светлой жидкости содержится молочный сахар, который можно обнаружить нагреванием нескольких капель сыворотки с раствором гидроокиси натрия (едкого натра) и сернокислой меди (медного купороса). Великолепная красная окраска доказывает, что в молочной воде содержится некоторое количество ценнейшего сахара. Это особый вид сахара — молочный сахар или лактоза. Помни о правилах безопасности при работе с раствором едкого натра!
125. ПОЛУЧАЕМ СЛИВОЧНУЮ ПОМАДКУ
Наполним фарфоровую чашку наполовину молоком и растворим три куска сахара. Затем прокипятим молоко при постоянном энергичном помешивании, снимая ненадолго чашку щипцами с огня каждый раз, когда масса готова перелиться через край.Содержащийся в молоке молочный сахар варится вместе с растворенным сахаром. Прекратив нагрев, выльем густую массу на лист бумаги или на тарелку и разделим на маленькие плитки. Когда она охладится, попробуй, какие получились вкусные сливочные конфеты — сливочная помадка!
О СПИРТЕ

Среди огромного количества так называемых органических веществ выделяют большую группу соединений, которые называются спиртами. Среди них известные тебе вещества: винный спирт (химики называют его этиловый спирт), который содержится в вине, водке, одеколоне, духах, лекарствах (например, в настойке календулы и др.), глицерин, фенол, который также называют «карболовая кислота» и многие другие вещества. С ними ты познакомишься, когда будешь изучать химию в старших классах. С помощью нашего набора ты сможешь познакомиться лишь с некоторыми свойствами спиртов на примере этилового (винного) спирта. Так как в нашем наборе нет спирта, то попроси у мамы немного одеколона или водки.
126. НАГРЕВАЕМ СЕРНОКИСЛУЮ МЕДЬ (МЕДНЫЙ КУПОРОС)
Поместим в пробирку немного медного купороса (химики называют его сульфатом меди) и нагреем на спиртовке. Мы увидим, как на стенке стеклянной пробирки осаждаются мелкие капли воды, а порошок изменяет свою окраску и становится серовато-белым. Накапаем несколько капель воды на порошок после охлаждения, и он снова приобретает синюю окраску.Следовательно, кристаллы медного купороса, содержащие воду, имеют синюю окраску.

Медный купорос (сульфат меди пятиводный CuSO4·5H2O) |

Сульфат меди безводный |
 Безводный сульфат меди изменят окраску под действием воды |
После этого важного предварительного опыта мы будем исследовать спирт.
127. В ОДЕКОЛОНЕ СОДЕРЖИТСЯ НЕ ТОЛЬКО СПИРТ

Если в пробирку с одеколоном добавить несколько сероватобелых кристалликов обезвоженного медного купороса, они тотчас окрашиваются в голубой цвет, значит в одеколоне содержится вода.
128. КАК ОПРЕДЕЛИТЬ ЭТИЛОВЫЙ СПИРТ
Нальем в пробирку 1 мл йодной настойки (которая продается в аптеке и представляет собой спиртовый раствор йода) и прильем к ней раствор гидроксида натрия до обесцвечивания раствора. Жидкости в пробирке перемешаем и слегка подогреем на спиртовке. Выпадет бледно-желтый осадок. Это кристаллы вещества, которое называется йодоформ. С помощью этой реакции можно определить этиловый спирт.О ДРОЖЖЕВЫХ ГРИБКАХ

Дрожжи
Дрожжи под микроскопом
129. КАК ДРОЖЖЕВЫЕ ГРИБКИ ВЕДУТ СЕБЯ НА ХОЛОДЕ?
Дрожжевые грибки активно работают, если они находятся в тепле. Интересно проверить, как будут они вести себя на холоде. С разрешения мамы поставим две пробирки с раствором меда и дрожжевыми грибками на день в холодильник. Мы увидим, что пена совсем не появляется, газ не выделяется и спирт не образуется. Медовая вода длительное время остается сладкой. При низкой температуре грибки не работают, и брожение не происходит, поэтому и фруктовые соки следует хранить в холоде.130. НАГРЕВАНИЕ УБИВАЕТ ДРОЖЖЕВЫЕ ГРИБКИ
Можно подумать, что, чем больше тепла, тем лучше развиваются дрожжевые грибки. Это не так.Пробирку с медовой водой закроем пробкой с отводной трубкой и осторожно и недолго будем нагревать жидкость так. чтобы вода не вытекала через трубочку Если теперь пробирку с подогретой медовой водой поместить в стакан с теплой водой, пузырьки не будут выделяться. Работа грибков прекратилась. Живые организмы грибков не выдерживают нагревания.
Если пробирку из холодильника поместить в тепло, то в ней снова начнется брожение. Значит, холодом можно остановить работу грибков. Кипячение их убивает. Чтобы возобновить брожение, придется в медовую воду внести новые грибки.
131. КАК ПРЕДОХРАНИТЬ ФРУКТОВЫЙ СОК ОТ БРОЖЕНИЯ?
 |
 |
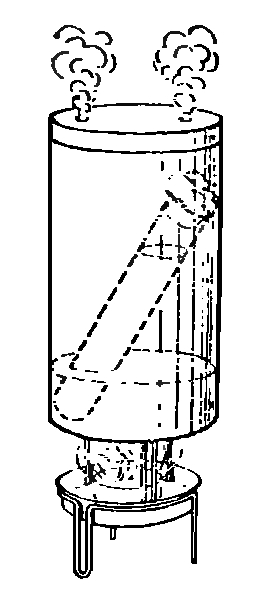
В открытой бутылке с фруктовым соком начинается брожение, так как туда попадают дрожжевые грибки из воздуха. Если даже пробирку со свежевыжатым соком закрыть обыкновенной пробкой, все равно сок со временем начнет бродить, потому что грибки есть уже на самих фруктах. Чтобы предотвратить брожение, нужно свежий сок прокипятить и плотно закрыть. Лучше сделать так, как показано выше на рисунке. Пробирку с соком закрыть ватной пробкой, поместить в жестяную банку с крышкой, содержащую небольшое количество воды. В крышке должны быть сделаны отверстия для выхода пара. Банку с водой нагреваем и выдерживаем пробирку на горячем пару 20 минут.
132. ТАЙНА СТЕРИЛИЗАЦИИ
Если фрукты портятся, значит, поселившиеся в них грибки вызывают брожение, гниение и разрушение. Если грибок убить получасовым нагреванием на паровой бане и предотвратить попадание грибка, плотно закрыв сосуд с фруктами крышкой, то фрукты можно потом хранить годами.
Этот метод так называемой стерилизации применяют ваши мамы при заготовлении консервированных компотов из свежей сливы, яблок, персиков и т.п.
Если мы, как описано в предыдущем опыте, простерилизуем в пробирке несколько вишен и затем оставим их стоять, плотно закрыв пробирку чистой пробкой, или даже оставим ее открытой, ягоды сохраняются гораздо дольше, чем другие, одновременно купленные, но не обработанные таким образом.
133. ГРИБКИ И БАКТЕРИИ ВОКРУГ НАС
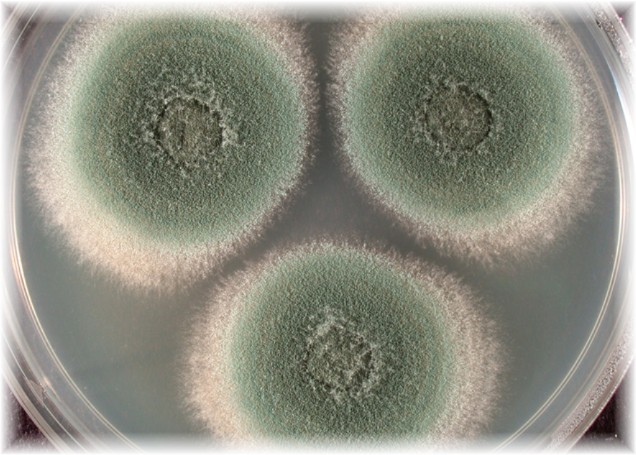
К сожалению, мы не можем видеть грибки невооруженным глазом, они видны только под микроскопом. Очень много всяких микроорганизмов находятся в воздухе, и, попадая на наши продукты, они портят их. Попробуем положить в чашку, в которой содержится 1 см по высоте воды, кусочек хлеба, вишню, кусочек лимона. Закроем чашку стеклом, а спустя неделю проверим, что получилось. Мы увидим, что разнообразно окрашенные зеленоватые, серые, белые плесневые грибки поселились на продуктах, образуя целые колонии, хорошо видные невооруженным глазом.Плесневые грибки, дрожжевые грибки и бактерии гниения присутствуют почти всюду.
 |
 |
О ХЛЕБЕ
134. «ЧЕРНЫЙ ХЛЕБ» ИЗ БЕЛОГО ХЛЕБА
Пробирку из набора, содержащую разбавленную настойку йода, закроем пробкой с изогнутой трубкой и накапаем слабый раствор йода на маленький кусочек белого хлеба. Он мгновенно станет черным. Кусочек белого хлеба превратился в «черный хлеб», но только есть его уже нельзя.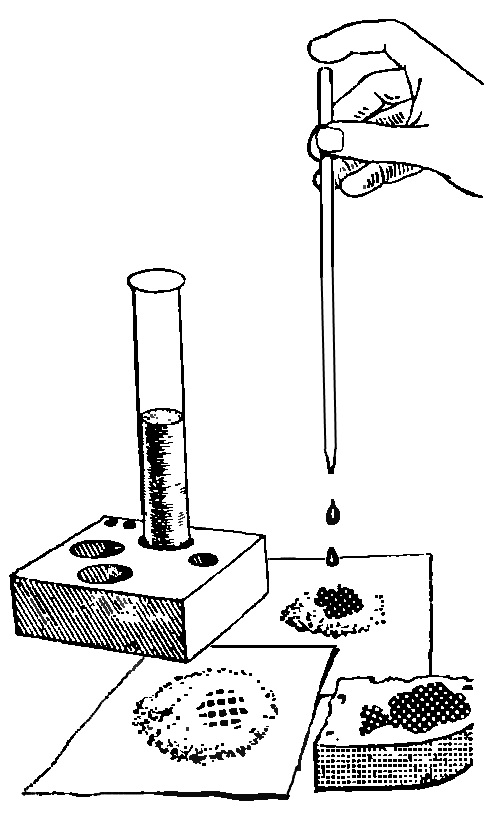
135. ХЛЕБ СОДЕРЖИТ КРАХМАЛ
Для опыта нужны: немного крахмала, который попроси у мамы, и мел. Если мел растереть, то мы увидим, что крахмал и мел похожи друг на друга.Но, если накапать на тот и другой несколько капель раствора йода, то мел окрасится в коричневый цвет, а крахмал становится сине-черным. Сравнивая окраску крахмала с результатом предыдущего опыта, убедимся в наличии крахмала в хлебе.
136. МУКА СОДЕРЖИТ КРАХМАЛ
Хлеб пекут из муки, поэтому крахмал должен содержаться и в муке. Проведем испытание с настойкой йода на маленькой кучке муки, и синее окрашивание укажет нам на присутствие крахмала в муке.137. КРАХМАЛ В КАРТОФЕЛЕ

Если разрезать сырую картофелину и капнуть на срез йодом, появится синее окрашивание. Следовательно, в картофеле тоже есть крахмал.
138. КРАХМАЛ ЕСТЬ ВО МНОГИХ ПРОДУКТАХ
Исследуем с помощью настойки йода разные продукты, например: горох, фасоль, разрезанные зерна риса, банан, спелые и неспелые яблоки, колбасу. Мы обнаружим, что во всех этих продуктах содержится крахмал. Мясо не содержит крахмала.
139. СЕКРЕТ ПУДРЫ

Попроси у мамы щепотку пудры и капни на нее настойкой йода, происходит очень интенсивное синее окрашивание. Значит, пудра содержит крахмал. Если опыт не получился, значит, этот вид пудры не содержит крахмал.
140. КРАХМАЛЬНЫЙ КЛЕЙСТЕР
Размешаем крахмал в чашке с водой и нагреем, получится слизистая масса, называемая клейстером. Мы можем использовать это клейстер в качестве клея для бумаги. Можно проверить, сохранился ли в клейстере крахмал. Проба с йодом дает синее окрашивание, т.е. в клейстере сохранился крахмал.141. СТОЛЯРНЫЙ КЛЕЙ
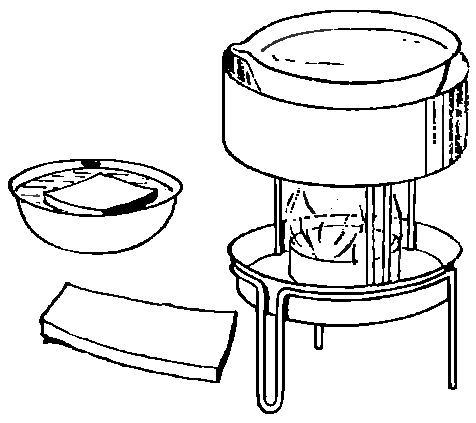
Постарайся дома найти кусок столярного клея, который представляет собой темнокоричневые плитки. Кусочек клея надо оставить стоять на ночь в фарфоровой чашке с водой. За ночь он сильно набухнет. Набухший клей сварим в чашке, но не надо ставить чашку непосредственно на огонь, так как клей может подгореть. Надо поставить на огонь жестяную банку больших размеров, чем наша чашка. Банку заполним наполовину водой и поставим в воду чашку с клеем. В такой кипящей водяной бане клей спокойно варится. Этим клеем можно клеить бумагу, картон, дерево.
142. КЛЕЙ ИЗ КОСТЕЙ
Такой клей можно получить вывариванием костей, точнее хрящей, при этом образуется навар в виде густой массы. Если этот навар слить и остудить, получится светлый клей.143. КЛЕЙ В КАЧЕСТВЕ ПИЩИ ДЛЯ БАКТЕРИЙ
Если сваренному костяному клею дать застыть тонким слоем в чашке, накрыть чашку стеклянной пластинкой и оставить стоять на несколько дней, то мы заметим, что на поверхности клея появляются «точки», которые увеличиваются в размерах. Это скопление бактерий. Клей — хорошая пища для бактерий. Бактерии, попавшие на клей из воздуха, поедают его и размножаются.С помощью микроскопа можно увидеть, что каждая точка, которая видна невооруженным глазом, представляет собой большое скопление бактерий.
144. ПЛЕСНЕВЫЙ ГРИБ
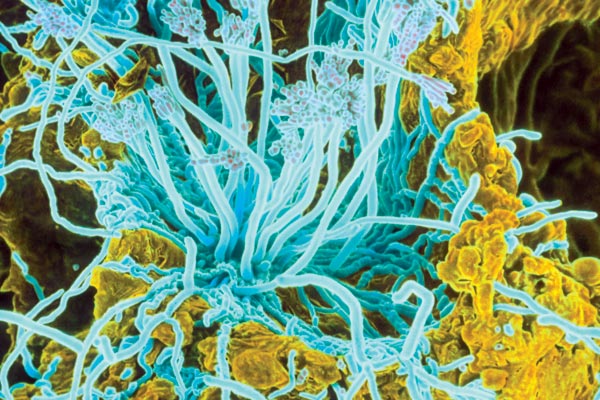
Отсыревший хлеб служит хорошей пищей для плесневого грибка, находящегося в воздухе. Если мы намочим кусочек хлеба и будем хранить его неделю в сосуде, закрытым стеклом, то хлеб покроется зеленым и белым «лесом» плесени.
145. ЖЕЛАТИН
В домашнем хозяйстве, например, при изготовлении фруктового желе или заливного, твоя мама использует пищевой желатин, состоящий из белка — желатины. Это тоже клей. Можно самим попробовать сварить клей на водяной бане из пищевого желатина. Его можно применять в качестве клея для бумаги.146. САМОДЕЛЬНЫЙ КСЕРОКС
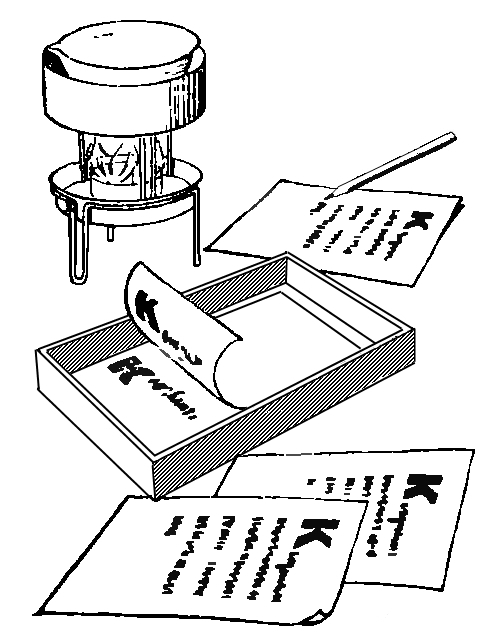 |
 |
Сваренный желатиновый клей смешаем с глицерином. Выльем смесь в низкую коробочку или противень и дадим клею застыть. Добавленный глицерин действует как смазка, поэтому поверхность клея не подсыхает, а остается влажной. На чистом листе бумаги напишем несколько предложений и положим лист исписанной бумаги на застывшую поверхность клея и оставим его лежать несколько минут. Осторожно сняв лист, мы увидим, что текст перешел на влажную поверхность клея. Если положить теперь на клейкую поверхность чистый лист бумаги, то текст отпечатается с поверхности клея на чистый лист. Таким образом можно размножить написанное в нескольких экземплярах.
ЖЕЛЕЗО
147. О РЖАВЧИНЕ
 |
 |
На смоченную картонную полосу равномерно насыпем порошок железа и поместим полоску в пустую пробирку. Затем пробирку поставим в чашку с водой в наклонном положении. Через несколько дней железо покроется ржавчиной. Железо постепенно ржавеет в соприкосновении с воздухом и водой. Чтобы предохранить железо от ржавчины, его можно смазать жиром. Окраска, никелирование или лужение тоже защищают железо от ржавчины.
148. РАСТВОРЯЕМ ИГЛЫ И СТАЛЬНЫЕ ПЕРЬЯ
Несколько игл или писчих перьев поместим в пробирку с соляной кислотой и немного нагреем. Сначала выделяется газ, затем выделение газа прекратится даже при повторном нагреве. Это значит, что некоторое количество кислоты израсходовалось, так как часть железа растворилась в ней, образовав зеленоватый раствор хлорида железа (II). Сольем раствор с остатка в другую пробирку и отфильтруем. На фильтре остаются частички угля, которые попадают в железо при выплавке в доменной печи.
149. ЖЕЛЕЗНЫЙ ПОРОШОК ВЫТЕСНЯЕТ ИЗ КИСЛОТЫ ВОДОРОД
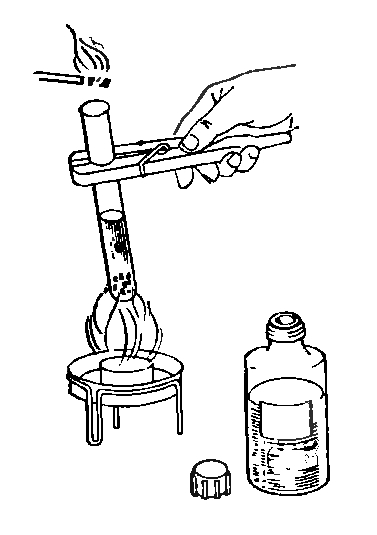
Поместим на дно пробирки немного железного порошка, прильем раствор соляной кислоты и осторожно подогреем, направив отверстие пробирки от лица. Постепенно раствор окрашивается в зеленый цвет, и в нем видны пузырьки выделяющегося газа. Поднесем к отверстию пробирки зажженную личину. Если раздается легкий хлопок — это признак того, что в пробирке — «чистый» водород. Если звук будет свистящим, значит, в пробирке частично остался воздух (водород не весь его вытеснил) и в смеси с водородом при поджигании он издает свистящий звук.
А в больших количествах такая смесь взрывоопасна!
150. ЖЕЛТОЕ ПЛЮС ЗЕЛЕНОЕ — ПОЛУЧАЕТСЯ СИНЕЕ

Красная кровяная соль K3[Fe(CN)6]
Возьмем из нашего набора несколько кристалликов калия железосинеродистого (красной кровяной соли), химики называют это вещество гексацианоферрат (III) калия. Растворим их в воде. Если слить в одну пробирку 1 см по высоте желтого раствора кровяной соли и столько же желтоватозеленого раствора хлорида железа (II), полученного в предыдущем опыте, появится характерное темно-синее окрашивание.
151. ПОЛУЧЕНИЕ ЯРКО-СИНЕЙ ЛАЗУРИ ИЗ СОЕДИНЕНИЯ ЖЕЛЕЗА
Возьмем немного зеленоватого раствора хлорида железа (II) и оставим его в пробирке открытым на 2 дня. Раствор постепенно становится бурым. Хлорид железа (II) под действием кислорода воздуха превращается в другое вещество — хлорид железа (III). Если к полученному раствору добавить немного (1 мл) раствора калия железистосинеродистого (желтой кровяной соли), химики называют это вещество гексацианоферрат (II) калия, то появляется ярко-синее окрашивание. Полученное ярко-синее вещество называют «берлинской лазурью».
Раствор хлорида железа (II) - слева и хлорида железа (III) - справа |
 "Берлинская лазурь" |
152. КАК ОБНАРУЖИТЬ ЖЕЛЕЗО?
Опыт (пробу) с калием железосинеродистым (красной кровяной солью) проводят всегда, когда хотят убедиться в наличии железа (II).Знак (II) означает, что железо находится в данном соединении в виде химического элемента и имеет так называемую степень окисления 2+.
Существует соединение железа со степенью окисления его 3+. Например, хлорид железа (III). Его химическая формула FeCl3 а химическая формула хлорида железа (II) — FeCl2.
Реакция хлорида железа (II) с красной кровяной солью называется качественной реакцией, с помощью которой можно определить наличие железа в виде химического элемента со степенью окисления 2+ в том или ином соединении. А качественной реакцией на соединение железа со степенью окисления 3+ является реакция с калием железистосинеродистым (желтой кровяной солью). Но эти качественные реакции не являются единственными.
При помощи качественной реакции анализируются земные породы при поиске железной руды. Мы можем и сами провести такое испытание, если раздобудем кусочек горной породы или какой-нибудь камешек с прожилками, похожими на ржавчину. Надо растворить немного породы в соляной кислоте и добавить к раствору желтую кровяную соль. Если раствор окрасится в синий цвет, значит в породе содержится железо.
 Желтая и красная кровяная соль - это цианидные комплексы, соответственно Fe2+ и Fe3+. Их растворы в воде - желтые. При взаимодействии K4[Fe(CN)6] с солями Fe3+ и K3[Fe(CN)6] с солями Fe2+ образуется синие вещество KFe[Fe(CN)6], известное как турнбулева синь, которое использовали в качестве красителя еще в 18 веке. |
153. УДИВИТЕЛЬНЫЕ СТАЛАГМИТЫ И ДИКОВИННЫЕ РАСТЕНИЯ
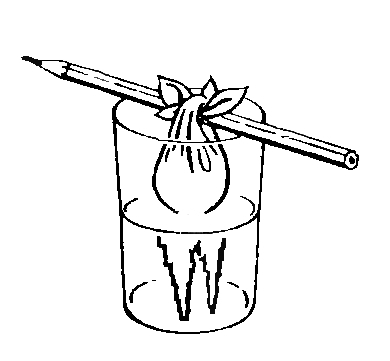
Нальем в стакан или пробирку раствора калия железистосинеродистого (желтой кровяной соли, гексацианоферрата (II) калия) и в небольшую тряпочку положим немного сернокислой меди (медного купороса), завяжем и укрепим ее так, чтобы она только касалась раствора. Спустя некоторое время мы увидим, как из узелка начнут расти красно-коричневые нити. У нас в стакане растут сталагмиты, как в пещерах. Только там сталагмиты имеют совсем иной состав и состоят из известняка. Если положить на дно стакана кусочек медного купороса, то через некоторое время медный купорос в растворе гексацианоферрата(II) калия калия как бы обрастает «мхом».
 |
 Хлорид железа (III) FeCl3 в растворе желтой кровяной соли K4[Fe(CN)6] |
 |
 Кристаллы сульфата меди CuSO4 в растворе желтой кровяной соли K4[Fe(CN)6] |
154. ЖЕЛЕЗО В КРОВИ
Если мама принесет домой кусок парного мяса, ты можешь попросить ее выдавить из него немного крови в фарфоровую чашку. До испытания на содержание железа кровь следует сначала высушить в чашке.Затем надо растворить кровь в соляной кислоте, отфильтровать раствор и испытать калием железосинеродистым (красной кровяной солью). Испытание покажет, что в крови присутствует железо в виде химического элемента со степенью окисления 2+.
Эритроциты - красные клекти крови, придающие ей цвет и содержащие железо
155. «ЖЕЛЕЗНЫЕ» ЛИСТЬЯ
Возьмем зеленый лист какого-нибудь растения, высушим его в чашке над спиртовкой и зажжем. Когда лист сгорит, измельчим в порошок образовавшийся пепел и растворим его в соляной кислоте. Затем отфильтруем этот раствор и добавим в фильтрат несколько капель раствора калия железистосинеродистого (желтой кровяной соли). Раствор окрашивается в синий цвет, значит, в зеленых листьях растений содержится железо.
156. САЛАТ И ШПИНАТ СОДЕРЖАТ ЖЕЛЕЗО
Утверждают, что в салате и шпинате содержится много железа, и мы сами можем убедиться в этом.Для этого листья салата и шпината надо подсушить на солнышке или над горячей плитой, а потом сжечь в фарфоровой чашке до пепла. Пепел в чашке нужно растереть, растворить в соляной кислоте и раствор отфильтровать. Синее окрашивание при добавлении к этому раствору калия железистосинеродистого (желтой кровяной соли) доказывает наличие железа в листьях.
157. МЫ ДЕЛАЕМ ЧЕРНИЛА

Растворим в пробирке, наполовину наполненной водой, немного танина из нашего набора. Добавим к танину раствор, содержащий железо (ранее приготовленный из игл или перьев раствор хлорида железа (II)). Раствор окрашивается в черно-синий чернильный цвет.
158. ФРУКТЫ СОДЕРЖАТ ТАНИН
Если к раствору соединения, содержащего железо со степенью окисления 2+ (например, раствор хлорида железа (II)) добавить немного фруктового сока, то происходит такое же окрашивание, как и в предыдущем опыте с танином.Значит, фруктовый сок содержит танин.
159. В ЧАЕ ТОЖЕ ЕСТЬ ТАНИН
Если настой чая смешать с раствором соединения железа, чай становится темным, как чернила, а это подтверждает, что в чае тоже есть танин.160. «ЗАШИФРОВАННОЕ» ПИСЬМО
Ты можешь написать своему товарищу небольшое письмо или записку слабым раствором хлорида железа (II), и текст записки не будет виден. Ты запомни его и передай на словах товарищу то, что ты ему написал. Потом дай ему раствор калия железосинеродистого (красной кровяной соли) и предложи «расшифровать» письмо, смочив лист этим раствором. Он сам тебе расскажет о том, что обнаружил на листе именно то, что ты передал ему на словах. Текст письма проявляется, благодаря реакции раствора, содержащего железо, которым написана записка с красной кровяной солью. |
 |
161. ПОРОШОК или ЖИДКОСТЬ
В нашем наборе есть сера — это порошок желтого цвета. Но если серу нагреть в чашке, то она расплавится и по внешнему виду будет представлять собой светлую желтоватую жидкость. Будем продолжать осторожно нагревать, жидкость начнет темнеть и густеть. Если теперь серу охладить, а потом снова нагреть, она станет липкой и эластичной как каучук или пластилин, и мы сможем в этом убедиться, если выльем горячую серу в банку с водой. Так порошкообразную серу можно превратить в темную вязкую жидкость. А если такую жидкость подержать некоторое время на воздухе, то она снова станет твердой и хрупкой.ЕЩЕ НЕСКОЛЬКО ИНТЕРЕСНЫХ ОПЫТОВ
162. МЫ ПОЛУЧАЕМ ПОВАРЕННУЮ СОЛЬ
Трудно представить, что поваренную соль, которую мы употребляем в пище, можно получить из гидроокиси натрия (едкого натра) и соляной кислоты. Но представим себе, что именно эти два опасных вещества образуют при взаимодействии друг с другом вещество совсем безвредное, которое в домашнем обиходе называют просто солью.Попробуем сами приготовить поваренную соль.
Нальем в пробирку по высоте 2 см соляной кислоты, перельем это количество в чашку, положим в чашку нейтральную лакмусовую бумажку и, перемешивая жидкость стеклянной палочкой, будем вливать (осторожно!) из флакона раствор едкого натра до тех пор, пока лакмусовая бумажка не станет фиолетовой.
Потом уберем лакмусовую бумажку из раствора и поставим чашку на день на подоконник. В чашке образуется небольшое количество маленьких кристалликов в форме кубиков. Это не что иное, как поваренная соль.
 |
 |
163. ЕЩЕ ОДИН СПОСОБ ПРИГОТОВЛЕНИЯ ПОВАРЕННОЙ СОЛИ
Возьмем немного натрия углекислого кислого (питьевой соды), растворим в пробирке, до половины заполненной водой. Добавим к раствору соды с помощью стеклянной пипетки одну каплю соляной кислоты. Жидкость некоторое время пенится. Когда пена спадает, капнем еще раз кислоты. Вспенивание начинается снова.Если таким образом продолжать добавлять кислоту по каплям, то вспенивание постепенно прекратится. Это свидетельствует о том, что вся сода разложилась. Поставим чашку на день на подоконник. Когда вода испарится, на дне чашки увидим знакомые кубики. Это поваренная соль. Так можно из соды приготовить поваренную соль.
 |
 |
164. ИЗГОТАВЛИВАЕМ МЫЛО

Для этого нагреем в чашке кусочек соды с водой и накапаем туда несколько капель стеарина с горящей свечи. Перемешаем все стеклянной палочкой. Вскоре жидкость вспенится, это образовалось мыло. Мыло делают из жира и щелочи. Мы уже знаем, что сода в водном растворе дает щелочную среду, свеча состоит из стеариновой кислоты, а стеарин получают из жира. Вот мы и сварили мыло из жира и щелочи. Что же собой представляет мыло? Мы получили мыло из соды и стеариновой кислоты. Поэтому мыло химики называют стеариновокислый натрий или стеарат натрия.
165. ЕЩЕ ОДИН СПОСОБ ИЗГОТОВЛЕНИЯ МЫЛА
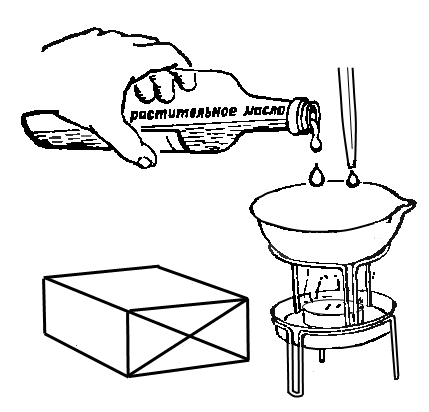
Нальем в чашку растительного масла, насыпем немного соды и нагреем смесь на спиртовке так, чтобы масло закипело. Продолжая нагрев, понемногу добавляем еще соды. Примерно через час (в течение нескольких минут) приливаем к смеси по каплям сильно соленую воду.
Поверхность жидкости покроется пышными хлопьями мыла. Отфильтруем раствор через какую-нибудь ткань и получим мыло.
166. ИССЛЕДУЕМ МЫЛО, ДРЕВЕСНУЮ ЗОЛУ И СТИРАЛЬНЫЙ ПОРОШОК
В растворы этих веществ опусти фенолфталеиновые бумажки и встряхни несколько раз пробирки. Ты сразу же замечаешь, что фенолфталеиновые бумажки окрасились в малиновый цвет. Как ты думаешь, почему? Значит, растворы этих веществ дают щелочную реакцию. Именно поэтому эти вещества обладают мылкостью и их используют как моющие средства. |
 |
167. ПОЧЕМУ МЫЛО МОЕТ?
Опыт 1.В пробирку с водой добавим 1—2 капли раствора фенолфталеина. Никакого изменения в окраске не произойдет. Теперь в эту же пробирку бросим кусочек мыла или мыльного порошка и хорошо размешаем раствор. Сразу же появляется малиновая окраска фенолфталеина, указывающая на присутствие щелочи. Щелочь обладает мылкостью и растворяет жиры. Но почему мыло отмывает и не жировую грязь, например, пыль, сажу и т.д. Грязь прилипает к тканям или к какой-либо поверхности и прочно удерживается, главным образом, благодаря взаимному притяжению пограничных молекул. Вода не способна разорвать эти силы. Мыло же уменьшает силы поверхностного натяжения, обволакивает частички пеной и отрывает их от поверхности. Проверим это на следующем опыте.

Опыт 2.
Возьмем стеклянную пластину и подержим ее над горящей свечой, чтобы она закоптилась. Приготовим фильтр и вложим его в воронку. После смачивания воронки водой копоть с пластины при помощи стеклянной палочки перенесем на фильтр и промоем чистой водой, подставив под воронку стакан.
Проходит ли копоть через фильтр? Нет, хотя известно, что частицы сажи меньше отверстий в фильтровальной бумаге. Они притягиваются к бумаге и межмолекулярными силами прочно на ней удерживаются.
А теперь промой сажу на фильтре мыльной водой. Через несколько минут ты заметишь, как мыльная вода, прошедшая через фильтр, начинает приобретать коричневую окраску, хотя отдельных частиц сажи в этой воде и не видно.
Что же произошло?
Благодаря мылу частицы сажи смочились водой, уменьшились межмолекулярные силы, и эти частицы оторвались от бумаги и прошли через ее поры.
Таким образом, мыло, обволакивая частицы, уносит их с поверхности предмета, т.е. моет.
168. О МОЮЩИХ СРЕДСТВАХ
В две пробирки нальем воды и растворим в одной из них немного мыла, в другой — детского шампуня.Встряхнем обе пробирки и добавим в них по 2—3 капли раствора фенолфталеина. В пробирке с мылом сразу же появляется малиновая окраска, указывающая на присутствие щелочи, а во второй пробирке никакого изменения в окраске не наблюдается.
Теперь понятно, почему хорошие моющие средства не раздражают кожу – они не содержат щелочи.
169. ИЗВЛЕЧЕНИЕ ПОТАША ИЗ ЗОЛЫ
Поташ имеет формулу К2СО3; химики называют его углекислый калий (карбонат калия). Это ценнейшее калийное удобрение, содержащееся в золе, способствует развитию подземных органов растений — корней, клубней, корневищ, луковиц растений.Люди еще в глубокой древности заметили, что на земле после лесных пожаров урожай намного выше, чем на обычной почве.
Вывод напрашивается сам собой — зола содержит какое-то вещество, необходимое растениям.
Проделаем следующий опыт.
Поместим в фарфоровую чашку немного золы (в объеме 2—3 спичечных головок), прибавим 5—6 капель воды и нагреем до кипения.
Дадим жидкости отстояться и перенесем в отдельности на стекло 2 капли прозрачного раствора.
Смочи первой каплей красную лакмусовую бумажку — она посинеет.
Раствор карбоната калия (поташа) также, как карбоната натрия (стиральной соды) и гидрокарбоната натрия (питьевой соды), имеет щелочную реакцию.
Около второй капли помести каплю соляной кислоты, осторожно соедини капли и наблюдай выделение углекислого газа. Происходит реакция:
Следовательно, в золе содержится углекислый калий — соль калия и угольной кислоты.
 Калий углекислый (поташ) K2CO3 |
 Лакмусовая бумага |
 Выделение углекислого газа в результате взаимодействия раствора углекислого калия и соляной кислоты |
170. ОКРАШИВАНИЕ ДЕРЕВА
Мы можем с помощью растворов калия железосинеродистого (красной кровяной соли) и хлорида железа (II) окрасить деревянную доску в красивый цвет (подобный процесс окрашивания дерева в технике называют протравливанием).Сначала нанесем на нее кисточкой раствор хлорида железа (II) (приготовленный из игл и перьев растворением в соляной кислоте). После легкого подсушивания окрашиваем доску тонким слоем раствора красной кровяной соли. Доска приобретает устойчивый синий цвет. Если еще натереть окрашенную поверхность воском, а затем суконкой, наша доска будет блестеть и выглядеть очень красиво.
Если обыкновенную еловую щепку или дощечку покрыть раствором калия марганцовокислого (перманганата калия), они приобретают красивый коричневый цвет орехового дерева. Покрашенную дощечку можно отполировать воском.
171. ЖЕЛЕЗО И МАГНИЙ

В наборе есть два вещества: железо и магний. Железо, мы знаем, это серый блестящий металл, из которого изготовлены многие инструменты и машины. Знаем также, что оно притягивается магнитом. Магний тоже вещество, обозначается Mg. Это легкий металл, который горит ослепительным белым пламенем (опыт 203).
172. ПОЛУЧЕНИЕ МЕДИ
Мы знаем медь по медной проволоке или медным сосудам как коричнево-красный металл Растворим в чашке с водой несколько кристалликов меди сернокислой (медного купороса, сульфата меди) и пропустим через раствор электрический ток от карманной батарейки (этот процесс в технике называют электролизом). Через некоторое время мы увидим на длинной пластинке батарейки осадок меди, которая выделилась из раствора. Можно и без пропускания тока выделить медь из раствора медного купороса. Простой железный гвоздь, опущенный в раствор, через несколько минут покрывается красным налетом меди.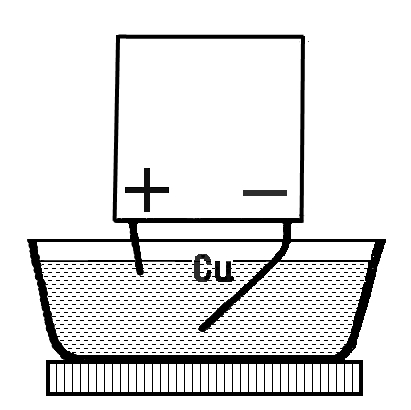 |
 |
КАК НАЗЫВАЮТСЯ СОЛИ?
173. ПОВАРЕННАЯ СОЛЬ
Соединения элементов с кислородом мы называем оксидами, а соединения элементов с хлором называют хлоридами.Поваренная соль, судя по желтой окраске пламени, содержит натрий, кроме того, она содержит хлор.
Поваренная соль: 2Na + Сl2 = 2NaСl — хлорид натрия или натрий хлористый.
174. ХЛОРИД МАГНИЯ И ХЛОРИД ЖЕЛЕЗА (II)
Если опустить кусочек магниевой ленты в пробирку с соляной кислотой, то мы вскоре заметим, что начинает выделяться газ. Выждем некоторое время, пока выделяющийся газ вытеснит из пробирки воздух, и поднесем к отверстию пробирки зажженную лучину. Газ сгорает с легким хлопком. Это водород.Этот процесс объясняется так: магний взаимодействует с соляной кислотой, вытесняя из нее водород, а оставшийся кислотный остаток соединяется с магнием, образуя соль — хлорид магния.
Мg + 2НСl = МgСl2 + Н2. Хлорид магния растворяется в воде. Чтобы в этом убедиться, нужно выпарить воду из раствора в фарфоровой чашке, поставив ее па огонь. Оставшийся белый порошок — хлорид магния.
А теперь вспомним опыт 148. Поясним происходящий процесс.
Железо (в виде порошка, стружки или гвоздя) опустим в пробирку с соляной кислотой и повторим операцию, как в случае с магниевой лентой (см. выше). Железо вытесняет из кислоты водород и присоединяет хлор, образуя хлорид железа (II) (железо хлористое):
Fe + 2НСl = FеСl2 + Н2. Если раствор, в котором растворяли железо, отфильтровать, получится прозрачная зеленоватая жидкость — раствор хлорида железа или хлористого железа.

Хлорид железа (II) тетрагидрат
175. ХЛОРИД КАЛЬЦИЯ ИЛИ КАЛЬЦИЙ ХЛОРИСТЫЙ
Как мы выяснили, мел — это СаСO3, а при обработке мела соляной кислотой выделяется СO2. Происходит реакция обмена:Угольная кислота, образовавшаяся в этой реакции, очень непрочная. Она сразу же разлагается на воду и углекислый газ. В растворе остается хлористый кальций. Попробуем выделить хлорид кальция из раствора. Для этого жидкость надо отфильтровать и затем выпарить. Хлорид кальция, выделенный таким образом из раствора, образует в чашке белую корку. Если оставить чашку стоять открытой, то через два дня мы увидим, что хлорид кальция увлажнился. Он поглощает влагу из воздуха, другими словами, он гигроскопичен. При нагревании или прокаливании воду из него можно удалить, но со временем хлорид кальция снова ее поглощает. Таким же свойством обладает и поваренная соль NaСl. Ты, очевидно, видел, как дома соль постепенно увлажняется.
 CaCO3 |
 CaCl2 |
176. ПОГЛОЩАЕТСЯ ЛИ ВЕЩЕСТВО ПРИ ГОРЕНИИ?
Мы уже знаем, что порошок железа может гореть. После сжигания порошка остается черно-серый пепел, называемый оксидом железа. Интересно, этот пепел тяжелее или легче металла?Конечно, тебе покажется, что легче!
Проверим это на опыте.
Накалим крышку консервной банки, охладим и насыпем на нее железного порошка и взвесим. Запишем точный вес. Теперь нагреем крышку вместе с содержимым, лучше на пламени газовой плиты. Ты увидишь, как порошок накаляется и постепенно образуется твердая черно-серая масса. Снова взвесим. Ты удивишься! Черно-серая масса, полученная после сжигания металла, весит больше самого металла!
При горении вес увеличился потому, что из воздуха поглотился кислород.
Если сжечь дерево, то получим золу намного легче весом, чем само дерево, потому, что с продуктами сгорания улетучивается углекислый газ.
ЖЕЛЕЗО СОЕДИНЯЕТСЯ С КИСЛОРОДОМ В ОКСИД ЖЕЛЕЗА
 Оксид железа (II) - FeO |

Железная руда - гематит Fe2O3 |

Железная руда - лимонит Fe2O3·nH2O |

Железная руда - магнетит Fe3O4 |

Железная руда - магнетит Fe3O4 |
177. ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ
Для опыта тебе необходимо сделать простую незамкнутую электрическую цепь из батарейки карманного фонаря, кусочков провода и лампочки 3,5 ватт, как это показано на рис.Затем опустим концы проводов в сухие вещества: поваренную соль, сернокислую медь (медный купорос), аммоний хлористый (хлорид аммония), сахар. Лампочка не горит. Теперь приготовь растворы этих веществ и дополнительно возьми растворы соляной кислоты и гидроокиси натрия (едкого натра).
Растворы поочередно наливай в фарфоровую чашку. (После проведения опыта с каждым раствором чашку тщательно вымой). И в каждый из них опускай концы провода. Ты увидишь интересное явление — лампочка загорится во всех растворах, кроме сахара.
Значит, электрическая цепь замыкается в этих растворах, а в растворе сахара нет. Следовательно, растворы поваренной соли, медного купороса, хлорида аммония, соляной кислоты, едкого натра электропроводны, а раствор сахара не проводит электрический ток.
Вещества, растворы которых проводят электрический ток, называются электролитами. Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Следовательно, поваренная соль, медный купорос, хлорид аммония, соляная кислота, едкий натр — электролиты. Поэтому их можно использовать в аккумуляторах. Сахар же является неэлектролитом.
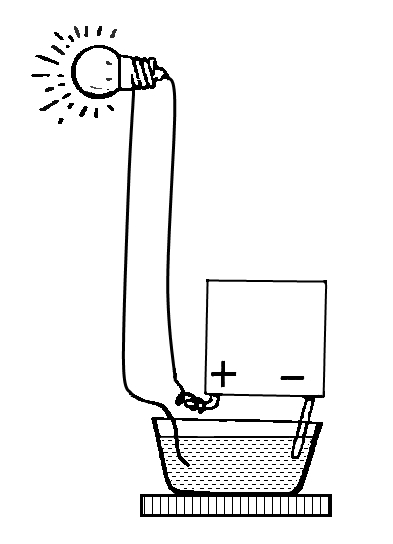 |
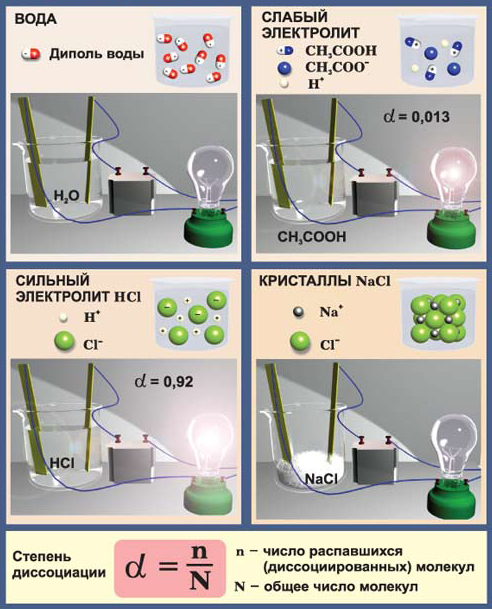 |
178. ЕЩЕ ОДИН ОПЫТ С ЭЛЕКТРОПРОВОДНОСТЬЮ РАСТВОРОВ
Возьмем фильтр из нашего набора, смочим его раствором поваренной соли и положим на стекло (рис.). По центру фильтра осторожно проложим белую нитку, смоченную в аммиачном растворе сернокислой меди (медного купороса), который готовится из равных частей растворов сернокислой меди (сульфата меди) и гидроксида аммония. Нитка окрашивается в интенсивно синий цвет. На равном расстоянии от нитки на фильтр положим электроды (гвозди), которые соединим один — с положительным, а другой — с отрицательным полюсом карманной батарейки. Пометим соответственно полюса и на фильтре простым карандашом.Через некоторое время увидим, что синяя полоска перемещается к тому концу бумажки, где стоит знак (—).
Следовательно, в аммиачном растворе медного купороса есть положительно заряженные частички, а значит, должны быть и отрицательно заряженные частички, т.к. вещество электронейтрально.
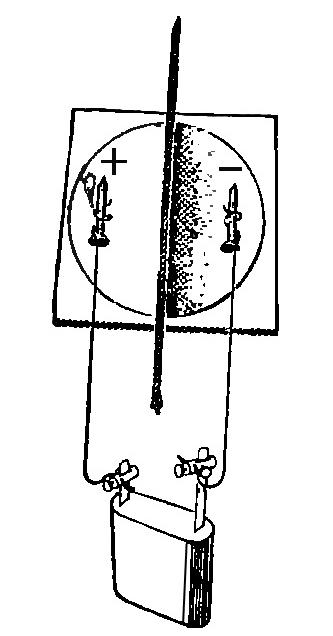 |
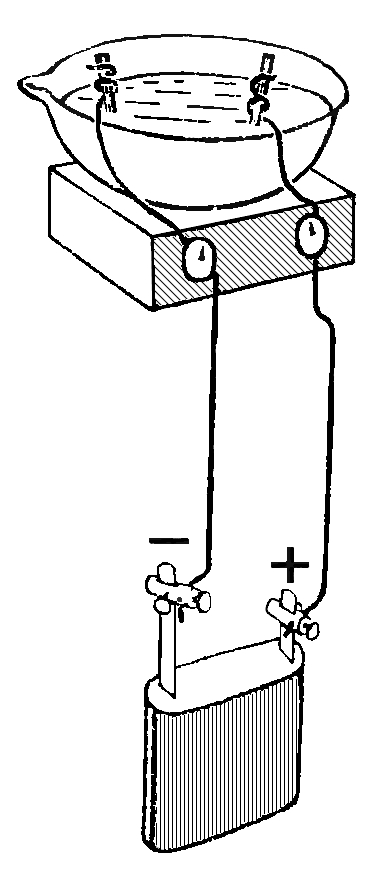 |
179. НАТРИЯ ГИДРООКИСЬ (ЕДКИЙ НАТР)
Едкий натр может быть получен при пропускании электрического тока через раствор поваренной соли. В воде растворяют такое количество поваренной соли, чтобы следующая порция больше не растворялась, и дно сосуда покрылось бы нерастворившимися кристаллами. Химики называют такой раствор насыщенным. В такой раствор опускают два графитовых стержня. Графитовые стержни можно взять из карандаша, желательно — мягкого, так как там стержни более крупного размера, или, как их называют специалисты, графитовые электроды и пропускают через них ток от карманной батарейки. Через некоторое время электроды покрываются пузырьками газов. На электроде, соединенном с отрицательным полюсом батарейки — водородом, а с положительным полюсом — хлором. Хлор обнаруживается по резкому неприятному запаху. Установка для электролиза |
 Установка для электролиза |
Хлор — ядовитый газ и в больших количествах опасен, а в незначительных количествах даже полезен. Он убивает болезнетворных бактерий.
В нашем опыте хлор выделяется в ничтожно малых количествах и опасности не представляет. В растворе образуется щелочь — едкий натр, который можно обнаружить с помощью фенолфталеина (малиновое окрашивание).
Едкий натр образовался в результате электролиза водного раствора поваренной соли. Хлор выделился из хлорида натрия, а водород из воды (растворителя). Эти процессы произошли под действием электрического тока.

Хлор - желтовато-зеленый газ с резким удушливым запахом amazingrust.com
180. БЕЛИЛЬНЫЙ РАСТВОР
Белильный раствор образуется при вышеописанном электролизе поваренной соли. Выделившийся на электроде свободный хлор соединяется с образовавшейся натриевой щелочью. Получается соединение NaOCI. Это и есть белильный раствор (средство "белизна") или, как называют его в химии, натрий хлорноватокислый (гипохлорит натрия). Лакмус в белильном растворе сначала становится синим, а потом бледнеет, как в токе хлора. NaOCI служит для отбеливания хлопка, бумаги и т.п.
181. ИЗ НАШАТЫРНОГО СПИРТА (РАСТВОРА АММИАКА) ВЫДЕЛЯЕТСЯ ДЕЙСТВУЮЩИЙ КАК ОСНОВАНИЕ ГАЗ - NH3
Этот газ окрашивает влажную лакмусовую бумажку в синий цвет, т.е. действует как основание, так как, соединяясь с водой, он образует гидроксид-ионы:Группа атомов NH4+ называется аммонийной группой или аммонием.
В результате соединения с водой, имеющей гидроксильную группу -ОН, аммиак превращается в основание, которое называют нашатырным спиртом. Раствор имеет сильный запах аммиака. Аммиак NH3 легко испаряется из нашатырного спирта.
182. ГИДРОКСИД КАЛЬЦИЯ
Гидроксид кальция получается при растворении в воде кальция гидроокиси (гашеной извести). Гашеная известь хуже растворяется в воде, чем едкий натр.
Гидрооксид кальция
Если смешать в пробирке или фарфоровой чашке немного гашеной извести с водой и опустить в полученную смесь нейтральную или красную лакмусовую бумажку, то она посинеет. Следовательно, гашеная известь — основание.
Если ты захочешь получить прозрачный раствор гидроксида кальция, отфильтруй полученную мутную жидкость и прозрачный фильтрат снова испытай нейтральной или красной лакмусовой бумажкой. Бумажка посинеет.
Прозрачный раствор — не что иное, как известная тебе известковая вода.
Следовательно, известковая вода — основание.
183. ОТ ГИДРОКСИДА МЕДИ ДО ОКСИДА МЕДИ
Если в раствор меди сернокислой (медного купороса) налить немного натриевой щелочи, образуется голубой студенистый осадок:
Cu(OH)2
Можно слить большую часть воды с осадка и нагреть его в пробирке, тогда из гидроксида меди выделяется вода в виде пара и остается СuО (оксид меди) в виде черного порошка.
184. УГЛЕРОД ОХОТНО СОЕДИНЯЕТСЯ С КИСЛОРОДОМ, ОТБИРАЯ ЕГО У МЕТАЛЛОВ
Для того, чтобы убедиться в том, нам необходимы: древесный уголь и оксид меди, который мы получили в предыдущем опыте. Смешаем оксид меди с тройным количеством древесного угля. Затем смесь насыпем в пробирку и сильно нагреем (рис.). Через некоторое время порошок изменит свой черный цвет на красноватый. Это образуется чистая медь. Всю реакцию можно записать следующим образом: Порошок Cu |

Оксид меди (II) CuO |
УСЛОВИЯ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
185. РЕАКЦИЯ СОЕДИНЕНИЯ
Вспомни опыт горения магния. Он горел ярким ослепительным пламенем. Металлический магний соединяется с кислородом воздуха, при этом образуется порошок белого цвета. Это оксид магния:
Горение магния в кислороде
В этой реакции из двух веществ образуется одно новое вещество.
Реакции, при которых из двух или нескольких веществ образуется одно новое, называются реакциями соединения.
186. РЕАКЦИЯ РАЗЛОЖЕНИЯ
Наверное, ты хорошо знаешь красивый уральский минерал малахит. Это изумрудно-зеленый, непрозрачный камень с темными прожилками. В состав этого камня входит вещество, которое названо основной углекислой медью или гидроксокарбонатом меди (II). |

Природный малахит - основный карбонат меди CuCO3·Cu(ОН)2 |

Синтетический малахит - основный карбонат меди CuCO3·Cu(ОН)2 |
В нашем наборе есть это вещество. Насыпь этого порошка в пробирку на 1/4 часть. Пробирку с помощью зажима для пробирок укрепи наклонно в штативе таким образом, чтобы дно было немного выше отверстия пробирки.
Пробирку закрой пробкой с газоотводной трубкой, конец которой опусти в пробирку с известковой водой (рис.). Нагрей пробирку.

Основная углекислая медь чернеет. Образуется порошок оксида меди. Известковая вода мутнеет, следовательно, выделяется углекислый газ. "На стенках пробирки конденсируется капельки воды. Значит, основная углекислая медь — вещество сложное и разлагается при нагревании на более простые вещества.
Когда прекратится выделение углекислого газа, газоотводную трубку надо вынуть из известковой воды и тогда только убрать спиртовку. Иначе воду может засосать в горячую пробирку и пробирка лопнет.
Реакции, при которых из одного вещества образуются два или несколько новых веществ, называются реакциями разложения.
187. ОТБЕЛИВАЮЩИЕ СВОЙСТВА ПЕРЕКИСИ ВОДОРОДА
Перекись водорода обладает отбеливающим свойством, т.е. способствует разрушению органических красителей. Убедиться в этом можно на следующем опыте.Возьмем немного черной шерсти (или волос), обезжирим ее путем обработки разбавленным раствором гидроокиси натрия (едкого натра). Промоем шерсть чистой водой и погрузим в пробирку с 3%-ным раствором перекиси водорода так, чтобы часть шерсти не была погружена в жидкость (из домашней аптечки мама даст тебе раствор перекиси). Через несколько часов цвет шерсти изменится. Произойдет обесцвечивание той части шерсти, которая погружена в перекись водорода.
Обесцвечивание шерсти объясняется окислительными свойствами перекиси водорода, очень непрочного соединения, которое на свету разлагается по уравнению реакции:
Атом кислорода является сильнейшим окислителем, он то и разрушает органические краски.
Это тоже пример реакции разложения.
188. РЕАКЦИЯ ЗАМЕЩЕНИЯ
В пробирку нальем кипяченую воду, растворим в ней немного медного купороса (сернокислой меди) и опустим в нее чистый железный гвоздь (шляпкой вниз). Через 8—10 минут посмотрим, какие произошли изменения и почему?. Гвоздь покрывается красным налетом — это медь, а вода остается без изменений.
Происходящую реакцию можно записать уравнением:
В этой реакции железо вытесняет медь, которая выделяется из раствора и осаждается на поверхности гвоздя. Поэтому эта реакция и называется реакцией замещения.
189. РЕАКЦИЯ ОБМЕНА
Приготовим в пробирке небольшое количество раствора сернокислой меди (медного купороса, сульфата меди) и добавим немного известковой воды. Выпадает голубой студенеобразный осадок гидроксида меди.Здесь произошла так называемая реакция обмена:
Примечание: стрелка, направленная вниз, указывает, что вещество выпадает из раствора в осадок. В молекулах поменялись местами атомы и группы атомов.
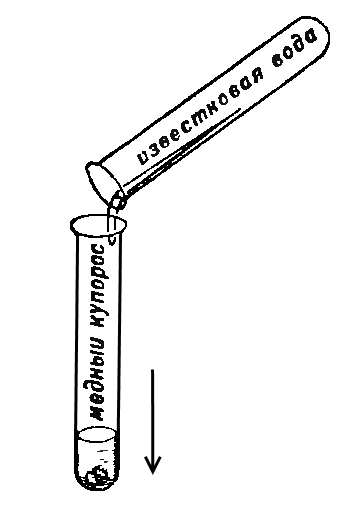
190. СИНЕЕ ПРЕВРАЩАЕТСЯ В ЧЕРНОЕ
Продолжим предыдущий опыт.Поместим пробирку с осадком на огонь спиртовки и нагреем до кипения. Осадок постепенно будет темнеть и, наконец, станет черным. Это объясняется тем, что голубой гидроксид меди превратился при нагревании в черный оксид меди. Опыт может не удаться, если мы возьмем слишком мало известковой воды. Тогда его надо повторить с меньшим количеством сернокислой меди (сульфата меди), прилив побольше известковой воды.
Какого типа эта реакция? Постарайтесь ответить на этот вопрос самостоятельно.

191. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИИ
Смешай гашеную известь с аммонием хлористым (хлоридом аммония) в равном соотношении в пробирке. Ты почувствуешь незначительный запах аммиака.А теперь пробирку подогрей и ты ощутишь резкий запах аммиака.
Видоизменим опыт.
В пробирку налей растворы гидроокиси натрия (едкого натра) и хлорида аммония. Запаха аммиака нет. Нагрей пробирку и ты тотчас почувствуешь запах аммиака.
На основании этих опытов можно сделать вывод, что нагревание ускоряет эти химические реакции.
192. ВЛИЯНИЕ ПОВЕРХНОСТИ РЕАГИРУЮЩИХ ВЕЩЕСТВ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИИ
В одну пробирку положи мел кусочком, а в другую предварительно измельчи. В обе пробирки налей одинаковые количества соляной кислоты (но не больше четверти пробирки).В пробирке с порошком мела наблюдается бурная реакция с выделением углекислого газа; а в другой пробирке реакция протекает спокойно.
Следовательно, чем больше поверхность соприкосновения реагирующих веществ, тем быстрее протекает химическая реакция.
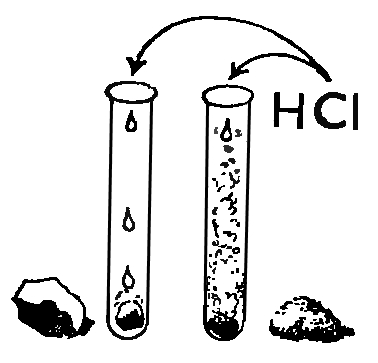
193. КАК ВЛИЯЮТ КИСЛОТЫ РАЗНОЙ СИЛЫ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИИ
В две пробирки помести по маленькому кусочку мрамора. В одну прилей соляную кислоту, в другую — такое же количество столового уксуса (уксусной кислоты). Выделяются пузырьки углекислого газа и ты сразу обнаружишь, что реакция мрамора с соляной кислотой идет интенсивнее, чем с уксусной кислотой.Значит соляная кислота сильнее уксусной. Попробуй убедиться в этом еще на одном опыте.
В одну пробирку налей соляной кислоты, а в другую столько же уксусной.
В обе пробирки брось по щепотке порошка железа. В обеих пробирках выделяются пузырьки водорода.
Ты видишь, что здесь результат тот же, что в первом опыте; реакция с соляной кислотой идет быстрее.
Следовательно, чем сильнее кислота, тем лучше идет реакция.
194. ЧТО ТЫ ЗНАЕШЬ О КАТАЛИЗАТОРАХ?
В две пробирки до половины нальем 3% раствора перекиси водорода. (Ее можно купить в аптеке).В одну пробирку бросим щепотку оксида марганца (IV) (диоксида марганца) из нашего набора, а в другую — небольшой кусочек сырого мяса. В обеих пробирках будем наблюдать бурную реакцию.
 |
 |
 |
 |
 Разложение Н2O2 под действием оксида марганца (IV) |
Перекись водорода как бы кипит, при этом выделяются пузырьки газа. Теперь постараемся выяснить, что это за газ. К отверстию пробирки поднесем тлеющую лучинку, она ярко вспыхивает. Следовательно, это кислород. Перекись водорода разложилась на кислород и воду:
Разложение перекиси водорода может происходить и без участия диоксида марганца (или сырого мяса). Но процесс этот происходит очень медленно. Чтобы убедиться в этом, нальем в 4 пробирки 3% раствор перекиси водорода и оставим их открытыми на свету.
Через три дня в первую пробирку добавим диоксид марганца. Наблюдаем признаки реакции (выделение пузырьков газа). Через следующие три дня — добавим диоксид марганца во вторую пробирку — выделение газа в меньшей степени.
То же проделаем с третьей и четвертой пробирками. На двенадцатый день в четвертой пробирке после добавления диоксида марганца никаких признаков реакции не наблюдается.
Следовательно, реакция разложения перекиси водорода прошла. В этой пробирке мы обнаруживаем воду.
Диоксид марганца и сырое мясо ускоряют эту реакцию.
Вещества, которые ускоряют химическую реакцию, а сами при этом остаются к концу реакции неизмененными называются катализаторами, а реакции с участием катализаторов — каталитическими.
С каталитической реакцией ты уже познакомился вначале нашего руководства, когда для более быстрого горения сахара использовал пепел, содержащий соединения лития. Соединения лития в этой реакции являются катализатором. Диоксид марганца и белки, содержащиеся в сыром мясе — тоже катализаторы.
Таких веществ в природе и полученных искусственным путем очень мало.
Проделаем некоторые опыты с катализаторами.
195. ЕЩЕ ОДИН ОПЫТ С ПЕРЕКИСЬЮ ВОДОРОДА
В три пробирки наливаем: в одну раствор сернокислой меди (медного купороса), в другую раствор аммиака (нашатырный спирт), в третью смесь этих двух растворов. В третьей пробирке образуется темно-синий раствор — соединение меди с аммиаком.
Затем во все три пробирки добавляем равное количество перекиси водорода. В то время, как в первых двух пробирках признаки реакции разложения еле заметны, в третьей пробирке, содержащей соединение аммиака с медью, происходит бурная реакция разложения перекиси водорода.
Это соединение разлагает перекись водорода почти в миллион раз быстрее, чем раствор медного купороса, следовательно, это тоже катализатор.
196. ЧТО ТАКОЕ ИНГИБИТОРЫ?
Только что мы познакомились с веществами, ускоряющими химические реакции. Может быть существуют вещества, замедляющие реакции?Проделаем опыт.
В две пробирки нальем до половины соляной кислоты. В одну из пробирок бросим 1/4 таблетки уротропина (продается в аптеке) и размешиваем так, чтобы он растворился.
В обе пробирки бросаем очищенный гвоздик.
В пробирке, где не было уротропина гвоздь энергично реагирует с соляной кислотой.
В пробирке же, содержащей кислоту с уротропином, водород сначала выделяется энергично, но затем скорость выделения его уменьшается и через несколько минут почти прекращается.
Опыт показывает, что уротропин замедляет реакцию между железом и соляной кислотой.
Вещества, замедляющие химические реакции, называются ингибиторами.
Вот мы и выяснили некоторые условия, влияющие на скорость химических реакций. Это и температура, и поверхность соприкосновения реагирующих веществ, и катализаторы, и ингибиторы.
ЧТО ТАКОЕ УГЛЕВОДОРОДЫ?
Такие вещества получили название углеводородов. К ним относится бензол.
Молекула бензола содержит одинаковое количество атомов углерода и водорода — по 6. Формула бензола С6Н6.
 |
 Молекула бензола |
К углеводородам относятся бензин, керосин, которые получают из нефти. Нефть — это смесь большого количества различных углеводородов.
197. ЧТО ТАКОЕ УГЛЕВОДЫ?
Если нагреть немного крахмала на жестяной крышке и над выделяющимся паром подержать холодную сухую ложку, мы увидим, что она покроется капельками влаги: из крахмала улетучивается вода. В крахмале, как и во многих других продуктах, содержится очень распространенный элемент углерод, а также водород и кислород. Приводим формулы знакомых уже тебе по названиям соединений:- для крахмала – С6Н10O5
- для виноградного сахара — С6Н12O6
- для тростникового сахара — С12Н22О11

Подобные вещества называются углеводами, так как кроме углерода в состав их входят водород и кислород в таком же соотношении, как в воде (2:1).
ХИМИЧЕСКИЕ ФОКУСЫ
198. НЕВИДИМЫЕ ЧЕРНИЛА

Раствором гидроокиси натрия (едкого натра) напишем несколько слов на листе бумаги (чистым пером!) и дадим надписи просохнуть. Надпись высохнет и на листе бумаги не останется никаких следов. Затем, раствором фенолфталеина смочим кусочек ваты и проведем полученным тампоном по бумаге. Тотчас появится четкая надпись ярко-малинового цвета. Можно сделать аналогичную надпись разбавленным раствором сернокислой меди. Когда бумага просохнет, проведем по сделанной надписи ваткой, смоченной в нашатырном спирте, и надпись появится снова.
Симпатические (невидимые) чернила можно приготовить и из лимонного сока. Для этого выжмем сок лимона в пробирку и сделаем этими чернилами какую-нибудь надпись. Когда лимонный сок высохнет, подержим лист над пламенем свечи, и на бумаге возникает четкая надпись. Вместо лимонного сока можно воспользоваться соком, выжатым из мелко порезанной луковицы. Можно приготовить невидимые чернила из железных стружек и раствора соляной кислоты (см. опыт 148. «Растворяем иглы и перья»).
Полученными зелеными чернилами напишем несколько слов. Можно пользоваться железом (II) сернокислым 7-водным (сульфатом железа (II)) из нашего набора. Когда надпись высохнет, проведем ваткой, смоченной в растворе красной кровяной соли (или как она еще называется, калием железосинеродистым) по этому месту, и появится надпись ярко-синего цвета.
РАЗНОЦВЕТНОЕ ПЛАМЯ
199. ЖЕЛТОЕ ПЛАМЯ
Возьмем пинцетом несколько крупных кристалликов поваренной соли и подержим их в пламени спиртовки. Пламя окрасится в красивый желтый цвет.Желтое пламя можно получить, если железную проволоку смочить в воде, окунуть в раствор натрия углекислого кислого (гидрокарбоната натрия) и потом поместить в пламя спиртовки. В состав поваренной соли и гидрокарбоната натрия входит элемент натрий, который всегда окрасит пламя спиртовки ярко-желтым цветом.

Соли натрия окрашивают пламя в желтый цвет |
200. ЗЕЛЕНОЕ ПЛАМЯ
Смочим медную проволоку или латунную пластинку в соляной кислоте и поместим в пламя спиртовки. Через некоторое время пламя станет яркозеленым. Медь, из которой изготовлена медная проволока и которая входит в состав латуни, вызывает это изменение окраски пламени.
Медь окрашивает пламя в зеленый цвет |
201. КРАСНОЕ ПЛАМЯ
Капнем на кусочек мела соляной кислотой и смоченным концом внесем в пламя спиртовки. Пламя окрасится в красный цвет. В состав мела (углекислого кальция) входит элемент кальций, который окрасит пламя спиртовки красным цветом.
202. ФИОЛЕТОВОЕ ПЛАМЯ
Если внесем крупинки калия марганцовокислого (перманганата калия) на проволочной петле в пламя, то пламя окрасится в фиолетовый цвет. Смотреть эту окраску нужно через синее стекло.203. ОСЛЕПИТЕЛЬНОЕ ПЛАМЯ
Отщипни маленький кусочек магниевой ленты из нашего набора, внеси его в пламя, придерживая пинцетом и прищурив при этом глаза. Магний сгорит ярким сверкающим пламенем и превратится в белый пепел.Горение магния на воздухе |
Оксид магния, образованный в результате горения |
204. ФЕЙЕРВЕРК
Ты можешь сам приготовить интересную искроразбрасывающую свечу для новогодней иллюминации, но для этого ты должен потрудиться. Для опыта используем вещество из нашего набора — перманганат калия (марганцовокислый калий). Отсыпем из пробирки небольшую кучку этого вещества и размельчим ее на листе бумаги каким-нибудь твердым предметом так, чтобы получился мелкий порошок. Затем измельчим такое же по величине количество древесного угля в порошок. Основательно перемешаем эти порошки, добавив к ним порошок железа. Этой смесью наполните металлический колпачок (или наперсток), который ты раньше попросил у мамы, и внесем его с помощью проволоки в пламя. Когда колпачок достаточно нагреется, масса накалится и начнет выбрасывать красивый дождь искр.
205. «ОГНЕННЫЙ» ПОРОШОК
Если зажечь в спиртовом пламени деревянную щепку или лучинку, а потом погасить ее пламя, она продолжает тлеть. Посыпаем на тлеющую лучину измельченного калия марганцовокислого (перманганата калия). Везде, куда попадут крупинки перманганата, вспыхнет огонь. Перманганат калия способствует горению.206. МЕШОЧЕК С ДЕНЬГАМИ НЕ ГОРИТ
Возьмем 5—10 штук пятикопеечных монет (можно взять кусок меди, медную гирю), которые завертываются в один слой батистовым материалом. Этот мешок с деньгами нагреваем на пламени спиртовки. Ткань не загорается.
Почему?
Медь — хороший проводник тепла. Тепло от пламени спиртовки сразу передается меди, и ткань не успевает загореться.
207. БЕЧЕВКИ ДЫМЯТ, НО НЕ ГОРЯТ
Этот опыт можно демонстрировать как фокус своим товарищам или малышам. Возьми бечевку, длиной 25—30 см, смочи ее в растворе аммиака (нашатырном спирте), а другую, такой же длины, в растворе соляной кислоты. Затем бечевки по всей длине параллельно приблизь на расстояние до одного сантиметра.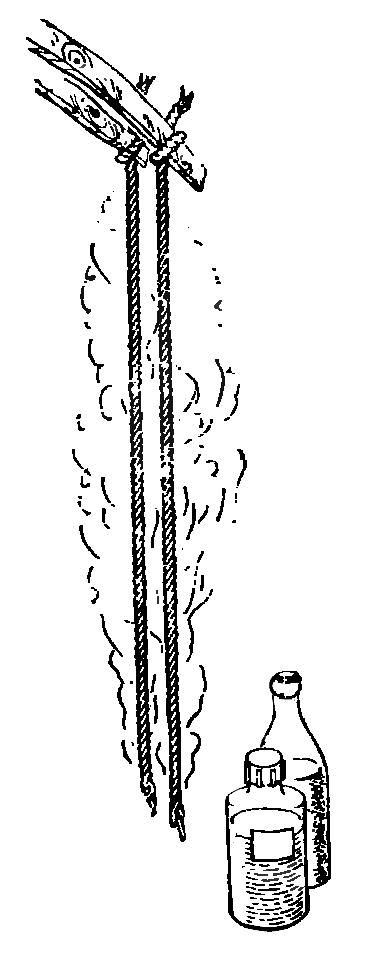
Появляется «дым», т.е. образуется хлорид аммония, пары которого имеют белый цвет Соляная кислота летучая, из нее выделяется газ — хлороводород (HCl).
Нашатырный спирт также летуч, из него выделяется аммиак (NH3).
Хлороводород взаимодействует с аммиаком, и образуется хлорид аммония в виде белого «дыма»:
При удалении бечевок друг от друга «дым» исчезает. Чтобы концы бечевок не держать руками - их следует закрепить на лучинах.

Другой вариант проведения реакции HCl + NH3 = NH4Cl
208. НЕСГОРАЕМАЯ НИТЬ
Суровую нитку хорошо пропитываем крепким раствором поваренной соли и высушиваем. Высушенную нитку, пропитанную солью, зажигаем, но она, сгорая не разрушается.Для большего эффекта к обработанной солью нити можно привязать, например, перо, чтобы оно висело на нитке.
Почему это происходит?
Нить сгорает, но кристаллы соли не сгорают и сохраняют форму нити.
209. «ЧУДО-ПАЛОЧКА»
Покажи этот опыт малышам. Для опыта в 4-х пробирках приготовь следующие растворы:в первой — раствор фенолфталеина, во второй — раствор гидроокиси натрия (едкого натра), в третьей — раствор соляной кислоты, в четвертой — раствор фиолетовых чернил. Возьми из набора пипетку. Ты начинаешь опыт с того, что незаметно для посторонних ладонью руки закрываешь пипетку сверху и часть содержимого из первой пробирки переносишь во вторую пробирку, и при помешивании пипеткой раствора жидкость становится малиновой.
Затем «чудо-палочку» опустить в третью пробирку, из которой пипетку снова переносишь во вторую пробирку, и малиновый цвет исчезает.

210. ГАЗ, ПОДДЕРЖИВАЮЩИЙ ГОРЕНИЕ
Наполним сухую пробирку на 1 см порошком марганцовокислого калия (перманганата калия) и плотно закроем ее пробкой с изогнутой трубкой. Ручку зажима для пробирки вставим в косое отверстие деревянного штатива так, чтобы пробирка удерживалась в наклонном положении, и нагреем порошок над пламенем спиртовки. При этом пробирка снаружи тоже должна быть абсолютно сухой, иначе она лопнет. Как только порошок начинает чернеть, поднесем к свободному отверстию изогнутой трубки чашку с водой так, чтобы конец трубки слегка опустился в воду. Мы увидим массу пузырьков, поднимающихся в воде от свободного конца трубки. Если поднести к отверстию трубки тлеющую лучину, она вспыхнет и энергично загорится.Газ, который поддерживает горение, называется кислородом.
Не прекращая нагревания, надо убрать чашку с водой, иначе воду засосет в пробирку и она лопнет.
 |
 Выделение кислорода в результате разложения перманганата калия |
211. ГОРЯЩАЯ ЖЕЛЕЗНАЯ ПРОВОЛОКА
В свободном кислороде могут гореть такие вещества, которые на воздухе обычно не горят. Из тонкой железной проволоки с помощью гвоздя совьем спираль или пружину, на конце которой укрепим уголек размером со спичечную головку.Затем конец пружинки с угольком раскалим в пламени и поднесем пинцетом близко к отверстию трубки, из которой выделяется кислород. Проволока начнет гореть и сгорит, разбрасывая искры. (Обязательно нужно подставить чашечку с песком).
 |
 Горение железа в кислороде |
212. КРАСНОЕ ИЛИ ЗЕЛЕНОЕ?
Насыпем в пробирку немного марганцовокислого калия (перманганата калия), закроем пробирку пробкой с изогнутой трубкой и нагреем на спиртовке. Затем поднесем к отверстию трубки тлеющую лучинку, она ярко загорится. Значит, при нагревании перманганата калия выделяется кислород. На дне пробирки образуется черный порошок, состоящий из манганата калия и диоксида марганца. Теперь приготовим водный раствор перманганата калия, который будет окрашен в яркий фиолетово-красный цвет. Прибавим к этому раствору немного черного порошка из пробирки и цвет изменится на ярко-зеленый, а через несколько минут снова станет фиолетово-красным. Зеленый цвет раствора был вызван образовавшимся манганатом калия, который в присутствии воды снова превратился в перманганат калия.Манганат калия K2MnO4 (раствор) |
213. КАК КРАСНЫЕ ЦВЕТЫ ПРЕВРАТИТЬ В СИНИЕ?
Нальем в небольшую вазочку немного раствора аммиака (нашатырного спирта), а рядом поставим красный цветок, все это покроем большой стеклянной банкой и оставим так в течение некоторого времени. Со временем красный цветок станет синим, даже сине-зеленым. В цветке имеется антоциан, окрашенный в красный цвет кислотами, содержащимися в почках. Аммиак, улетучиваясь из раствора, попадает на лепестки цветка и, как щелочь, окрашивает их в синий цвет.

214. ПОЧЕМУ КАРТОФЕЛЬ ПЛАВАЕТ В ВОДЕ?
Этот опыт ты можешь показать своим младшим братьям и сестрам. Приготовь насыщенный раствор поваренной соли.В литровую стеклянную банку до половины налей воды и положи клубень картофеля, который тут же опустится на дно.
Затем прилей в банку раствор поваренной соли (можешь малышам назвать этот раствор «водой»). Клубень картофеля всплывет наверх. Если в банку с картофелем прилить воды, то клубень снова утонет и опустится на дно банки.
Чем объяснить такое явление?
Обычно картофель в воде тонет, но в насыщенном растворе поваренной соли, удельный вес которой больше, чем у воды, картофель всплывает.
Вторично ты приливал чистую воду, и картофель снова утонул.

215. СВЕТОКОПИРОВАЛЬНАЯ БУМАГА ДЛЯ РАЗМНОЖЕНИЯ ЧЕРТЕЖЕЙ
В нашем наборе имеются вещества, с помощью которых можно самим изготовить светокопировальную бумагу. Это лимоннокислое железо и калий железосинеродистый (красная кровяная соль). Для опыта сначала приготовим растворы: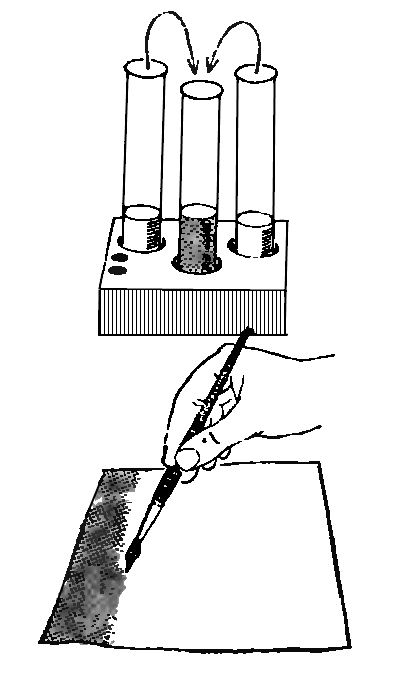 |
 |
1. В пробирке, заполненной на 5 см водой, растворим половину содержимого пробирки с лимоннокислым железом (для лучшей растворимости лимоннокислого железа пробирку следует нагреть).
2. Две трети содержимого пробирки с красной кровяной солью растворим в равном (по высоте пробирки) количестве воды. Оба раствора следует хранить в темном месте.
Смешаем в пробирке (по 2 см по высоте пробирки) оба раствора и получившийся зеленоватый состав нанесем с помощью кисточки сплошным слоем на лист чертежной бумаги или другой плотной бумаги. Окрашивание следует проводить в темной комнате или в полутемном коридоре. После окрашивания лист надо высушить в темноте, в закрытой коробке.
Вот мы и получили светокопировальную бумагу, проверим ее. Нарисуем на кальке или другой просвечивающей бумаге тушью какой-нибудь рисунок и попробуем его скопировать. Для этого надо поместить наш чертеж на изготовленную светокопировальную бумагу, оба листа положить на гладкую пластинку и сверху накрыть стеклом. Все это надо поместить в хорошо освещенное место, например, на подоконник, желательно, чтобы через это окно проникало много солнечных лучей. Та часть нашей светокопировальной бумаги, которая не покрыта черными линиями рисунка и, значит, доступна солнечным лучам, меняет окраску на темно-синюю. Светлым остается только контур рисунка, так как солнечные лучи не проникают через затушеванные места.
Для лучшего проявления наш копировальный лист после 5—10 минутного облучения можно положить на 15 минут в ванночку с водой.
216. НЕСГОРАЕМЫЕ ТКАНИ
Конторский силикатный клей — не что иное, как жидкое стекло. Разбавь клей наполовину водой, погрузи в этот раствор жидкого стекла, кусок холста, затем просуши его. Пропитанный материал, если его поджечь, не горит, а только тлеет. Такой же опыт можно проделать с фанерной дощечкой.Пропитанные жидким стеклом театральные занавеси из ткани, бумажные и матерчатые абажуры, сценическая бутафория и другие предметы становятся несгораемыми.
Тонкая пленка высохшего жидкого стекла полностью прекращает доступ воздуха к горящему материалу, и пламя гаснет. Жидким стеклом пропитывают рукавицы и спецодежду рабочих горячих цехов.

217. ПОЛУЧАЕМ КРЕМНИЕВУЮ КИСЛОТУ
Возьмем жидкое стекло — силикатный клей конторский (силикат натрия) и нальем на 1/4 пробирку.Затем помешивая содержимое пробирки стеклянной палочкой, прильем столько же соляной кислоты, или столового уксуса до слабокислой реакции (воспользуемся индикаторными бумажками!).
Происходит образование студнеобразною осадка. Это и есть кремниевая кислота — одна из немногих нерастворимых неорганических кислот.
Этот процесс можно записать уравнением:

ПОЛЕЗНЫЕ СОВЕТЫ
218. УДАЛЕНИЕ ПЯТЕН РЖАВЧИНЫ
Ржавым гвоздем сделай пятно на кусочке белой ткани и опусти ее в раствор лимонной кислоты.Потом промой ткань 2—3 раза водой.
Пятно исчезнет. Почему?
В состав ржавчины входят оксид и гидроксид железа (III), которые реагируют с кислотой.
219. УДАЛЕНИЕ ПЯТЕН ИОДА (ЙОДНОЙ НАСТОЙКИ) С ТКАНЕЙ
Сделай пятно йодной настойкой (из домашней аптечки) на белой ткани.Смочи ее холодной водой и несколько раз с обеих сторон протри пятно свежим срезом клубня сырого картофеля. Пятно исчезнет. Почему?
Потому, что в состав картофеля входит крахмал, который взаимодействует с йодом.
220. СВЕЖАЯ РЫБА И ЛАКМУСОВАЯ БУМАЖКА
Попробуем установить опытным путем насколько купленная в магазине рыба — свежая.На туловище рыбы сделаем глубокий надрез, в который вложим влажные лакмусовые бумажки, красную и синюю. Прижмем бумажки стеклянной палочкой.
Если бумажки приобретают слабо-сиреневую или розовую окраску, что указывает на нейтральную или слабокислую реакцию — рыба хорошего качества.
Если бумажки окрашиваются в синий или красный цвет — рыба недоброкачественная.