| |||||||
Астат
Астат – пятый галоген – наименее распространенный элемент на нашей планете, если, конечно, не считать трансурановые элементы. Приблизительный расчет показывает, что во всей земной коре содержится лишь около 30 г астата, и эта оценка – самая оптимистическая. У элемента №85 стабильных изотопов нет, а самый долгоживущий радиоактивный изотоп имеет период полураспада 8,3 часа, т.е. от полученного утром астата к вечеру не остается и половины.
Таким образом, в названии астата – а по-гречески αστατος значит «неустойчивый» – удачно отражена природа этого элемента. Чем же тогда может быть интересен астат и стоит ли заниматься его изучением? Стоит, ибо астат (так же, как прометий, технеций и франций) в полном смысле слова создан человеком, и изучение этого элемента дает много поучительного – прежде всего для познания закономерностей в изменении свойств элементов периодической системы. Проявляя в одних случаях металлические свойства, а в других – неметаллические, астат представляет собой один из наиболее своеобразных элементов.
До 1962 г. в русской химической литературе этот элемент называли астатином, а теперь за ним закрепилось название «астат», и это, видимо, правильно: ни в греческом, ни в латинском названии этого элемента (по-латыни astatium) нет суффикса «ин».
Поиски экаиода
Д. И, Менделеев именовал последний галоген не только экаиодом, но и галоидом X. Он писал в 1898 г.: «Можно, например, сказать, что при открытии галоида X с атомным весом, большим, чем иод, он все же будет образовывать KX, KXO3 и т.п., что его водородное соединение будет газообразной, очень непрочной кислотой, что атомный весь будет... около 215».
В 1920 г. немецкий химик Э. Вагнер вновь привлек внимание к все еще гипотетическому пятому члену группы галогенов, утверждая, что этот элемент должен быть радиоактивным.
Тогда и начались интенсивные поиски элемента №85 в природных объектах.
В предположениях о свойствах 85-го элемента химики исходили из местоположения его в периодической системе и из данных о свойствах соседей этого элемента по таблице Менделеева. Рассматривая свойства других членов группы галогенов, легко заметить следующую закономерность: фтор и хлор – газы, бром – уже жидкость, а иод – твердое вещество, проявляющее, хотя и в малой степени, свойства металлов. Экаиод – самый тяжелый галоген. Очевидно, он должен быть еще более металлоподобен, нежели иод, и, обладая многими свойствами галогенов, так или иначе похож и на своего соседа слева – полоний... Вместе с другими галогенами экаиод, по-видимому, должен находиться в воде морей, океанов, буровых скважин. Его пытались, подобно иоду, искать в морских водорослях, рассолах и т.п. Английский химик И. Фриенд пытался найти нынешние астат и франций в водах Мертвого моря, в которых, как было известно, и галогенов, и щелочных металлов более чем достаточно. Для извлечения экаиода из раствора хлоридов осаждалось хлористое серебро; Фриенд полагал, что осадок увлечет за собой и следы 85-го элемента. Однако ни рентгеноспектральный анализ, ни масс-спектрометрия не дали положительного результата.
В 1932 г. химики Политехнического института штата Алабама (США) во главе с Ф. Аллисоном сообщили, что ими из монацитового песка выделен продукт, в котором содержится около 0,000002 г одного из соединений элемента №85. В честь своего штата они назвали его «алабамий» и описали даже его соединение с водородом и кислородсодержащие кислоты. Название «алабамий» для 85-го элемента фигурировало в учебниках и справочниках по химии до 1947 г.
Однако уже вскоре после этого сообщения у нескольких ученых возникли сомнения в достоверности открытия Аллисона. Свойства алабамия резко расходились с предсказаниями периодического закона. Кроме того, к этому времени стало ясно, что все элементы тяжелее висмута не имеют стабильных изотопов. Допустив же стабильность элемента №85, наука оказалась бы перед необъяснимой аномалией. Ну, а если элемент №85 не стабилен, тогда на Земле его можно обнаружить лишь в двух случаях: если у него есть изотоп с периодом полураспада больше возраста Земли или если его изотопы образуются при распаде долгоживущих радиоактивных элементов.
Предположение, что элемент №85 может быть продуктом радиоактивного распада других элементов, стало отправной точкой для другой большой группы исследователей, занимавшихся поисками экаиода. Первым в этой группе следует назвать известного немецкого радиохимика Отто Гана, который еще в 1926 г. предположил возможность образования изотопов 85-го элемента при бета-распаде полония.
За 19 лет, с 1925 по 1943 г., в периодической печати появилось по меньшей мере полдюжины сообщений об открытии экаиода. Ему приписывали определенные химические свойства, присваивали звучные названия: гельвеций (в честь Швейцарии), англогельвеций (в честь Англии и Швейцарии), дакин (от названия древней страны даков в Средней Европе), лептин (в переводе с греческого «слабый», «шаткий», «обездоленный») и т.д. Однако первое достоверное сообщение об открытии и идентификации элемента №85 сделали физики, занятые синтезом новых элементов.
На циклотроне Калифорнийского университета Д. Корсон, К. Мак-Кензи и Э. Сегре облучили альфа-частицами мишень из висмута. Энергия частиц составляла 21 МэВ, и ядерная реакция получения элемента №85 была такова:
20983Bi + 42He → 21185At + 2 10n.
Новый синтетический элемент получил название лишь после войны, в 1947 г. Но еще раньше, в 1943 г., было доказано, что изотопы астата образуются во всех трех рядах радиоактивного распада. Следовательно, астат есть в природе.
Астат в природе
Астат в природе первыми нашли австрийские химики Б. Карлик и Т. Бернерт. Изучая радиоактивность дочерних продуктов радона, они обнаружили, что незначительная часть радия-А (так называли тогда, да и сейчас еще называют, изотоп 218Po) распадается двояко (так называемая радиоактивная вилка):
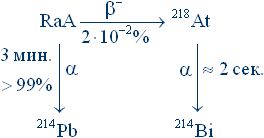
В свежевыделенном образце RaA наряду с альфа-частицами, порождаемыми полонием-218, были зарегистрированы и альфа-частицы с иными характеристиками. Как раз такие частицы могли, по теоретическим оценкам, испускать ядра изотопа 21885.
Позже в других опытах были обнаружены короткоживущие изотопы 215At, 216At и 217At. А в 1953 г. американские радиохимики Э. Хайд и А. Гиорсо химическим путем выделили изотоп 219At из франция-223. Это единственный случай химической идентификации изотопа астата из имеющегося в природе изотопа. Намного проще и удобней получать астат искусственным путем.
Обнаружить, выделить, узнать
Приведенную выше реакцию облучения висмута альфа-частицами можно использовать и для синтеза других изотопов астата. Достаточно повысить энергию бомбардирующих частиц до 30 МэВ, как пойдет реакция с вылетом трех нейтронов и вместо астата-211 образуется астат-210. Чем выше энергия альфа-частиц, тем больше образуется вторичных нейтронов и тем меньше, следовательно, массовое число образующегося изотопа. В качестве мишеней для облучения используют металлический висмут или его окись, которые наплавляют или напыляют на алюминиевую или медную подложку.
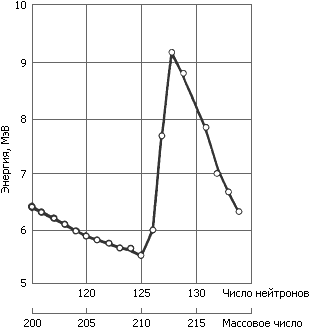
Рис. 6. Зависимость между энергией испускаемых альфа-частиц и массовым числом (или числом нейтронов в ядре) изотопов астата
Другой метод синтеза астата состоит в облучении ускоренными ионами углерода мишени из золота. В этом случае происходит, в частности, такая реакция:
19779Au + 126C → 20585At + 4 10n.
Для выделения образующегося астата из висмутовых или золотых мишеней используют достаточно высокую летучесть астата – он же все-таки галоген! Дистилляция происходит в токе азота или в вакууме при нагревании мишени до 300...600°C. Астат конденсируется на поверхности стеклянной ловушки, охлаждаемой жидким азотом или сухим льдом.
Еще один способ получения астата основан на реакциях расщепления ядер урана или тория при облучении их альфа-частицами или протонами высоких энергий. Так, например, при облучении 1 г металлического тория протонами с энергией 680 МэВ на синхроциклотроне Объединенного института ядерных исследований в Дубне получается около 20 микрокюри (иначе 3·1013 атомов) астата. Однако в этом случае гораздо труднее выделить астат из сложной смеси элементов. Эту нелегкую проблему сумела решить группа радиохимиков из Дубны во главе с В.А. Халкиным.
Сейчас известно уже 20 изотопов астата с массовыми числами от 200 до 219. Самый долгоживущий из них – изотоп 210At (период полураспада 8,3 часа), а самый короткоживущий – 214At (2·10–6 секунды).
Поскольку астат не может быть получен в весомых количествах, его физические и химические свойства изучены неполно, а физико-химические константы чаще всего рассчитываются по аналогии с более доступными соседями по периодической системе. В частности, вычислены температуры плавления и кипения астата – 411 и 299°C, т.е. астат, как и иод, должен легче возгоняться, чем плавиться.
Все исследования по химии астата проводились с ультрамалыми количествами этого элемента, порядка 10–9...10–13 г на литр растворителя. И дело даже не в том, что нельзя получить более концентрированные растворы. Если бы их и удалось получить, работать с ними было бы крайне сложно. Альфа-излучение астата приводит к радиолизу растворов, сильному их разогреву и образованию больших количеств побочных продуктов.
И все же, несмотря на все эти трудности, несмотря на то, что количество атомов астата в растворе сравнимо со случайными (хотя и тщательно избегаемыми) загрязнениями, в изучении химических свойств астата достигнуты определенные успехи. Установлено, что астат может существовать в шести валентных состояниях – от 1 – до 7+. В этом он проявляет себя как типичный аналог иода. Как и иод, он хорошо растворяется в большинстве органических растворителей, но зато легче, чем иод, приобретает положительный электрический заряд.
Получены и изучены свойства ряда межгалогенных соединений астата, например AtBr, AtI, CsAtI2.
Попытка с годными средствами
Первые попытки применить астат на практике были предприняты еще в 1940 г., сразу же после получения этого элемента. Группа сотрудников Калифорнийского университета установила, что астат, подобно иоду, селективно концентрируется в щитовидной железе. Опыты показали, что использовать 211At для лечения заболеваний щитовидной железы более выгодно, чем радиоактивный 131I.
Астат-211 испускает лишь альфа-лучи – весьма энергичные на небольших расстояниях, но не способные уйти далеко. В итоге они действуют лишь на щитовидную железу, не затрагивая соседнюю – паращитовидную. Радиобиологическое действие альфа-частиц астата на щитовидную железу в 2,8 раза сильнее, чем бета-частиц, излучаемых иодом-131. Это говорит о том, что в качестве терапевтического средства при лечении щитовидной железы астат весьма перспективен. Найдено и надежное средство выведения астата из организма. Роданид-ион блокирует накопление астата в щитовидной железе, образуя с ним прочный комплекс. Так что элемент №85 уже нельзя назвать практически бесполезным.
| < Полоний Po > < Оглавление > < Радон Rn > < Франций Fr > |

![Радиоактивный ряд урана-238 (4n+2) [другое название - радиоактивный ряд радия]](http://chemistry-chemists.com/N3_2012/U3/img/Decay_chain_4n+2,_Uranium_series.PNG)
