Chemistry and Chemists № 3 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 3 2025 Journal of Chemists-Enthusiasts |
Reaction of Sodium Thiosulfate with Iron(III) Salts - pt.1, 2 Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
How to Determine Composition of Unstable Complex? (Introduction) - Part 1
While I was experimenting with phenol, specifically filming a video of the formation of the blue complex of phenol with iron(III) chloride, a colleague wrote to me and suggested trying sodium thiosulfate instead of phenol. A similar color, he said, should appear. He had come across a monograph describing this behavior of reagents. I thanked him, but I could not perform the experiment immediately. At that time, while filming chemical demonstrations, I was busy with a synthesis project. I will not be able to share the results for a while, but this work consumed all my time and energy. I even placed my computer closer to the fume hood, because the stirrer often stopped working during the synthesis, requiring me to rush back and restart it. The lack of stirring caused a violent, uncontrolled reaction, which led to splashes of the caustic reaction mixture.
Реакция тиосульфата натрия с солями железа (III) Как определить состав нестабильного комплекса? (Вступление) - часть 1 A little later, the colleague successfully carried out this experiment using iron(III) sulfate and sodium thiosulfate. Then I remembered that I had first read about this complex in a popular science book as a schoolboy [1]. This complex is interesting because it decomposes almost immediately after formation. Many people assume that the study of unstable compounds is an exotic field that requires high or low temperatures, deep vacuum or high pressure, expensive equipment, and rare, hard-to-find substances. In fact, this is not always the case. I did not remember at first whether the iron salts involved were those of iron(II) or iron(III) (it turned out to be iron(III)). However, I clearly recalled how the composition of this unstable complex was determined. The composition of metal-ligand complexes is determined by various methods, especially spectrophotometry. For stable complexes, the procedure is as follows. A series of standard solutions is prepared with different molar ratios of metal (M) and ligand (L). For example, M:L = ...3:1, 2:1, 1:1, 1:2, 1:3… Then the optical density of each solution is measured. A graph of optical density versus the M:L ratio is plotted. Based on this graph, the composition of the complex is deduced. For example, if the maximum optical density is observed at an M:L ratio of 4, then the formula of the complex is ML4. My explanation is somewhat simplified. In reality, several complexes can form simultaneously in solution and exist in equilibrium with one another (ML2 + ML4 + ML6…). Nevertheless, I hope the principle is clear. Furthermore, it is preferable to determine the composition of the complex by several independent methods at the same time. 


For unstable complexes, however, mixing the reagents and measuring the optical density must be done in a flowing liquid. For example, in determining the composition of the Fe3+-thiosulfate complex, reagent solutions of specified concentrations were first prepared. The solutions of iron salt and thiosulfate were then fed through two parallel tubes at a controlled flow rate that ensured the desired ratio of substances. The tubes were connected in a Y-shape (or a T-shape), so that the two streams mixed and then passed into a flow cell. In the cell, iron(III) and thiosulfate formed a complex, and the solution then exited the cell through another tube. 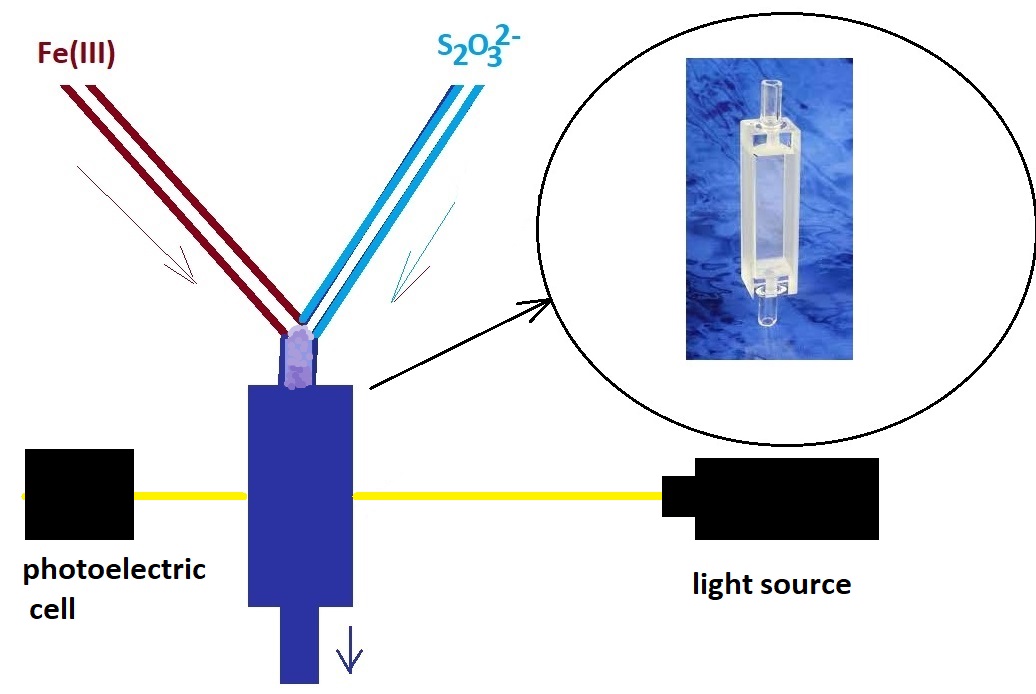
1Fe3+ : 1S2O32-. Therefore, the composition of the complex is [Fe(S2O3)]+: Fe3+(aq) + S2O32-(aq) => [Fe(S2O3)(H2O)2]+(aq) This complex is unstable because thiosulfate reduces iron(III) to iron(II), producing tetrathionate ions (S4O62-). This reaction leads to the decomposition of the complex. The following parts of the article describe experiments demonstrating the formation and subsequent decomposition of the iron(III)-thiosulfate complex under static conditions (not in a flow cell, but in a flask or beaker). __________________________________________________ 1 Leenson, I.A. - Odd or Even? Entertaining Stories on Chemistry (1987)/ Леенсон И.А. - Чёт или нечет? Занимательные очерки по химии (1987) [link]. |
|
Реакция тиосульфата натрия с солями железа (III)
Когда я проводил эксперименты с фенолом, в частности, снял видео образования синего комплекса фенола с хлоридом железа (III), мне написал коллега и предложил использовать вместо фенола тиосульфат натрия. Должна появиться подобная окраска. Он встретил монографию, где было описано такое поведение реагентов. Я поблагодарил, но провести такой эксперимент сразу не было возможности. Одновременно со съемкой химических демонстраций я был занят синтезом в рамках научного проекта. Его результаты смогу выложить в общий доступ не скоро, зато данная работа отнимала все время и силы. Даже компьютер я поставил ближе к вытяжному шкафу, поскольку во время синтеза мешалка часто отключалась - приходилось срочно подходить и включать. Отсутствие перемешивания вызывало бурную, неконтролируемую реакцию, что приводило к разбрызгиванию едкой реакционной смеси.
Вступление - часть 1 Чуть позже коллега успешно провел этот эксперимент, используя сульфат железа (III) и тиосульфат натрия. Тогда я вспомнил, что, будучи еще школьником, прочитал про этот комплекс в научно-популярной книге [1]. Данный комплекс интересен тем, что он разрушается сразу же после образования. Многие думают, что исследование неустойчивых соединений - экзотическая область. Требуются высокие или низкие температуры, глубокий вакуум или высокое давление, дорогое оборудование и экзотические, труднодоступные вещества. На самом деле это не всегда так. Я не помнил, какие соли железа используются: (II) или (III) (позже оказалось, что (III)). Зато я хорошо запомнил, как был установлен состав этого нестабильного комплекса. Состав комплексных соединений металлов с лигандами устанавливают разными методами, в частности, с помощью спектрофотометрии. Для стабильных комплексов поступают так. Готовят серию стандартных растворов с различным молярным соотношением металла (M) и лиганда (L). Например, M:L = ...3:1, 2:1, 1:1, 1:2, 1:3... Затем измеряют оптическую плотность этих растворов. Строят график зависимости оптической плотности от соотношения M:L. Исходя из графика, определяют состав комплекса. Например, если максимальная оптическая плотность наблюдается при соотношении M:L=4, то формула комплекса - ML4. Мое изложение несколько упрощенное. Например, в растворе может образоваться несколько комплексов одновременно, которые находятся в равновесии друг с другом (ML2 + ML4 + ML6...), но принцип, я надеюсь, понятен. Кроме того, состав комплекса желательно установить несколькими независимыми методами одновременно. А как можно определить состав нестабильного комплекса? Аналогично тому, как определяют химическую формулу стабильного комплекса. В случае стабильного комплекса раствор соли метала M и раствор лиганда L смешивают в мерной колбе, добавляют растворитель до заданного объема. Затем раствор наливают в фотометрическую кювету. Типичная кювета спектрофотометра представляет собой прямоугольную ячейку, изготовленную из оптического кварцевого стекла. Кювету помещают в фотометр и измеряют оптическую плотность раствора. 



1Fe3+ : 1S2O32- Следовательно, состав комплекса - [Fe(S2O3)]+: Fe3+(aq) + S2O32-(aq) => [Fe(S2O3)(H2O)2]+(aq) Этот комплекс нестабилен, поскольку тиосульфат восстанавливает железо(III) до железа(II) с образованием тетратионат-ионов (S4O62-). Данная реакция приводит к распаду комплекса. В следующих частях статьи описаны эксперименты, демонстрирующие образование и последующее разложение комплекса железа (III) с тиосульфатом в статических условиях (не в проточной ячейке, а в колбе или стакане). |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Reaction of Sodium Thiosulfate with Iron(III) Chloride (Trial Experiment) - Part 2
The colleague sent me the following description of his experiment:
Реакция тиосульфата натрия с хлоридом железа(III) (пробный эксперимент) - Часть 2 *"I ultimately reproduced this experiment as follows. In one beaker, I dissolved 1.00 g of 50% Fe2(SO4)3 paste in 9.00 g of water. The initially cloudy solution became clear and light brown. In another beaker, I dissolved 0.62 g of Na2S2O3·5H2O in 9.00 g of water. I drew the iron(III) sulfate solution into a syringe and, while stirring, began adding thiosulfate dropwise. A dark, almost black color of the complex immediately appeared in the solution! Apparently, the most difficult part of this experiment was finding a reasonably accurate sample of Fe(III) salts."* I did not have iron(III) sulfate, but I did have ferric nitrate and chloride. In this case, the sulfate could easily be replaced with chloride. When I opened the jar labeled "FeCl3·6H2O," I found a dark brown liquid instead of the solid compound. This salt is strongly hygroscopic, so it had absorbed moisture from the air, turning into a solution of iron(III) chloride. The concentration of this solution was unknown, but I assumed it was saturated. (If some solid phase had remained at the bottom of the jar, I could confidently say the solution was saturated, but in this case, all the iron(III) chloride had dissolved.) Looking up the reference data, I found that the solubility of anhydrous iron(III) chloride in water is 92 g/100 mL (at 20°C). Therefore, the iron(III) concentration in the jar solution was likely close to that in the iron(III) sulfate paste my colleague used. For my first trial, I decided not to change the procedure and to reproduce my colleague's experiment as closely as possible (with the difference that I used chloride solution instead of sulfate paste). In future experiments, I plan to make adjustments depending on the results. I weighed out 0.68 g of sodium thiosulfate (Na2S2O3·5H2O) and dissolved it in 9 g of water in one beaker. In another beaker, I mixed 1 g of the iron(III) chloride solution with 9 g of water and stirred. To begin, I added a few drops of the iron(III) chloride solution to the thiosulfate. The solution turned brownish-purple, almost black, and then gradually lightened. After stirring with a glass rod, the solution became colorless. Next, I added about half a milliliter of the iron chloride solution. The liquid again turned dark purple, almost black, before gradually lightening. The color shifted to brown and then to light yellow. This residual yellow color did not disappear. With another addition of iron(III), the solution again darkened before fading. However, this time the residual color was more intense than in the previous step. The next portion of iron(III) chloride once again produced a dark purple color, which slowly faded to yellow. Reaction products were gradually accumulating in the solution. One of them, the Fe2+ cation, is not completely colorless, which explained why the residual color became more pronounced. Finally, the next addition of iron(III) chloride no longer produced the dark purple coloration, indicating that all the sodium thiosulfate had been consumed in the reaction with iron(III). 2Fe3+(aq) + 2S2O32-(aq) = 2Fe2+(aq) + S4O62-(aq). |

Reaction of Sodium Thiosulfate with Iron(III) Chloride |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Комментарии
К1
Возможны побочные реакции.
Соли железа (III) в водных растворах устойчивы в кислой среде (pH меньше 1.5), при гидролизе получается кислая среда. Тиосульфат - наоборот. Его раствор медленно разлагается даже при добавлении уксусной кислоты. К2 Я наблюдал реакцию при демонстрационном опыте: В чайник наливают разбавленный раствор (нитрата) железа (III), почти бесцветный. Берут несколько стаканов. Один оставляют чистым, другой ополаскивают раствором роданида, третий - жёлтой кровяной соли, четвёртый - тиосульфата. И т.д., насколько хватает фантазии, цветные реакции с железом есть ещё. Далее, как обычно, разливают "воду" из чайника по стаканам. |