Chemistry and Chemists № 3 2025
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 3 2025 Journal of Chemists-Enthusiasts |
Dissolving Mollusk Shells in EDTA - pt.3, 4 Chemist |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Reaction of Disodium Salt of EDTA and Calcium Carbonate - Part 3
The reaction of mollusk shells with an EDTA-2Na solution proved to be insufficiently visual. Dissolution of the shell material was slow and incomplete. After the solution cooled, a precipitate formed in the beaker. I weighed the undissolved shell residue; its mass was 1.9 g.
Реакция динатриевой соли EDTA и карбоната кальция - Часть 3 To obtain a more demonstrative result, I decided to study the reaction between a disodium EDTA solution and calcium carbonate powder of analytical grade. I weighed 2 g of EDTA-2Na, added it to a beaker containing 100 ml of water, and heated it on a hot plate until it dissolved. Then I added 0.2 g of calcium carbonate. The calcium carbonate powder formed clumps that had to be broken up with a glass rod. A suspension formed, and carbon dioxide bubbles began to appear. The release of carbon dioxide indicated a reaction between EDTA-2Na and calcium carbonate, accompanied by the dissolution of the latter. As the solution was heated, bubbles of water vapor also appeared. However, the calcium carbonate particles soon settled at the bottom. Visually, no further dissolution of the precipitate occurred. For comparison, nitric, hydrochloric, or acetic acid dissolves calcium carbonate powder within minutes or even seconds under suitable experimental conditions. I then added another 4 g of solid EDTA-2Na. Gas was released vigorously, and the carbonate precipitate dissolved within about one minute. The solution, however, remained slightly cloudy. At the beginning of the experiment, the EDTA/Ca molar ratio was 2.64. Under these conditions, most of the calcium carbonate remained undissolved. After adding the second portion of EDTA-2Na, the ratio increased to 7.80, and under these conditions, the precipitate dissolved completely. It should be noted that, theoretically, EDTA-2Na and CaCO3 react in a 1:1 molar ratio. This experiment confirmed the conclusion drawn from the previous one: disodium EDTA does dissolve calcium carbonate, but only in the presence of a substantial excess of EDTA-2Na, which makes this process impractical. |

Reaction of Disodium Salt of EDTA and Calcium Carbonate |

|

|

|

|

|

|

|

|

|

|

|

|

|
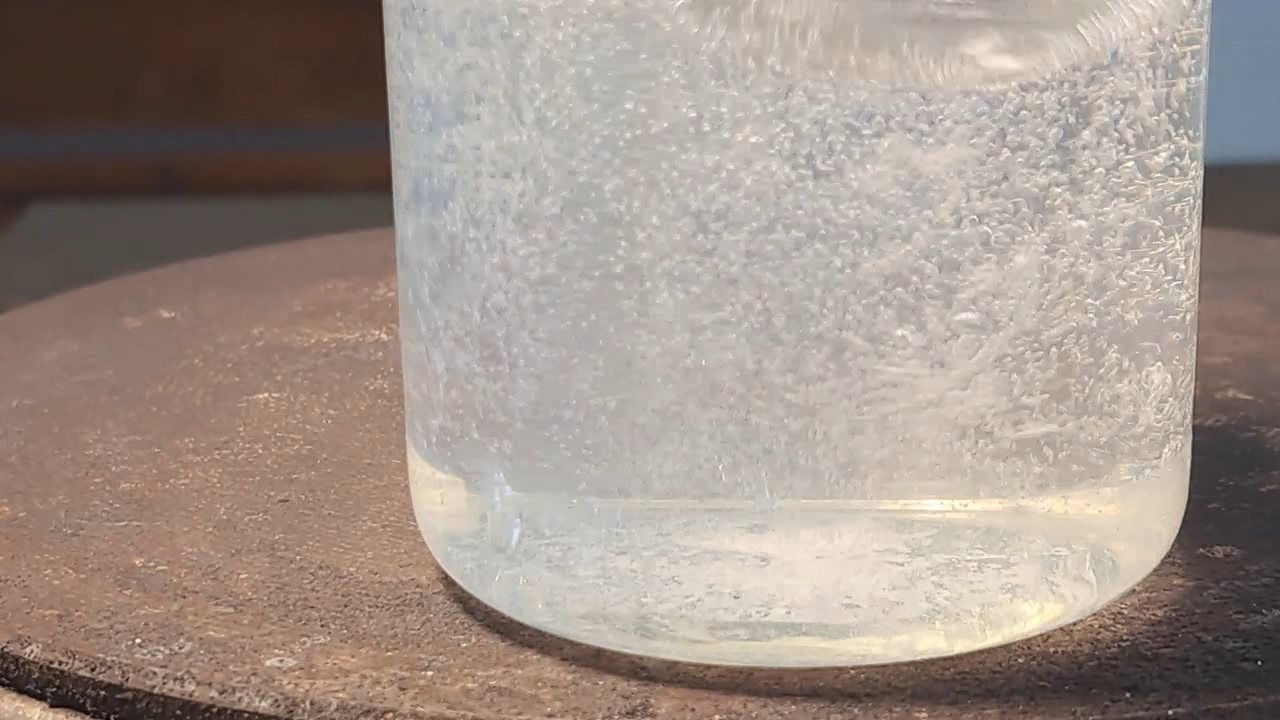
|

|

|

|
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Disodium Salt of EDTA and Calcium Sulfate - Part 4
As noted earlier, the presence of hardness salts in water can lead to scale formation - especially on the surfaces of kettles, washing machine heaters, pipes, and heating equipment. Such deposits consist primarily of calcium carbonate, magnesium carbonate, and calcium sulfate. Like calcium carbonate (and unlike magnesium sulfate), calcium sulfate is poorly soluble in water.
Динатриевая соль ЭДТА и сульфат кальция - Часть 4 However, the solubility of calcium sulfate in water is somewhat higher than that of the carbonate: 0.21 g of anhydrous calcium sulfate dissolves in 100 ml of water at 20°C, which is considerable for practical purposes. Moreover, the solubility of calcium sulfate decreases as temperature increases (an inverse temperature dependence of solubility). As a result, when a saturated solution is heated, calcium sulfate precipitates, contributing to scale formation. While calcium carbonate readily dissolves in acids (except those forming sparingly soluble calcium salts), calcium sulfate has a low solubility in acids - mostly, it is approximately the same as in water [K1]. Therefore, calcium sulfate deposits cannot be effectively removed by acid treatment. I decided to test whether calcium sulfate would dissolve in EDTA-2Na or EDTA-4Na solution. I poured approximately 50 ml of water into a beaker, added 2.64 g of EDTA-2Na, and heated the mixture until the salt dissolved. Then I added 0.21 g of anhydrous calcium sulfate and stirred thoroughly. The calcium sulfate did not dissolve. I added another 2.00 g of EDTA-2Na, continued heating, and stirred again. The precipitate still did not dissolve. Next, I added 1.03 g of sodium hydroxide to the beaker to convert the EDTA-2Na into the tetrasodium form (EDTA-4Na). The precipitate dissolved only partially. Thus, the use of EDTA-2Na or EDTA-4Na to dissolve calcium sulfate precipitate proved ineffective. Fortunately, in practice, scale formed from hard water usually consists not of pure calcium sulfate but of a mixture of calcium carbonate, magnesium carbonate, and calcium sulfate. Such mixed deposits can be effectively removed with hydrochloric acid. Although calcium sulfate itself is poorly soluble in hydrochloric acid, it is removed mechanically due to the dissolution of the surrounding calcium and magnesium carbonates. |
|
Динатриевая соль ЭДТА и сульфат кальция - Часть 4
Как мы уже отмечали, наличие в воде солей жесткости может привести к образованию накипи, особенно, на поверхности чайников, нагревателей стиральных машин, труб, отопительного оборудования и т.д. Осадок состоит преимущественно из карбонатов кальция, магния и сульфата кальция. Аналогично карбонату кальция (и в отличие от сульфата магния), сульфат кальция плохо растворим в воде.
Однако, растворимость сульфата кальция в воде выше, чем растворимость карбоната: в 100 мл воды при 20°С растворяется 0.21 г безводного сульфата, что существенно для практики. Более того, с увеличением температуры растворимость сульфата кальция в воде уменьшается (обратная температурная зависимость растворимости) - соль выпадает в осадок при нагревании насыщенного раствора, что приводит к образованию накипи. В то время как карбонат кальция легко растворяется в кислотах (за исключением тех, которые образовывают малорастворимые соли кальция), растворимость сульфата кальция в кислотах низкая - во многих случаях она приблизительно такая же, как в воде [K1]. Поэтому осадок сульфата кальция не может быть эффективно растворен действием кислот. Возникла идея проверить, растворяется ли сульфат кальция в растворе EDTA-2Na или EDTA-4Na? Налил в стакан приблизительно 50 мл воды, добавил 2.64 г EDTA-2Na. Стакан нагрел до растворения соли. Добавил 0.21 г безводного сульфата кальция, тщательно перемешал. Сульфат кальция не растворился. В стакан добавил еще 2.00 г EDTA-2Na, продолжил нагрев, перемешивал. Осадок не растворился. Добавил в стакан 1.03 г гидроксида натрия, чтобы превратить соль EDTA-2Na в тетранатриевую форму (EDTA-4Na). Осадок растворился только частично. Таким образом, использование EDTA-2Na или EDTA-4Na для растворения осадка сульфата кальция оказалось неэффективным. К счастью, на практике из жесткой воды чаще всего образуется не осадок чистого сульфата кальция, а смесь осадков карбоната кальция, карбоната магния и сульфата кальция, которая эффективно удаляется раствором соляной кислоты. Сульфат кальция плохо растворим в соляной кислоте, но он удаляется механически за счет растворения окружающих его карбонатов кальция и магния. |

Calcium sulfate |

The calcium sulfate did not dissolve in EDTA-2Na or EDTA-4Na |
|
Комментарии
К1
A small clarification regarding solubility in acids (in particular HCl).https://pubs.acs.org/doi/abs/10.1021/je050217e This and other similar works, in particular, "Solubility of calcium sulphate dihydrate in hydrochloric acid solutions" (2007), show that the solubility of gypsum (CaSO4·2H2O) in pure HCl increases to a maximum at an HCl concentration of about 3 mol/dm3 (which is approximately 10.95 wt.% HCl). This is the peak solubility value for gypsum and is approximately 35-37 g/dm3 (depending on temperature). This significant increase in solubility (from 2.05 g/dm3 in pure water to 36 g/dm3 at 10% HCl) is due to the formation of hydrosulfate ions, which effectively removes sulfate ion from solution and shifts the CaSO4 dissolution equilibrium to the right. Невелике уточнення щодо розчинності у кислотах (зокрема HCl). https://pubs.acs.org/doi/abs/10.1021/je050217e У цій та інших подібних роботах, зокрема, "Solubility of calcium sulphate dihydrate in hydrochloric acid solutions" (2007), показано, що розчинність гіпсу (CaSO4·2H2O) у чистій HCl зростає до максимуму при концентрації HCl близько 3 моль/дм3 (що приблизно 10.95 мас.% HCl). Це пікове значення розчинності для гіпсу і становить приблизно 35-37 г/дм3 (в залежності від температури). Це значне збільшення розчинності (з 2.05 г/дм3 у чистій воді до 36 г/дм3 при 10% HCl) пояснюється утворенням гідросульфат-іонів, що ефективно виводить сульфат-іон із розчину і зміщує рівновагу розчинення CaSO4 вправо. |