Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
История человечества знает множество случаев появления в биосфере больших
количеств потенциально опасных веществ. Воздействие этих ксенобиотиков (так,
напомним, называют вещества, неприемлемые для живых организмов) иногда было
причиной трагических последствий, примером которых может служить история с
инсектицидом ДДТ. Еще большую печальную известность приобрел диоксин. Долгое
время название этого вещества ассоциировалось с Южным Вьетнамом и итальянским
городом Севезо, жители которых сполна ощутили насколько смертоносно данное
соединение. Но со временем география диоксинов расширилась до размеров всей
планеты.
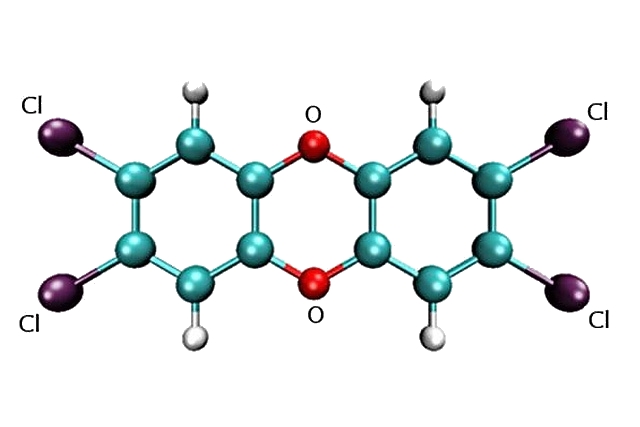
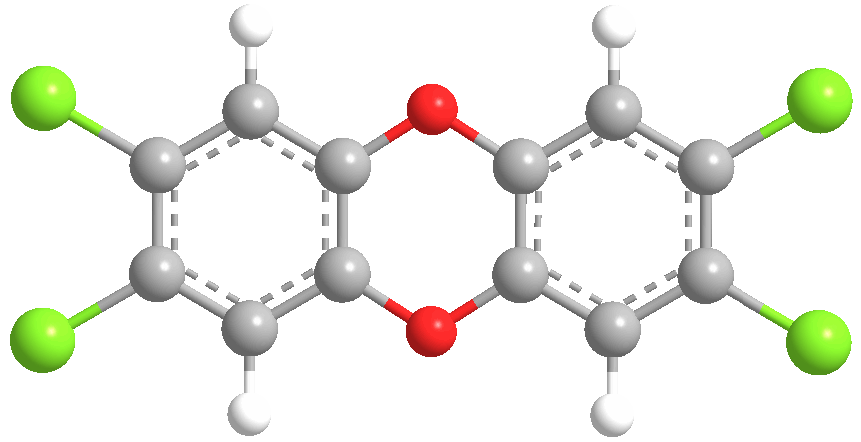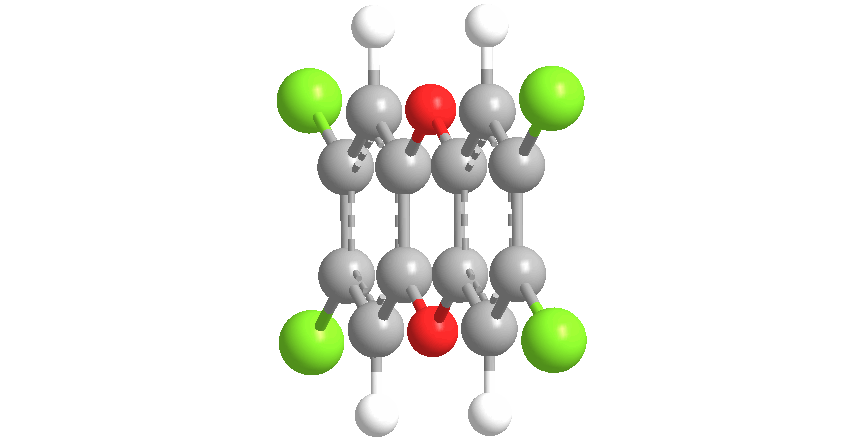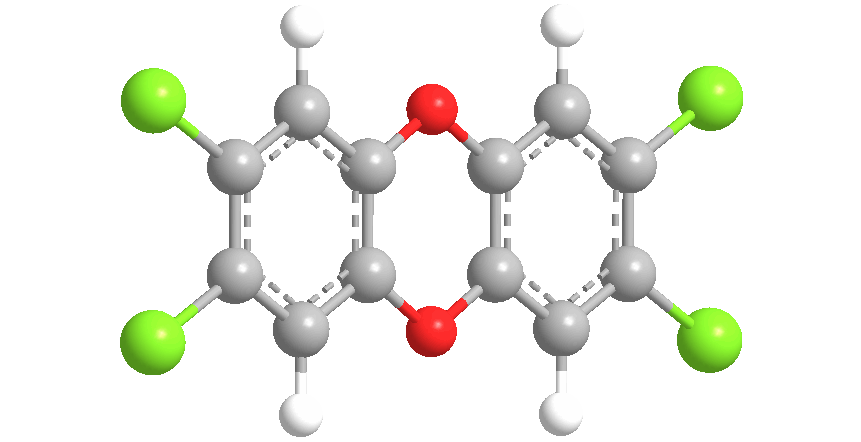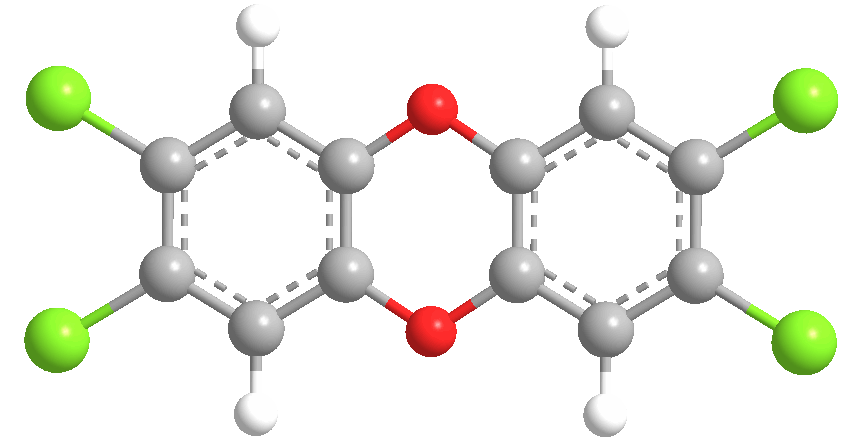
Диоксин, вернее – 2,3,7,8-тетрахлордибензо-пара-диоксин – представляет собой соединение, содержащее два бензольных кольца, в которых по два атома водорода замещено на хлор. Кольца соединены двумя мостиками из атомов кислорода:
Столь простая и изящная формула принадлежит самому токсичному из всех небелковых ядов, действие которого сильнее цианидов, стрихнина, кураре, зомана, зарина, табуна, VX-газа. Только биологические токсины превышают диоксин по токсичности.
Токсичность диоксина и некоторых ядов
Но диоксин является всего лишь одним из представителей большого класса соединений, которые представляют совсем не меньшую опасность. Удалите из молекулы один атом кислорода – и образуется почти столь же токсичный
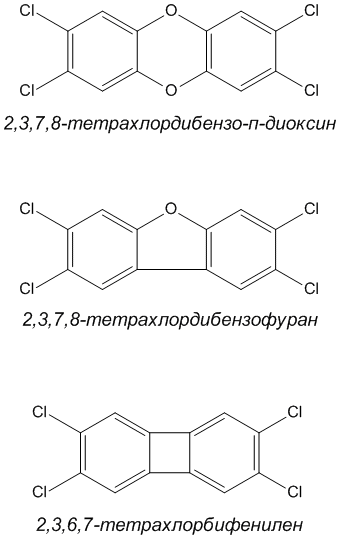
тетрахлордибензофуран. Удаление обоих атомов кислорода лишь частично уменьшит опасность. Количество и положение атомов хлора в бензольном ядре совсем не обязательно должно совпадать с таковыми для 2,3,7,8-тетрахлордибензо-пара-диоксина:
Атомы хлора могут быть полностью или частично замещены на бром:
Не так просто подсчитать, сколько высокотоксичных соединений можно получить, используя такие простые перестановки атомов. На данный момент известны тысячи представителей диоксинов и их число продолжает расти.
Таким образом, под диоксинами следует подразумевать не какое-то конкретное вещество, а несколько десятков семейств, включающих трициклические кислородсодержащие ксенобиотики, а также семейство бифенилов, не содержащих атомы кислорода. Это все 75 полихлорированных дибензодиоксинов, 135 полихлорированных дибензофуранов, 210 веществ из броморганических семейств и несколько тысяч смешанных хлорбромсодержащих. Нельзя забывать и об изомерии. Классический диоксин, с которого мы начали,— это лишь один (и самый токсичный) из 22 возможных изомеров Cl4-дибензо-пара-диоксинов.
Молекула диоксина имеет форму прямоугольника размерами 3х10 Å. Это позволяет ей удивительно точно вписываться в рецепторы живых организмов. Диоксин - один из самых коварных ядов, известных человечеству. В отличие от обычных ядов, токсичность которых связана с подавлением ими определенных функций организма, диоксин и подобные ему ксенобиотики поражают организм благодаря способности сильно повышать (индуцировать) активность ряда окислительных железосодержащих ферментов (монооксигеназ), что приводит к нарушению обмена многих жизненно важных веществ и подавлению функций ряда систем организма.
Диоксин опасен по двум причинам. Во-первых, являясь наиболее сильным синтетическим ядом, он отличается высокой стабильностью, долго сохраняется в окружающей среде, эффективно переносится по цепям питания и таким образом длительное время воздействует на живые организмы. Во-вторых, даже в относительно безвредных для организма количествах диоксин сильно повышает активность узкоспецифичных монооксигеназ печени, которые превращают многие вещества синтетического и природного происхождения в опасные для организма яды. Поэтому уже небольшие количества диоксина создают опасность поражения живых организмов имеющимися в природе обычно безвредными ксенобиотиками.
Откуда вообще взялся диоксин? Массовое производство хлорфенолов и гербицидов началось в тридцатые-сороковые годы в США и Германии.
Но первое упоминание о диоксинах датировано лишь 1957 годом. Почему? Потому что они — продукт незапланированный, побочный. Назвать какого-то одного первооткрывателя диоксинов трудно. К их открытию привел многолетний опыт человеческих трагедий и сопоставлений по аналогии. Если бы от диоксинов не было столько вреда, может, их и открывать бы никогда не пришлось.
В начале 30-х годов фирмой "Дау Кемикал" (США) был разработан способ получения полихлорфенолов из полихлорбензолов щелочным гидролизом при высокой температуре под давлением и показано, что эти препараты, получившие название дауцидов, являются эффективными средствами для консервации древесины.
Уже в 1936 г. появились сообщения о массовых заболеваниях среди рабочих шт. Миссисипи, занятых консервацией древесины с помощью этих агентов. Большинство из них страдали тяжелым кожным заболеванием. В 1937 г. были описаны случаи аналогичных заболеваний среди рабочих завода в Мидланде (шт. Мичиган, США), занятых в производстве дауцидов. Расследование причин поражения в этих и многих подобных случаях привело к заключению, что хлоракногенный фактор присутствует только в технических дауцидах, а чистые полихлорфенолы подобным действием не обладают.
Расширение масштабов поражения полихлорфенолами в дальнейшем было обусловлено их использованием в военных целях. Во время второй мировой войны в США были получены первые гербицидные препараты гормоноподобного действия на основе 2,4-дихлор- и 2,4,5-трихлорфеноксиуксусных кислот (2,4-Д и 2,4,5-Т). Эти препараты разрабатывались для поражения растительности Японии и были приняты на вооружение армией США вскоре после войны. Одновременно эти кислоты, их соли и эфиры стали использоваться для химической прополки сорняков в посевах злаковых культур, а смеси эфиров 2,4-Д и 2,4,5-Т - для уничтожения нежелательной древесной и кустарниковой растительности. Это позволило военно-промышленным кругам США создать крупнотоннажные производства 2,4-дихлор-, 2,4,5-трихлорфенолов, а на их основе кислот 2,4-Д и 2,4,5-Т.
Изучение свойств 2,4-Д и ее производных явилось мощным импульсом к становлению современной химии гербицидов. Совсем по-иному развивались события, связанные с расширением масштабов производства и применения 2,4,5-Т.
В 1949 стало извесно о массовом заболевании, проявляющемся в виде множества покрывающих кожу незаживающих фурункулов, которое имело место после взрыва на заводе «Nitro» в американском штате Виржиния. На предприятии производился 2,4,5-трихлорфенол. Пострадали тогда двести с лишним человек, и примерно у половины из них обнаружили симптомы какой-то новой болезни. Впрочем, сразу же вспомнили, что известна эта болезнь еще с конца прошлого века и даже название имеет — хлоракне (тогда немецкие врачи сочли ее чисто кожной и причину усмотрели единственно в действии хлора). 32 человека тогда же скончались. Более половины оставшихся в живых не смогли излечиться вплоть до последних лет.
В 50-е годы появились сообщения о частых поражениях техническими 2,4,5-Т и трихлорфенолом. 1953 год. Авария на заводе фирмы «BASF» в ФРГ. И снова у 55 пострадавших — хлоракне. 1956 год. Взрыв на заводе фирмы «Rone Poulenc» во Франции. И снова та же странная болезнь, возбудитель которой неизвестен, но теперь хоть все поняли, что это точно не хлор...
Между тем тогда в ФРГ и США над проблемой хлоракне работало несколько групп ученых. Г. Гофман (ФРГ) выделил в чистом виде хлоракногенный фактор технического трихлорфенола, изучил его свойства, физиологическую активность и приписал ему строение тетрахлордибензофурана. Синтезированный образец этого соединения действительно оказывал на животных такое же действие, как и технический трихлорфенол.
В это же время К. Шульц (ФРГ), специалист в области кожных заболеваний, обратил внимание на то, что симптоматика поражения его клиента, работающего с хлорированными дибензо-пара-диоксинами, идентична симптоматике поражения техническим трихлорфенолом. Проведенные им исследования показали, что хлоракногенным фактором технического трихлорфенола действительно является 2,3,7,8-тетрахлордибензо-пара-диоксин (диоксин) - неизбежный побочный продукт щелочной переработки симметричного тетрахлорбензола. Позже сведения К. Шульца получили подтверждение в работах других ученых.
Высокая токсичность диоксина была установлена в 1957 г. и в США. Это произошло после несчастного случая с американским химиком Дж. Дитрихом, который, занимаясь синтезом диоксина и его аналогов, получил сильное поражение, напоминающее поражение техническим трихлорфенолом, и был госпитализирован на длительный срок. Этот факт, как и многие другие инциденты на производствах трихлорфенола, был скрыт от общественности, а синтезированные американским химиком галогенированные дибензо-п-диоксины изъяты для изучения военным ведомством.
Далее-то открытия следуют по нарастающей. Удается, например, установить, что причиной азиатских болезней Юшо и Ю-Ченг (названы они в память соответственно японского и тайваньского поселков, жители которых пострадали в 60—70-е годы от жестокого отравления) послужил собрат классического диоксина — тетрахлордибензофуран, формула которого уже изображена выше. Общее число пострадавших при этих двух катастрофах составило примерно четыре тысячи человек.
К этому времени, несмотря на высокую токсичность, 2,4,5-трихлорфенол проник во многие сферы производства. Его натриевая и цинковая соли, а также продукт переработки - гексахлорофен стали широко применяться в качестве биоцидных препаратов в технике, сельском хозяйстве, текстильной и бумажной промышленности, в медицине и т.д. На основе этого фенола приготавливались инсектициды, препараты для нужд ветеринарии, технические жидкости различного назначения. Однако наиболее широкое применение 2,4,5-трихлорфенол нашел в производстве 2,4,5-Т и других гербицидов, предназначенных не только для мирных, но и для военных целей. В результате к 1960 г. производство трихлорфенола достигло внушительного уровня - многих тысяч тонн в год.
Но диоксин является причиной куда более серьезных болезней чем хлоракне. Это начали понимать только после американо-вьетнамской войны. За период с 1961 по 1970 годы американская армия под предлогом борьбы с партизанами распылила на территории Южного Вьетнама 57 тысяч тонн дефолианта «Agent Orange» для уничтожения растительности. Подобные операции пришлось прекратить из-за многочисленных сообщений о раковых и других заболеваниях участников событий, в том числе и военнослужащих США и Австралии, о рождении у них детей-уродов.
Интересно, что сам по себе этот препарат с таким красивым названием (видите, красота опять обманчива) не может вызвать ничего подобного. Но из-за несовершенства его производства упомянутые 57 тысяч тонн дефолианта содержали 170 кг (0,0003 процента!) диоксина, который и наделал столько бед.
Гербицидные рецептуры армии США, содержащие диоксин
*Процентное содержание данного компонента в рецептуре
Для сравнения отметим, что массовое отравление в итальянском городе Севезо вызвали какие-то несколько килограммов диоксина. При ликвидации последствий этой катастрофы с большой территории пришлось удалять поверхностный слой почвы.
Тем временем в нашей печати, как в научной, так и массовой, до 1985 года диоксинам вообще не было посвящено ни одной публикации. В пятитомной «Краткой химической энциклопедии» (1961 г.) равно как и в изданном значительно позднее «Химическом энциклопедическом словаре» даже слова такого нет! Более того, листая старые подшивки санитарных журналов и сборников, можно найти сообщения о том, что в Уфе с 1964 по 1970 годы работал цех по производству того самого гербицида, который американцы называют «Agent Orange». И 128 человек из 165 обслуживающего персонала заболели неизвестной болезнью, по симптомам совпадающей с хлоракне. Данные эти (без географической привязки) перекочевали в зарубежную печать. А из отечественной прессы они странным (или не очень странным) образом исчезли. Кстати, тот цех реконструировали, потом закрыли. Но что стало с отходами производства — о том молчание. Вы скажете: в те времена иначе и не бывало. Но не повторяем ли мы сегодня ошибки прошлого? Вспомните недавние события в Уфе. Фенолы попали в хлорируемую воду — вот и создались прекрасные условия для образования диоксинов. К тому же они могли сопутствовать фенолам из-за несовершенства технологии производства последних.
Диоксин - кристаллическое вещество с высокой температурой плавления (305°С) и очень низкой летучестью, плохо растворяющееся в воде (2x10-8% при 25°С) и лучше - в органических растворителях. Он отличается высокой термической стабильностью: его разложение отмечается лишь при нагревании выше 750°С, а эффективно осуществляется при 1000°С.
Диоксин - химически инертное вещество. Кислотами и щелочами он не разлагается даже при кипячении. В характерные для ароматических соединений реакции хлорирования и сульфирования он вступает только в очень жестких условиях и в присутствии катализаторов. Замещение атомов хлора молекулы диоксина на другие атомы или группы атомов осуществляется лишь в условиях свободнорадикальных реакций. Некоторые из этих превращений, например взаимодействие с натрий-нафталином и восстановительное дехлорирование при ультрафиолетовом облучении, используются для уничтожения небольших количеств диоксина. При окислении в безводных условиях диоксин легко отдает один электрон и превращается в стабильный катион-радикал, который, однако, легко восстанавливается водой в диоксин с выделением очень активного катион-радикала НО+•. Характерной для диоксина является его способность к образованию прочных комплексов с многими природными и синтетическими полициклическими соединениями.
Токсические свойства. Диоксин - тотальный яд, поскольку даже в относительно малых дозах (концентрациях) он поражает практически все формы живой материи - от бактерий до теплокровных. Токсичность диоксина в случае простейших организмов обусловлена, по-видимому, нарушением функций металлоферментов, с которыми он образует прочные комплексы. Значительно сложнее происходит поражение диоксином высших организмов, особенно теплокровных. В организме теплокровных диоксин первоначально попадает в жировые ткани, а затем перераспределяется, накапливаясь преимущественно в печени, затем в тимусе и других органах. Его разрушение в организме незначительно: он выводится в основном неизменным, в виде комплексов неустановленной пока природы. Период полувыведения колеблется от нескольких десятков дней (мышь) до года и более (приматы) и обычно возрастает при медленном поступлении в организм. С повышением удерживаемости в организме и избирательного накопления в печени чувствительность особей к диоксину возрастает.
При остром отравлении животных наблюдаются признаки общетоксического действия диоксина: потеря аппетита, физическая и половая слабость, хроническая усталость, депрессия и катастрофическая потеря веса. К летальному исходу он приводит через несколько дней и даже через несколько десятков дней, в зависимости от дозы яда и скорости его поступления в организм.
В нелетальных дозах диоксин вызывает тяжелые специфические заболевания. У высокочувствительных особей первоначально появляется заболевание кожи - хлоракне (поражение сальных желез, сопровождающееся дерматитами и образованием долго незаживающих язв), причем у людей хлоракне может проявляться снова и снова даже через многие годы после излечения. Более сильное поражение диоксином приводит к нарушению обмена порфиринов - важных предшественников гемоглобина и простетических групп железосодержащих ферментов (цитохромов). Порфирия - так называется это заболевание - проявляется в повышенной фоточувствительности кожи: она становится хрупкой, покрывается многочисленными микропузырьками. При хроническом отравлении диоксином развиваются также различные заболевания, связанные с поражениями печени, иммунных систем и центральной нервной системы.
Все эти заболевания проявляются на фоне резкой активации диоксином (в десятки и сотни раз) важного железосодержащего фермента - цитохрома Р-448. Особенно сильно активируется этот фермент в плаценте и в плоде, в связи с чем диоксин даже в ничтожных количествах подавляет жизнеспособность, нарушает процессы формирования и развития нового организма, иными словами, оказывает эмбриотоксическое и тератогенное действие. В ничтожных концентрациях диоксин вызывает генетические изменения в клетках пораженных особей и повышает частоту возникновения опухолей, т.е. обладает мутагенным и канцерогенным действием.
Токсичность диоксина при одноразовом введении
*ЛД50 - обозначение, принятое в токсикологии для дозы, вызывающей в 50% летальный исход.
**Летальная концентрация.
Поведение в окружающей среде. В биосфере диоксин быстро поглощается растениями, сорбируется почвой и различными материалами, где практически не изменяется под влиянием физических, химических и биологических факторов среды. Благодаря способности к образованию комплексов, он прочно связывается с органическими веществами почвы, купируется в остатках погибших почвенных микроорганизмов и омертвевших частях растений. Период полураспада диоксина в природе превышает 10 лет. Таким образом, различные объекты окружающей среды являются надежными хранилищами этого яда.
Дальнейшее поведение диоксина в окружающей среде определяется свойствами объектов, с которыми он связывается. Его вертикальная и горизонтальная миграции в почвах возможны только для ряда тропических районов, где в почвах преобладают водорастворимые органические вещества. В почвах остальных типов, содержащих нерастворимые в воде органические вещества, он прочно связывается в верхних слоях и постепенно накапливается в остатках погибших организмов.
Из почв диоксин выводится преимущественно механическим путем. Отличающиеся низкой плотностью комплексы диоксина с органическими веществами, а также содержащие его остатки погибших организмов выдуваются с поверхности почвы ветром, вымываются дождевыми потоками и в итоге устремляются в низменности и акватории, создавая новые очаги заражения (места скопления дождевой воды, озера, донные отложения рек, каналов, прибрежной зоны морей и океанов).
Проведенные недавно анализы почв некоторых районов Южного Вьетнама указывают на сравнительно небольшое содержание диоксина в поверхностных слоях и на его появление в концентрации до 30 частей на триллион (30 ppt) в глубинных частях почвы. Это свидетельствует о том, что физический и механический перенос в условиях тропиков способствует эффективному рассеянию яда в природе. Однако это не единственный путь миграции диоксина в биосфере. Существует еще перенос этого яда по цепям питания, который способствует его постоянному накоплению в районах максимального потребления зараженных им продуктов питания, т.е. концентрированию в густонаселенных районах.
По мнению вьетнамского ученого и хирурга профессора Тон Тхат Тунга, эффективный биоперенос диоксина в природе способствует постоянному его накоплению теплокровными, причем степень накопления диоксина теплокровными возрастает с увеличением содержания яда в окружающей среде. Это заключение явилось результатом многолетнего изучения последствий прошедшей химической войны для обширных контингентов десятимиллионного населения Вьетнама, проживавших и (или) проживающих в районах применения так называемых "безвредных для человека и окружающей среды" гербицидов.
Диоксин, вернее – 2,3,7,8-тетрахлордибензо-пара-диоксин – представляет собой соединение, содержащее два бензольных кольца, в которых по два атома водорода замещено на хлор. Кольца соединены двумя мостиками из атомов кислорода:
 |
 |
Столь простая и изящная формула принадлежит самому токсичному из всех небелковых ядов, действие которого сильнее цианидов, стрихнина, кураре, зомана, зарина, табуна, VX-газа. Только биологические токсины превышают диоксин по токсичности.
| Вещество | Животное | Минимальная летальная доза, микромоль/кг [K1] |
| Ботулинический токсин | мышь | 3,3•10-17 |
| Дифтерийный токсин | мышь | 4,2•10-12 |
| Диоксин | морская свинка | 3,1•10-9 |
| Кураре | мышь | 7,2•10-7 |
| Стрихнин | мышь | 1,5•10-6 |
| Диизопропилфторфосфат | мышь | 1,6•10-5 |
| Цианид натрия | мышь | 3,1•10-4 |
____________________________________________
K1Таблица взята из статьи:
А.В. Фокин, А.Ф. Коломиец Диоксин - проблема научная или социальная? - журнал Природа № 3, 1985 г. и, вероятно, содержит опечатку: судя по порядку величины единица измерения должна быть не микромоль/кг, а моль/кг.
K1Таблица взята из статьи:
А.В. Фокин, А.Ф. Коломиец Диоксин - проблема научная или социальная? - журнал Природа № 3, 1985 г. и, вероятно, содержит опечатку: судя по порядку величины единица измерения должна быть не микромоль/кг, а моль/кг.
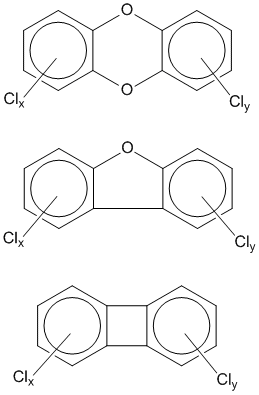
Но диоксин является всего лишь одним из представителей большого класса соединений, которые представляют совсем не меньшую опасность. Удалите из молекулы один атом кислорода – и образуется почти столь же токсичный

тетрахлордибензофуран. Удаление обоих атомов кислорода лишь частично уменьшит опасность. Количество и положение атомов хлора в бензольном ядре совсем не обязательно должно совпадать с таковыми для 2,3,7,8-тетрахлордибензо-пара-диоксина:

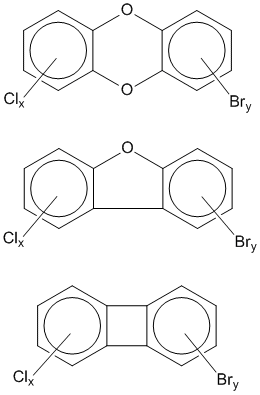
Атомы хлора могут быть полностью или частично замещены на бром:

Не так просто подсчитать, сколько высокотоксичных соединений можно получить, используя такие простые перестановки атомов. На данный момент известны тысячи представителей диоксинов и их число продолжает расти.
Таким образом, под диоксинами следует подразумевать не какое-то конкретное вещество, а несколько десятков семейств, включающих трициклические кислородсодержащие ксенобиотики, а также семейство бифенилов, не содержащих атомы кислорода. Это все 75 полихлорированных дибензодиоксинов, 135 полихлорированных дибензофуранов, 210 веществ из броморганических семейств и несколько тысяч смешанных хлорбромсодержащих. Нельзя забывать и об изомерии. Классический диоксин, с которого мы начали,— это лишь один (и самый токсичный) из 22 возможных изомеров Cl4-дибензо-пара-диоксинов.
Молекула диоксина имеет форму прямоугольника размерами 3х10 Å. Это позволяет ей удивительно точно вписываться в рецепторы живых организмов. Диоксин - один из самых коварных ядов, известных человечеству. В отличие от обычных ядов, токсичность которых связана с подавлением ими определенных функций организма, диоксин и подобные ему ксенобиотики поражают организм благодаря способности сильно повышать (индуцировать) активность ряда окислительных железосодержащих ферментов (монооксигеназ), что приводит к нарушению обмена многих жизненно важных веществ и подавлению функций ряда систем организма.
Диоксин опасен по двум причинам. Во-первых, являясь наиболее сильным синтетическим ядом, он отличается высокой стабильностью, долго сохраняется в окружающей среде, эффективно переносится по цепям питания и таким образом длительное время воздействует на живые организмы. Во-вторых, даже в относительно безвредных для организма количествах диоксин сильно повышает активность узкоспецифичных монооксигеназ печени, которые превращают многие вещества синтетического и природного происхождения в опасные для организма яды. Поэтому уже небольшие количества диоксина создают опасность поражения живых организмов имеющимися в природе обычно безвредными ксенобиотиками.
Откуда вообще взялся диоксин? Массовое производство хлорфенолов и гербицидов началось в тридцатые-сороковые годы в США и Германии.
Но первое упоминание о диоксинах датировано лишь 1957 годом. Почему? Потому что они — продукт незапланированный, побочный. Назвать какого-то одного первооткрывателя диоксинов трудно. К их открытию привел многолетний опыт человеческих трагедий и сопоставлений по аналогии. Если бы от диоксинов не было столько вреда, может, их и открывать бы никогда не пришлось.
В начале 30-х годов фирмой "Дау Кемикал" (США) был разработан способ получения полихлорфенолов из полихлорбензолов щелочным гидролизом при высокой температуре под давлением и показано, что эти препараты, получившие название дауцидов, являются эффективными средствами для консервации древесины.
Уже в 1936 г. появились сообщения о массовых заболеваниях среди рабочих шт. Миссисипи, занятых консервацией древесины с помощью этих агентов. Большинство из них страдали тяжелым кожным заболеванием. В 1937 г. были описаны случаи аналогичных заболеваний среди рабочих завода в Мидланде (шт. Мичиган, США), занятых в производстве дауцидов. Расследование причин поражения в этих и многих подобных случаях привело к заключению, что хлоракногенный фактор присутствует только в технических дауцидах, а чистые полихлорфенолы подобным действием не обладают.
Расширение масштабов поражения полихлорфенолами в дальнейшем было обусловлено их использованием в военных целях. Во время второй мировой войны в США были получены первые гербицидные препараты гормоноподобного действия на основе 2,4-дихлор- и 2,4,5-трихлорфеноксиуксусных кислот (2,4-Д и 2,4,5-Т). Эти препараты разрабатывались для поражения растительности Японии и были приняты на вооружение армией США вскоре после войны. Одновременно эти кислоты, их соли и эфиры стали использоваться для химической прополки сорняков в посевах злаковых культур, а смеси эфиров 2,4-Д и 2,4,5-Т - для уничтожения нежелательной древесной и кустарниковой растительности. Это позволило военно-промышленным кругам США создать крупнотоннажные производства 2,4-дихлор-, 2,4,5-трихлорфенолов, а на их основе кислот 2,4-Д и 2,4,5-Т.
Изучение свойств 2,4-Д и ее производных явилось мощным импульсом к становлению современной химии гербицидов. Совсем по-иному развивались события, связанные с расширением масштабов производства и применения 2,4,5-Т.
В 1949 стало извесно о массовом заболевании, проявляющемся в виде множества покрывающих кожу незаживающих фурункулов, которое имело место после взрыва на заводе «Nitro» в американском штате Виржиния. На предприятии производился 2,4,5-трихлорфенол. Пострадали тогда двести с лишним человек, и примерно у половины из них обнаружили симптомы какой-то новой болезни. Впрочем, сразу же вспомнили, что известна эта болезнь еще с конца прошлого века и даже название имеет — хлоракне (тогда немецкие врачи сочли ее чисто кожной и причину усмотрели единственно в действии хлора). 32 человека тогда же скончались. Более половины оставшихся в живых не смогли излечиться вплоть до последних лет.
В 50-е годы появились сообщения о частых поражениях техническими 2,4,5-Т и трихлорфенолом. 1953 год. Авария на заводе фирмы «BASF» в ФРГ. И снова у 55 пострадавших — хлоракне. 1956 год. Взрыв на заводе фирмы «Rone Poulenc» во Франции. И снова та же странная болезнь, возбудитель которой неизвестен, но теперь хоть все поняли, что это точно не хлор...
Между тем тогда в ФРГ и США над проблемой хлоракне работало несколько групп ученых. Г. Гофман (ФРГ) выделил в чистом виде хлоракногенный фактор технического трихлорфенола, изучил его свойства, физиологическую активность и приписал ему строение тетрахлордибензофурана. Синтезированный образец этого соединения действительно оказывал на животных такое же действие, как и технический трихлорфенол.
В это же время К. Шульц (ФРГ), специалист в области кожных заболеваний, обратил внимание на то, что симптоматика поражения его клиента, работающего с хлорированными дибензо-пара-диоксинами, идентична симптоматике поражения техническим трихлорфенолом. Проведенные им исследования показали, что хлоракногенным фактором технического трихлорфенола действительно является 2,3,7,8-тетрахлордибензо-пара-диоксин (диоксин) - неизбежный побочный продукт щелочной переработки симметричного тетрахлорбензола. Позже сведения К. Шульца получили подтверждение в работах других ученых.
Высокая токсичность диоксина была установлена в 1957 г. и в США. Это произошло после несчастного случая с американским химиком Дж. Дитрихом, который, занимаясь синтезом диоксина и его аналогов, получил сильное поражение, напоминающее поражение техническим трихлорфенолом, и был госпитализирован на длительный срок. Этот факт, как и многие другие инциденты на производствах трихлорфенола, был скрыт от общественности, а синтезированные американским химиком галогенированные дибензо-п-диоксины изъяты для изучения военным ведомством.
Далее-то открытия следуют по нарастающей. Удается, например, установить, что причиной азиатских болезней Юшо и Ю-Ченг (названы они в память соответственно японского и тайваньского поселков, жители которых пострадали в 60—70-е годы от жестокого отравления) послужил собрат классического диоксина — тетрахлордибензофуран, формула которого уже изображена выше. Общее число пострадавших при этих двух катастрофах составило примерно четыре тысячи человек.
К этому времени, несмотря на высокую токсичность, 2,4,5-трихлорфенол проник во многие сферы производства. Его натриевая и цинковая соли, а также продукт переработки - гексахлорофен стали широко применяться в качестве биоцидных препаратов в технике, сельском хозяйстве, текстильной и бумажной промышленности, в медицине и т.д. На основе этого фенола приготавливались инсектициды, препараты для нужд ветеринарии, технические жидкости различного назначения. Однако наиболее широкое применение 2,4,5-трихлорфенол нашел в производстве 2,4,5-Т и других гербицидов, предназначенных не только для мирных, но и для военных целей. В результате к 1960 г. производство трихлорфенола достигло внушительного уровня - многих тысяч тонн в год.
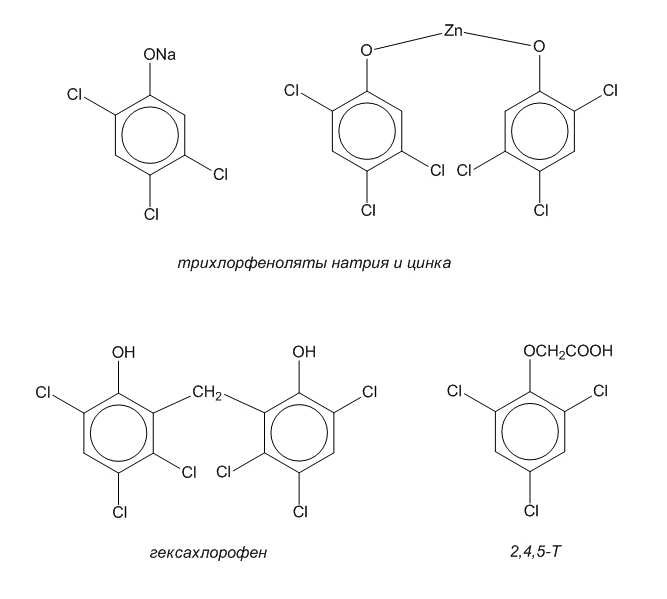 Биоцидные и гербицидные препараты, получаемые из трихлорфенола. |
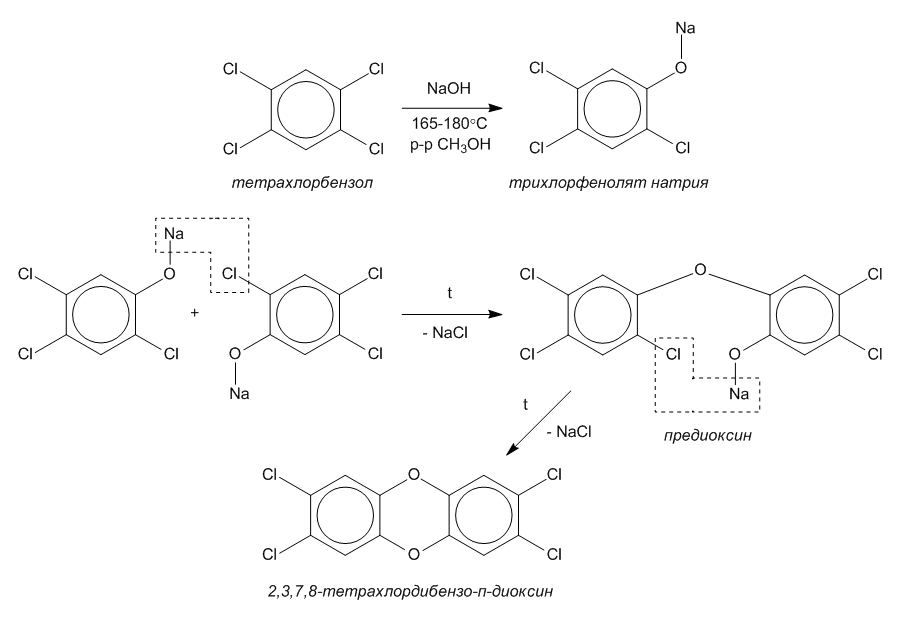 Схема образования диоксина при щелочном гидролизе тетрахлорбензола. Эту реакцию
обычно проводят в растворе метанола (СН3ОН) под давлением при температуре выше 165°С.
Образующийся при этом трихлорфенолят натрия всегда частично превращается в предиоксин, а затем в
диоксин. С повышением температуры до 210°С скорость этой побочной реакции резко возрастает, а
в более жестких условиях основным продуктом реакции становится диоксин. В этом случае процесс
неконтролируем и в производственных условиях завершается взрывом. |
Но диоксин является причиной куда более серьезных болезней чем хлоракне. Это начали понимать только после американо-вьетнамской войны. За период с 1961 по 1970 годы американская армия под предлогом борьбы с партизанами распылила на территории Южного Вьетнама 57 тысяч тонн дефолианта «Agent Orange» для уничтожения растительности. Подобные операции пришлось прекратить из-за многочисленных сообщений о раковых и других заболеваниях участников событий, в том числе и военнослужащих США и Австралии, о рождении у них детей-уродов.
Интересно, что сам по себе этот препарат с таким красивым названием (видите, красота опять обманчива) не может вызвать ничего подобного. Но из-за несовершенства его производства упомянутые 57 тысяч тонн дефолианта содержали 170 кг (0,0003 процента!) диоксина, который и наделал столько бед.
| Рецептура | К о м п о н е н т ы | |
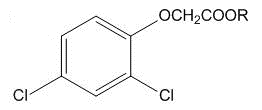 |
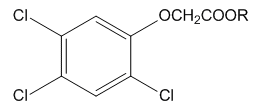 |
|
| Оранж I | R=C4H9[50%]* | R=C4H9[50%] |
| Оранж II | R=C4H9[50%] | R=C8H17[50%] |
| Пурпурная | R=C4H9[50%] | R=C4H9[30%] i-C4H9[20%] |
| Розовая | R=C4H9[60%] | R=C4H9[40%] |
| Зеленая | --- | R=C4H9[90%] |
| Диноксол | R=CH2CH2OC4H9[50%] | R=CH2CH2OC4H9[50%] |
| Триноксол | --- | R=CH2CH2OC4H9[40%] |
*Процентное содержание данного компонента в рецептуре
Для сравнения отметим, что массовое отравление в итальянском городе Севезо вызвали какие-то несколько килограммов диоксина. При ликвидации последствий этой катастрофы с большой территории пришлось удалять поверхностный слой почвы.
Тем временем в нашей печати, как в научной, так и массовой, до 1985 года диоксинам вообще не было посвящено ни одной публикации. В пятитомной «Краткой химической энциклопедии» (1961 г.) равно как и в изданном значительно позднее «Химическом энциклопедическом словаре» даже слова такого нет! Более того, листая старые подшивки санитарных журналов и сборников, можно найти сообщения о том, что в Уфе с 1964 по 1970 годы работал цех по производству того самого гербицида, который американцы называют «Agent Orange». И 128 человек из 165 обслуживающего персонала заболели неизвестной болезнью, по симптомам совпадающей с хлоракне. Данные эти (без географической привязки) перекочевали в зарубежную печать. А из отечественной прессы они странным (или не очень странным) образом исчезли. Кстати, тот цех реконструировали, потом закрыли. Но что стало с отходами производства — о том молчание. Вы скажете: в те времена иначе и не бывало. Но не повторяем ли мы сегодня ошибки прошлого? Вспомните недавние события в Уфе. Фенолы попали в хлорируемую воду — вот и создались прекрасные условия для образования диоксинов. К тому же они могли сопутствовать фенолам из-за несовершенства технологии производства последних.
ЧТО ИЗВЕСТНО О СВОЙСТВАХ ДИОКСИНА
Диоксин - кристаллическое вещество с высокой температурой плавления (305°С) и очень низкой летучестью, плохо растворяющееся в воде (2x10-8% при 25°С) и лучше - в органических растворителях. Он отличается высокой термической стабильностью: его разложение отмечается лишь при нагревании выше 750°С, а эффективно осуществляется при 1000°С.
Диоксин - химически инертное вещество. Кислотами и щелочами он не разлагается даже при кипячении. В характерные для ароматических соединений реакции хлорирования и сульфирования он вступает только в очень жестких условиях и в присутствии катализаторов. Замещение атомов хлора молекулы диоксина на другие атомы или группы атомов осуществляется лишь в условиях свободнорадикальных реакций. Некоторые из этих превращений, например взаимодействие с натрий-нафталином и восстановительное дехлорирование при ультрафиолетовом облучении, используются для уничтожения небольших количеств диоксина. При окислении в безводных условиях диоксин легко отдает один электрон и превращается в стабильный катион-радикал, который, однако, легко восстанавливается водой в диоксин с выделением очень активного катион-радикала НО+•. Характерной для диоксина является его способность к образованию прочных комплексов с многими природными и синтетическими полициклическими соединениями.
Токсические свойства. Диоксин - тотальный яд, поскольку даже в относительно малых дозах (концентрациях) он поражает практически все формы живой материи - от бактерий до теплокровных. Токсичность диоксина в случае простейших организмов обусловлена, по-видимому, нарушением функций металлоферментов, с которыми он образует прочные комплексы. Значительно сложнее происходит поражение диоксином высших организмов, особенно теплокровных. В организме теплокровных диоксин первоначально попадает в жировые ткани, а затем перераспределяется, накапливаясь преимущественно в печени, затем в тимусе и других органах. Его разрушение в организме незначительно: он выводится в основном неизменным, в виде комплексов неустановленной пока природы. Период полувыведения колеблется от нескольких десятков дней (мышь) до года и более (приматы) и обычно возрастает при медленном поступлении в организм. С повышением удерживаемости в организме и избирательного накопления в печени чувствительность особей к диоксину возрастает.
При остром отравлении животных наблюдаются признаки общетоксического действия диоксина: потеря аппетита, физическая и половая слабость, хроническая усталость, депрессия и катастрофическая потеря веса. К летальному исходу он приводит через несколько дней и даже через несколько десятков дней, в зависимости от дозы яда и скорости его поступления в организм.
В нелетальных дозах диоксин вызывает тяжелые специфические заболевания. У высокочувствительных особей первоначально появляется заболевание кожи - хлоракне (поражение сальных желез, сопровождающееся дерматитами и образованием долго незаживающих язв), причем у людей хлоракне может проявляться снова и снова даже через многие годы после излечения. Более сильное поражение диоксином приводит к нарушению обмена порфиринов - важных предшественников гемоглобина и простетических групп железосодержащих ферментов (цитохромов). Порфирия - так называется это заболевание - проявляется в повышенной фоточувствительности кожи: она становится хрупкой, покрывается многочисленными микропузырьками. При хроническом отравлении диоксином развиваются также различные заболевания, связанные с поражениями печени, иммунных систем и центральной нервной системы.
Все эти заболевания проявляются на фоне резкой активации диоксином (в десятки и сотни раз) важного железосодержащего фермента - цитохрома Р-448. Особенно сильно активируется этот фермент в плаценте и в плоде, в связи с чем диоксин даже в ничтожных количествах подавляет жизнеспособность, нарушает процессы формирования и развития нового организма, иными словами, оказывает эмбриотоксическое и тератогенное действие. В ничтожных концентрациях диоксин вызывает генетические изменения в клетках пораженных особей и повышает частоту возникновения опухолей, т.е. обладает мутагенным и канцерогенным действием.
| Вид | ЛД*50, мг/кг |
| Морская свинка | 0,001 |
| Крыса | 0,050 |
| Мышь | 0,112 |
| Кошка | 0,115 |
| Собака | 0,3 |
| Куры | 0,5 |
| Куриный эмбрион | 0,0005 |
| Гуппи | 0,1 ppm** |
| Echerichia coli | 2-4 ppm** |
| Salmonella tiphimurium | 2-3 ppm** |
*ЛД50 - обозначение, принятое в токсикологии для дозы, вызывающей в 50% летальный исход.
**Летальная концентрация.
Поведение в окружающей среде. В биосфере диоксин быстро поглощается растениями, сорбируется почвой и различными материалами, где практически не изменяется под влиянием физических, химических и биологических факторов среды. Благодаря способности к образованию комплексов, он прочно связывается с органическими веществами почвы, купируется в остатках погибших почвенных микроорганизмов и омертвевших частях растений. Период полураспада диоксина в природе превышает 10 лет. Таким образом, различные объекты окружающей среды являются надежными хранилищами этого яда.
Дальнейшее поведение диоксина в окружающей среде определяется свойствами объектов, с которыми он связывается. Его вертикальная и горизонтальная миграции в почвах возможны только для ряда тропических районов, где в почвах преобладают водорастворимые органические вещества. В почвах остальных типов, содержащих нерастворимые в воде органические вещества, он прочно связывается в верхних слоях и постепенно накапливается в остатках погибших организмов.
Из почв диоксин выводится преимущественно механическим путем. Отличающиеся низкой плотностью комплексы диоксина с органическими веществами, а также содержащие его остатки погибших организмов выдуваются с поверхности почвы ветром, вымываются дождевыми потоками и в итоге устремляются в низменности и акватории, создавая новые очаги заражения (места скопления дождевой воды, озера, донные отложения рек, каналов, прибрежной зоны морей и океанов).
Проведенные недавно анализы почв некоторых районов Южного Вьетнама указывают на сравнительно небольшое содержание диоксина в поверхностных слоях и на его появление в концентрации до 30 частей на триллион (30 ppt) в глубинных частях почвы. Это свидетельствует о том, что физический и механический перенос в условиях тропиков способствует эффективному рассеянию яда в природе. Однако это не единственный путь миграции диоксина в биосфере. Существует еще перенос этого яда по цепям питания, который способствует его постоянному накоплению в районах максимального потребления зараженных им продуктов питания, т.е. концентрированию в густонаселенных районах.
По мнению вьетнамского ученого и хирурга профессора Тон Тхат Тунга, эффективный биоперенос диоксина в природе способствует постоянному его накоплению теплокровными, причем степень накопления диоксина теплокровными возрастает с увеличением содержания яда в окружающей среде. Это заключение явилось результатом многолетнего изучения последствий прошедшей химической войны для обширных контингентов десятимиллионного населения Вьетнама, проживавших и (или) проживающих в районах применения так называемых "безвредных для человека и окружающей среды" гербицидов.
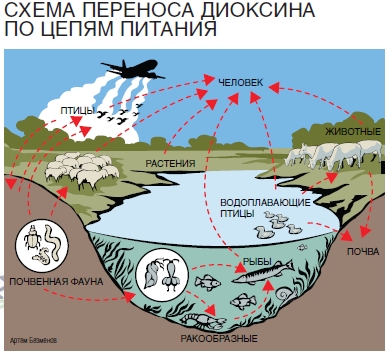 Попадая в почву, диоксин поглощается
растениями (особенно их подземной частью), почвенной фауной, через которую
передается по цепи питания птицам и другим
животным. Вынесенный из почв воздушными и водными потоками в акватории, диоксин через
зоопланктон, рачков и рыб также попадает к птицам и млекопитающим. Иными словами, с растительной,
мясной, молочной (особенно!) и рыбной продукцией, полученной с зараженной территории, диоксин так или
иначе попадет на стол к человеку. Высокая стабильность этого яда благоприятствует его многократной
циркуляции по цепям питания. |
Составил В.Н. Витер.
Использованы материалы журналов Природа, Химия и жизнь, а также Википедии.
Использованы материалы журналов Природа, Химия и жизнь, а также Википедии.