Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Многие физики считают химию "естественной" наукой, начисто лишенной
математической логики и строгости. Отчасти они правы: долгое время химия была
чисто экспериментальной наукой. Работами Гиббса, Полинга, Ландау, Пригожина,
Бора, Борна, Гейзенберга, Паули и другими была создана новая химия, мало
отличающаяся от физики по "математизации".
Продолжительное время оставался открытым вопрос о теоретическом предсказании возможности протекания реакции между двумя веществами (далее речь пойдет о термодинамической возможности). Эта проблема была решена исходя из устойчивости состояний с минимальным значением термодинамического потенциала. В нашей статье мы рассмотрим энергию Гиббса. Запишем основное уравнение термодинамики (обобщенный I и II законы).

продифференцируем обе части по времени:
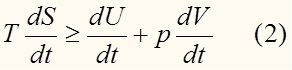
При P = const, T = const:
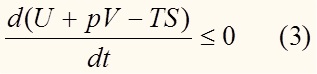
U + pV - TS = G – по определению, таким образом:
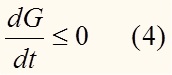
То есть энергия Гиббса есть убывающая функция времени (в системе без внешних воздействий). Иными словами, при протекании самопроизвольных процессов энергия Гиббса убывает: dG < 0. Проинтегрировав, получим: ΔG < 0.
Это условие накладывается и на химические реакции, если они протекают самопроизвольно. Данный вывод относится только к закрытым системам. Но в природе существуют, и протекают реакции, с положительной энергией Гиббса. Например, такой реакцией является синтез белка в нашем организме. Это кажущееся противоречие разрешается в рамках неравновесной термодинамики.

где знак равенства соответствует обратимому процессу. Знак больше соответствует необратимому, самопроизвольному процессу. Знак больше говорит о том, что изменение энтропии при таком процессе больше, чем .
.
Клаузиус ввел понятие нескомпенсированной теплоты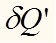 :
:
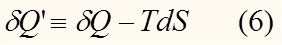
Таким образом нескомпенсированная теплота это не какая-то реально выделившееся или поглотившееся теплота, а такое количество теплоты, которое необходимо добавить к в неравенстве (5), чтобы обратить его в тождество. В то же время
неравенство (5) можно переписать в виде:
в неравенстве (5), чтобы обратить его в тождество. В то же время
неравенство (5) можно переписать в виде:

Сравнивая (6) и (7) легко заметить, что .
.
Бельгийская школа термодинамики (Пригожин, Де Донде) изменение энтропии представляет в виде:

где deS – изменение энтропии, обусловленное обменом системы с внешней средой энергией и веществом,
diS – изменение энтропии, обусловленная необратимыми процессами, протекающими внутри системы (например химическая реакция)
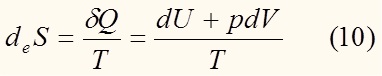
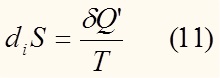
Согласно (8) и учитывая положительность абсолютной термодинамической температуры, можно заключить, что:
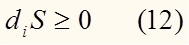
Действительно, сложив уравнение (10) с (11) и разделив на T, получим уравнение (6).
Закон возрастания энтропии справедлив только для изолированных систем (таких систем, которые не обмениваются с внешней средой ни веществом, ни энергией). Его формулировка: в изолированных системах энтропия может только возрастать или оставаться неизменной.

Индексы U, V указывают что изменение энтропии происходит при постоянной внутренней энергии и объеме (т.е в изолированной системе).
Используя уравнения (10) и (12) можно записать обобщенный второй закон термодинамики:
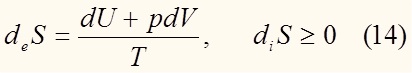
При этом diS и deS независимы друг от друга.
В случае изолированной системы, когда U=const, V=const, согласно (14) и (9) (напомним, что дифференциал константы равен нулю):
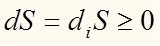
То есть мы получили обычный закон возрастания энтропии (13)
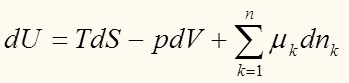
Где μ - химический потенциал
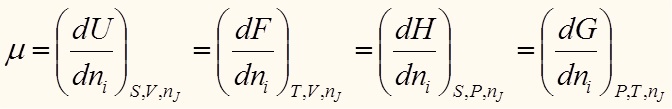
Выразим отсюда TdS:

Изменение числа молей k-ого компонента может происходить за счет обмена с внешней средой, или за счет процессов, протекающих внутри самой системы (например, химической реакции):
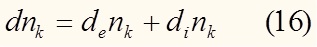
Это разделение эквивалентно разделению изменения энтропии (9).
Разделив выражение (15) на T, и используя (9) и (16) имеем:
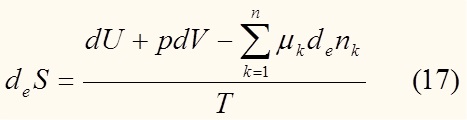
Де Донде показал, что:

Знак ≥ 0 мы поставили на основании (12)
Рассмотрим гипотетическую химическую реакцию :
A + B = 2C
При этом изменения количеств веществ, участвующих в реакции связанны между собой:
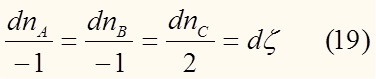
Знак " - " стоит при исходных веществах т.к. их количество с течением времени уменьшается. Величина ξ (кси) называется степенью полноты реакции. Это удобно тем, что с помощью одной переменной можно описать состояние всех участников реакции в более обобщенном виде:
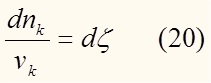
Выражая отсюда dnk и подставляя в (18) имеем:

Конкретно для нашей реакции A + B = 2C имеем:
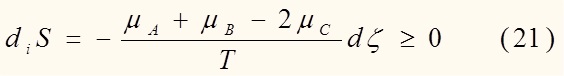
Величина

называется химическим сродством.
Химическое сродство отражает в данный момент времени состояние системы (реакционной смеси). При P = const, T = const

Как мы выяснили ранее, при самопроизвольных процессах dG ≤ 0, значит:

Как видно из этого уравнения, процесс (химическая реакция) идет таким образом, чтобы выровнялись химические потенциалы во всех точках системы. В связи с этим состояние системы при протекании необратимого процесса характеризует химическое сродство. Оно характеризует как - бы "разность химических потенциалов". Ясно, что чем сродство больше, тем интенсивнее будет протекать процесс.
С учетом (22) выражение (21) можно переписать в виде:

Сравнивая уравнение (23) с (11), имеем:
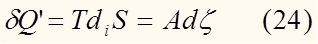
Продифференцируем (23) по времени:
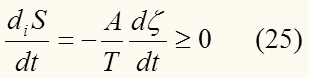
Теперь необходимо уяснить смысл дроби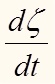 . Производная по времени
означает скорость изменения степени полноты реакции.
. Производная по времени
означает скорость изменения степени полноты реакции.
Напомним, что по определению:
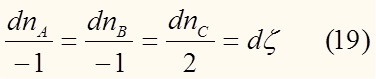
Рассмотрим более подробно уравнение (25). Здесь возможно три случая:
1. A > 0 , следовательно исходя из (25), того что T > 0, dt > 0 (время не может течь назад) имеем: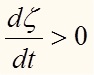 (рис.1) т.е. изменение степени полноты реакции положительно.
(степень полноты реакции как функция времени возрастает).
(рис.1) т.е. изменение степени полноты реакции положительно.
(степень полноты реакции как функция времени возрастает).
Исходя из определения это означает что dnc > 0 и dna < 0, dnb < 0, то есть количество продуктов реакции в случае положительного значения сродства увеличивается. (а исходных уменьшается).
Идет превращение исходных веществ в продукты реакции.
2. A < 0, следовательно исходя из (25), того что T > 0, dt > 0 (время не может течь назад) имеем: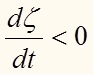 (рис.2) т.е. изменение полноты реакции отрицательно (степень
полноты реакции как функция времени убывает).
(рис.2) т.е. изменение полноты реакции отрицательно (степень
полноты реакции как функция времени убывает).
Исходя из определения это означает что dnc < 0 и dna > 0, dnb > 0, то есть количество продуктов реакции в случае отрицательного значения сродства уменьшается (а количество исходных веществ увеличивается).
Идет превращение продуктов в исходные вещества.
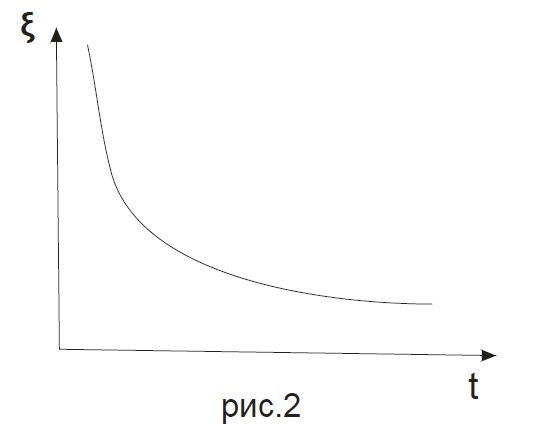
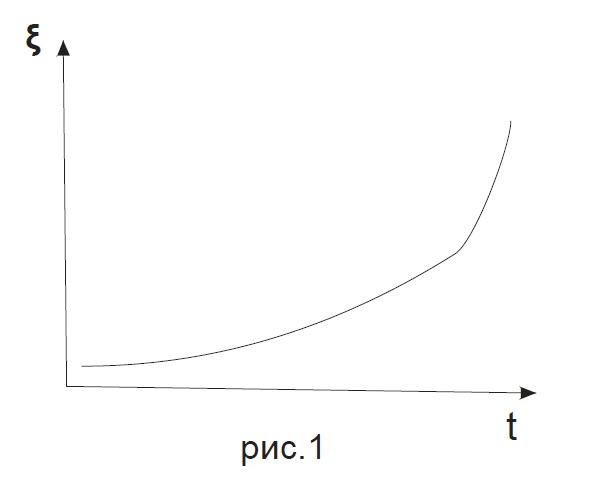
3. A = 0 Это соответствует полному термодинамическому равновесию. Количества исходных веществ и продуктов реакции остаются постоянными. Степень полноты реакции достигает постоянного равновесного значения (степень полноты реакции как функция времени постоянна (прямая) ξ(t) = ξeq = const (рис.3)

При этом зависимость химического сродства от степени полноты реакции будет иметь следующий вид:
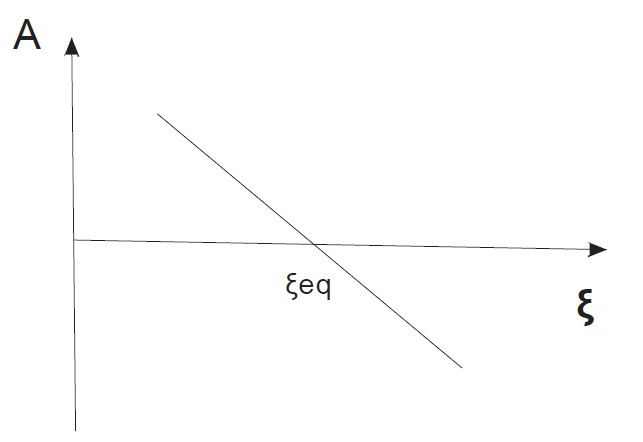
Химическое сродство в момент термодинамического равновесия равно нулю. Этому соответствует какое-то равновесное значение степени полноты реакции (ξeq). Как видно из графика при переходе через это равновесное значение химическое сродство меняет знак.
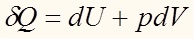
Согласно уравнению (6)

Значит:
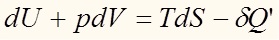
Выразим отсюда dU:

При постоянной энтропии и объеме (при постоянстве характеристических переменных термодинамического потенциала – внутренней энергии) имеем:
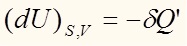
Аналогичные выражения можно получить для всех термодинамических потенциалов:
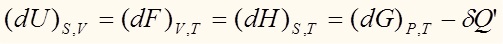
Как уже было сказано выше, из всех потенциалов нас более всего будет интересовать энергия Гиббса:
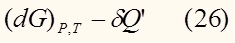
То есть при постоянной температуре и давлении изменение энергии Гиббса равно с обратным знаком нескомпенсированной теплоте.
Из уравнения (24) видно, что:
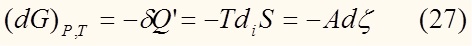
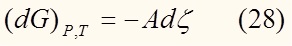
Раздели обе части на dξ:
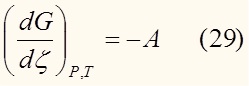
Уравнение (29) является одним из важнейших в данной статье, и наиболее полно раскрывает суть понятия химического сродства.
Согласно (29) химическое сродство – производная энергии Гиббса по степени полноты реакции при постоянной температуре и давлении.
В состоянии равновесия энергия Гиббса имеет минимум. Необходимое условие минимума – равенство нулю первой производной. А это исходя из (29) возможно только в случае А = 0 (третий случай в предыдущем пункте).
Химическое сродство – универсальная величина, показывающая то, как глубоко (интенсивно) будут взаимодействовать между собой вещества. Являясь универсальной мерой термодинамической активности, химическое сродство отражает фундаментальное стремление всех веществ в конечном итоге достигнуть состояния термодинамического равновесия.
Рассмотрим график зависимости энергии Гиббса от степени полноты реакции ξ:
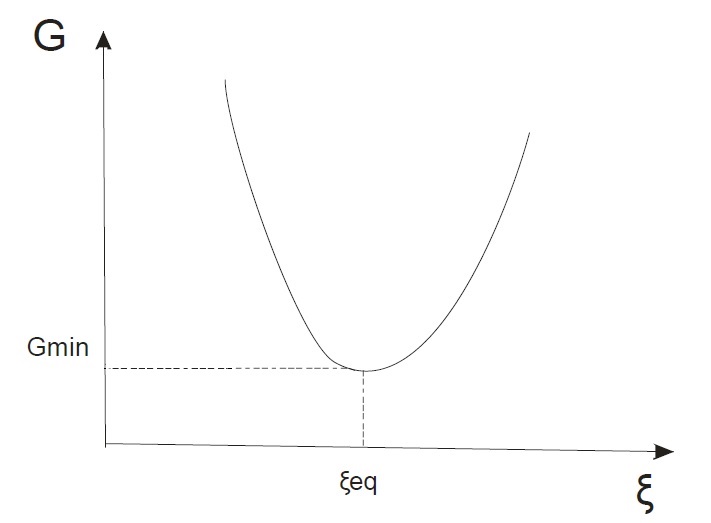
Как видно из графика, энергия Гиббса как функция степени полноты реакции имеет минимум (напомним, что давление и температура постоянны). Этому минимуму на оси ξ соответствует равновесное значение степени полноты реакции. Этот минимум отвечает устойчивому состоянию термодинамического равновесия, при котором энергия Гиббса минимальна.
Снова рассмотрим три случая:
1. A > 0
Т.к. А > 0, dG < 0 (это всегда так согласно (4)) значит dξ > 0 т.е. идет превращение исходных веществ в продукты. На графике этой ситуации соответствует левая ветвь (с увеличением степени полноты реакции энрегия Гиббса убывает).
2. A < 0.
Т.к. А < 0, dG < 0 (это всегда так согласно (4)) значит dξ < 0 т.е. идет превращение продуктов реакции в исходные вещества. На графике этой ситуации соответствует правая ветвь (с увеличением степени полноты реакции энергия Гиббса возрастает).
3. A = 0.
Равенство нулю первой производной энергии Гиббса по степени полноты реакции означает ее экстремум. Решая уравнение (зная конкретную зависимость G от ξ):
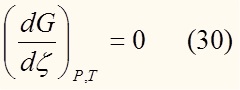
найдем равновесное значение степени полноты реакции ξeq (абсциссу экстремума). Слева от этой точки производная отрицательная, справа – положительная. Из этого следует заключить, что этот экстремум является минимумом (вспомним 10 класс). Как мы выяснили, минимуму энергии Гиббса соответствует термодинамическое равновесие.
Мы получили тот же результат, что и в предыдущем пункте, но используя не второй закон термодинамики, а свойство термодинамических потенциалов (в данном случае энергии Гиббса). Те же рассуждения можно повторить и для оставшихся термодинамических потенциалов, при постоянстве их характеристических переменных (для энергии Гиббса это P и Т).
Таким образом, химическое сродство является очень важным понятием для химии. В случае химических реакций оно характеризует стремление системы к равновесию (в данном случае к химическому). Сродство является одним из базовых понятий неравновесной термодинамики, являясь закономерным развитием феноменологической термодинамики.
Составил Новиков Д.В.
Список литературы:
Продолжительное время оставался открытым вопрос о теоретическом предсказании возможности протекания реакции между двумя веществами (далее речь пойдет о термодинамической возможности). Эта проблема была решена исходя из устойчивости состояний с минимальным значением термодинамического потенциала. В нашей статье мы рассмотрим энергию Гиббса. Запишем основное уравнение термодинамики (обобщенный I и II законы).
продифференцируем обе части по времени:
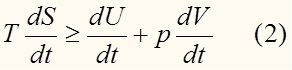
При P = const, T = const:
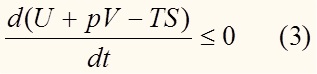
U + pV - TS = G – по определению, таким образом:
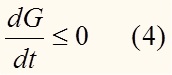
То есть энергия Гиббса есть убывающая функция времени (в системе без внешних воздействий). Иными словами, при протекании самопроизвольных процессов энергия Гиббса убывает: dG < 0. Проинтегрировав, получим: ΔG < 0.
Это условие накладывается и на химические реакции, если они протекают самопроизвольно. Данный вывод относится только к закрытым системам. Но в природе существуют, и протекают реакции, с положительной энергией Гиббса. Например, такой реакцией является синтез белка в нашем организме. Это кажущееся противоречие разрешается в рамках неравновесной термодинамики.
2. Нескомпенсированная теплота и производство энтропии
Второй закон термодинамики обычно записывают в виде:
где знак равенства соответствует обратимому процессу. Знак больше соответствует необратимому, самопроизвольному процессу. Знак больше говорит о том, что изменение энтропии при таком процессе больше, чем
 .
.Клаузиус ввел понятие нескомпенсированной теплоты
Таким образом нескомпенсированная теплота это не какая-то реально выделившееся или поглотившееся теплота, а такое количество теплоты, которое необходимо добавить к

Сравнивая (6) и (7) легко заметить, что
Бельгийская школа термодинамики (Пригожин, Де Донде) изменение энтропии представляет в виде:
где deS – изменение энтропии, обусловленное обменом системы с внешней средой энергией и веществом,
diS – изменение энтропии, обусловленная необратимыми процессами, протекающими внутри системы (например химическая реакция)
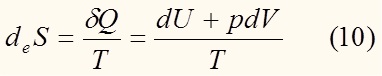
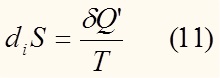
Согласно (8) и учитывая положительность абсолютной термодинамической температуры, можно заключить, что:
Действительно, сложив уравнение (10) с (11) и разделив на T, получим уравнение (6).
Закон возрастания энтропии справедлив только для изолированных систем (таких систем, которые не обмениваются с внешней средой ни веществом, ни энергией). Его формулировка: в изолированных системах энтропия может только возрастать или оставаться неизменной.
Индексы U, V указывают что изменение энтропии происходит при постоянной внутренней энергии и объеме (т.е в изолированной системе).
Используя уравнения (10) и (12) можно записать обобщенный второй закон термодинамики:
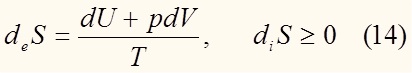
При этом diS и deS независимы друг от друга.
В случае изолированной системы, когда U=const, V=const, согласно (14) и (9) (напомним, что дифференциал константы равен нулю):
То есть мы получили обычный закон возрастания энтропии (13)
3. Химическое сродство
Все наши рассуждения до этого момента касались систем с постоянным числом частиц. Теперь же мы обобщим наши рассуждения на случай переменного числа частиц. Запишем фундаментальное уравнение (The fundamental equation, как его называют в англоязычной литературе):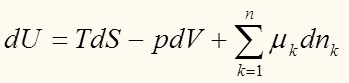
Где μ - химический потенциал
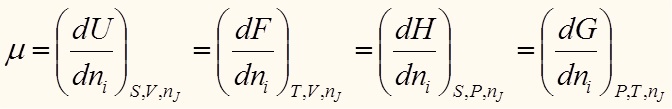
Выразим отсюда TdS:

Изменение числа молей k-ого компонента может происходить за счет обмена с внешней средой, или за счет процессов, протекающих внутри самой системы (например, химической реакции):
Это разделение эквивалентно разделению изменения энтропии (9).
Разделив выражение (15) на T, и используя (9) и (16) имеем:
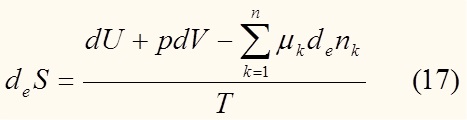
Де Донде показал, что:

Знак ≥ 0 мы поставили на основании (12)
Рассмотрим гипотетическую химическую реакцию :
При этом изменения количеств веществ, участвующих в реакции связанны между собой:
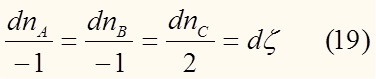
Знак " - " стоит при исходных веществах т.к. их количество с течением времени уменьшается. Величина ξ (кси) называется степенью полноты реакции. Это удобно тем, что с помощью одной переменной можно описать состояние всех участников реакции в более обобщенном виде:
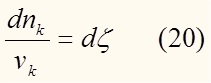
Выражая отсюда dnk и подставляя в (18) имеем:

Конкретно для нашей реакции A + B = 2C имеем:
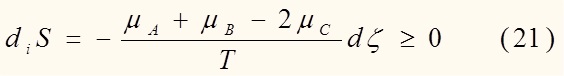
Величина
называется химическим сродством.
Химическое сродство отражает в данный момент времени состояние системы (реакционной смеси). При P = const, T = const

Как мы выяснили ранее, при самопроизвольных процессах dG ≤ 0, значит:

Как видно из этого уравнения, процесс (химическая реакция) идет таким образом, чтобы выровнялись химические потенциалы во всех точках системы. В связи с этим состояние системы при протекании необратимого процесса характеризует химическое сродство. Оно характеризует как - бы "разность химических потенциалов". Ясно, что чем сродство больше, тем интенсивнее будет протекать процесс.
С учетом (22) выражение (21) можно переписать в виде:

Сравнивая уравнение (23) с (11), имеем:
Продифференцируем (23) по времени:
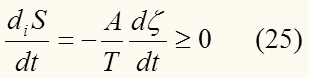
Теперь необходимо уяснить смысл дроби
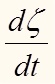 . Производная по времени
означает скорость изменения степени полноты реакции.
. Производная по времени
означает скорость изменения степени полноты реакции.Напомним, что по определению:
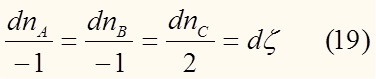
1. A > 0 , следовательно исходя из (25), того что T > 0, dt > 0 (время не может течь назад) имеем:
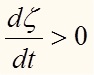 (рис.1) т.е. изменение степени полноты реакции положительно.
(степень полноты реакции как функция времени возрастает).
(рис.1) т.е. изменение степени полноты реакции положительно.
(степень полноты реакции как функция времени возрастает).Исходя из определения это означает что dnc > 0 и dna < 0, dnb < 0, то есть количество продуктов реакции в случае положительного значения сродства увеличивается. (а исходных уменьшается).
Идет превращение исходных веществ в продукты реакции.

2. A < 0, следовательно исходя из (25), того что T > 0, dt > 0 (время не может течь назад) имеем:
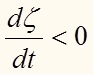 (рис.2) т.е. изменение полноты реакции отрицательно (степень
полноты реакции как функция времени убывает).
(рис.2) т.е. изменение полноты реакции отрицательно (степень
полноты реакции как функция времени убывает).Исходя из определения это означает что dnc < 0 и dna > 0, dnb > 0, то есть количество продуктов реакции в случае отрицательного значения сродства уменьшается (а количество исходных веществ увеличивается).
Идет превращение продуктов в исходные вещества.

3. A = 0 Это соответствует полному термодинамическому равновесию. Количества исходных веществ и продуктов реакции остаются постоянными. Степень полноты реакции достигает постоянного равновесного значения (степень полноты реакции как функция времени постоянна (прямая) ξ(t) = ξeq = const (рис.3)

При этом зависимость химического сродства от степени полноты реакции будет иметь следующий вид:

Химическое сродство в момент термодинамического равновесия равно нулю. Этому соответствует какое-то равновесное значение степени полноты реакции (ξeq). Как видно из графика при переходе через это равновесное значение химическое сродство меняет знак.
4. Связь термодинамических потенциалов с химическим сродством
Запишем первый закон термодинамики:Согласно уравнению (6)
Значит:
Выразим отсюда dU:
При постоянной энтропии и объеме (при постоянстве характеристических переменных термодинамического потенциала – внутренней энергии) имеем:
Аналогичные выражения можно получить для всех термодинамических потенциалов:
Как уже было сказано выше, из всех потенциалов нас более всего будет интересовать энергия Гиббса:
То есть при постоянной температуре и давлении изменение энергии Гиббса равно с обратным знаком нескомпенсированной теплоте.
Из уравнения (24) видно, что:
Раздели обе части на dξ:
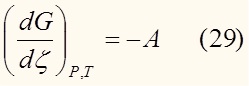
Уравнение (29) является одним из важнейших в данной статье, и наиболее полно раскрывает суть понятия химического сродства.
Согласно (29) химическое сродство – производная энергии Гиббса по степени полноты реакции при постоянной температуре и давлении.
В состоянии равновесия энергия Гиббса имеет минимум. Необходимое условие минимума – равенство нулю первой производной. А это исходя из (29) возможно только в случае А = 0 (третий случай в предыдущем пункте).
Химическое сродство – универсальная величина, показывающая то, как глубоко (интенсивно) будут взаимодействовать между собой вещества. Являясь универсальной мерой термодинамической активности, химическое сродство отражает фундаментальное стремление всех веществ в конечном итоге достигнуть состояния термодинамического равновесия.
Рассмотрим график зависимости энергии Гиббса от степени полноты реакции ξ:

Как видно из графика, энергия Гиббса как функция степени полноты реакции имеет минимум (напомним, что давление и температура постоянны). Этому минимуму на оси ξ соответствует равновесное значение степени полноты реакции. Этот минимум отвечает устойчивому состоянию термодинамического равновесия, при котором энергия Гиббса минимальна.
Снова рассмотрим три случая:
1. A > 0
Т.к. А > 0, dG < 0 (это всегда так согласно (4)) значит dξ > 0 т.е. идет превращение исходных веществ в продукты. На графике этой ситуации соответствует левая ветвь (с увеличением степени полноты реакции энрегия Гиббса убывает).
2. A < 0.
Т.к. А < 0, dG < 0 (это всегда так согласно (4)) значит dξ < 0 т.е. идет превращение продуктов реакции в исходные вещества. На графике этой ситуации соответствует правая ветвь (с увеличением степени полноты реакции энергия Гиббса возрастает).
3. A = 0.
Равенство нулю первой производной энергии Гиббса по степени полноты реакции означает ее экстремум. Решая уравнение (зная конкретную зависимость G от ξ):
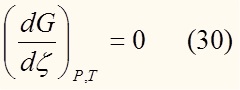
найдем равновесное значение степени полноты реакции ξeq (абсциссу экстремума). Слева от этой точки производная отрицательная, справа – положительная. Из этого следует заключить, что этот экстремум является минимумом (вспомним 10 класс). Как мы выяснили, минимуму энергии Гиббса соответствует термодинамическое равновесие.
Мы получили тот же результат, что и в предыдущем пункте, но используя не второй закон термодинамики, а свойство термодинамических потенциалов (в данном случае энергии Гиббса). Те же рассуждения можно повторить и для оставшихся термодинамических потенциалов, при постоянстве их характеристических переменных (для энергии Гиббса это P и Т).
Таким образом, химическое сродство является очень важным понятием для химии. В случае химических реакций оно характеризует стремление системы к равновесию (в данном случае к химическому). Сродство является одним из базовых понятий неравновесной термодинамики, являясь закономерным развитием феноменологической термодинамики.
- 1. И. Пригожин, Р.Дефей Химическая термодинамика, - Новосибирск: изд-во "Наука", 1966г.
- 2. И. Пригожин, Д. Кондепуди Современная термодинамика, - М: изд-во "Мир", 2002г.
- 3. Е.Н. Еремин Основы химической термодинамики - М: "Высшая школа", 1978г.