
| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 5 2011 |
|
Уроки техники безопасности (ТБ) - ч.4 А.Г. Кольчинский |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
IV. ОБЫДЕННЫЕ ЛАБОРАТОРНЫЕ ОПЕРАЦИИ
Казалось бы, что страшного в расфасовке реактивов? Никаких реакций, никакого нагревания. Переложили вещество из одной тары в другую, и все. Однако вспомним: чаще всего этим приходится заниматься, когда вещества слишком много. Отсюда и особая ответственность. Ведь 5 литров разлитого легко воспламеняющегося растворителя куда опаснее, чем 5 мл. Расфасовка больших количеств реактивов осложняется еще одним обстоятельством. Масштаб может "спровоцировать грубость" - в ход пойдут молотки, ломы, ведра и другие не очень химические предметы. Образование пыли, испарение веществ, опасность взрыва возрастают даже при аккуратной работе.
РАСФАСОВКА РЕАКТИВОВ От пыли достаточно надежно предохраняет респиратор и защитные очки. При работе с едкими, раздражающими кожу веществами обязательны перчатки, плотно прилегающая защитная одежда. Дымящиеся или легко испаряющиеся жидкости переливают так, чтобы свести к минимуму их контакт с атмосферой. Для этого удобнее всего сифон с грушей, позволяющей нагнетать воздух в сосуд с жидкостью. Стоит еще раз сказать, что многие жидкости (в том числе и горючие) при переливании способны сильно электризоваться, давать искру. Поскольку речь идет о диэлектриках, заземление помогает мало. Правильнее заполнить оба сосуда инертным газом, которым заодно можно создать необходимое для переливания избыточное давление. Само собой разумеется, что открытого огня (сигареты, искрящего выключателя или электроприбора) при этом быть не должно. Начиная расфасовку любого мало-мальски опасного вещества, химик обязан спросить себя: что я буду делать в случае аварии, если разобьется бутыль, прорвется мешок... Такой вопрос не позволит заниматься разливом кислот, не имея под рукой большой емкости с водой, аварийного душа или другого средства, позволяющего быстро смыть значительные количества кислоты. Этот же вопрос заставит перед расфасовкой токсичных веществ подготовить средства дегазации и противоядия. Существуют, однако, ситуации, при которых почти бесполезно заранее обдумывать свое поведение после аварии. Речь идет о расфасовке потенциально взрывчатых веществ. Здесь все усилия должны быть направлены на то, чтобы исключить ЧП. Полезно помнить, какую опасность зачастую представляют слеживающиеся и склонные к образованию комьев вещества. Мало-взрывчатые соединения при этом едва ли не опаснее настоящих взрывчаток: своим относительно мирным нравом они усыпляют бдительность. Долгое время самым крупным взрывом за всю историю человечества считался взрыв склада двойной соли - сульфата и нитрата аммония в Оппау (Германия). Слежавшееся удобрение дробили небольшими взрывами, что, по-видимому, и вызвало детонацию во всей массе вещества, считавшегося ранее безопасным. Взрыв оказался настолько мощным, что наряду с сильными разрушениями в самом Оппау дома были разрушены и в Мангейме, отстоящем на 6 км. Взрывной волной были выбиты стекла на расстоянии до 70 км. Если реактив очень уж слежался - не лучше ли его растворить, не прибегая к молотку? Вот о чем стоит подумать прежде чем браться за инструмент. При расфасовке больших количеств веществ, особенно если речь идет о пылящих или легко испаряющихся соединениях, возникает соблазн проделать эту операцию на открытом воздухе. Встав с наветренной стороны, избавляешь себя от пыли и паров. Необходимо, однако, учесть, что и здесь под рукой должны быть средства ликвидации возможной аварии, И еще одно: погода преподносит сюрпризы. Автору этих строк, взявшемуся однажды нарезать и расфасовать 2 кг металлического калия, пришлось спешно бежать от внезапного дождя, прикрывая собой уже вскрытую и частично распотрошенную емкость. В иных случаях помехой может стать не только дождь, но и порывы ветра и даже яркий солнечный свет. |

|
|
ОЧИСТКА РАСТВОРИТЕЛЕЙ
Это - неизбежная начальная стадия большинства исследований. Для удаления примесей (чаще всего воды) приходится пользоваться весьма и весьма активными реагентами. Это один из главных источников опасности. Опасности, связанные с перегонкой, будут рассмотрены позднее.
Осушку всегда проводят так, что сначала в дело идет менее активный, а затем более "жесткий" осушитель. При таком порядке слишком энергично проходящие реакции усмиряются, активный осушитель тратится более экономно. Некоторые осушители и растворители не совместимы между собой. И хотя во многих случаях осложнения легко предвидеть, самые опасные стоит назвать еще раз: - не следует пользоваться концентрированной серной кислотой (и в особенности олеумом) при осушке четыреххлористого углерода. При этом образуется фосген; - попытка осушить формамид фосфорным ангидридом приводит к выделению синильной кислоты; - щелочные металлы и их гидриды со взрывом реагируют с галогенсодержащими растворителями; взрыв обычно происходит после индукционного периода неопределенной продолжительности и провоцируется ударом. Впервые эта особенность была обнаружена, когда изучали взаимодействие калия с бромоформом. Химик, переносивший прибор с их смесью из одной лаборатории в другую, случайно ударил его о дверь. Последовал сильный взрыв, оторвавший экспериментатору руку. Таблица, приведенная ниже, обобщает сведения о взаимоотношениях наиболее ходовых растворителей с осушителями. Знак "+" означает, что осушитель рекомендуется для данного растворителя (возможно, после действия другого, более слабого осушителя). Знак "-" - не рекомендуется, "-!" - указывает на опасность, связанную с возможностью выделения токсичных газов или взрыва. Пустая клетка означает отсутствие информации в доступных руководствах. За этим может скрываться все что угодно. Скажем, не приходится сомневаться в том, что фосфорный ангидрид можно использовать для очистки ароматических углеводородов. Отсутствие рекомендаций к его использованию объясняется наличием других, более эффективных методов очистки. Эта таблица - не пособие по очистке растворителей, она лишь перечисляет разрешенные, запрещенные и сомнительные сочетания. Многие важные способы осушки (молекулярные сита, азеотропная отгонка воды) в ней не отражены. Далеко не все близко родственные вещества можно "стричь под одну гребенку". Литий скажем, в отличие от натрия и калия, практически не реагирует с диметилсульфоксидом. Натрий можно использовать для осушки ароматических углеводородов, калий же - нет, это чрезвычайно опасно. Бензол выдерживался над металлическим калием и после осушки был отфильтрован. При взбалтывании остатков бензола с калием в присутствии проникшего в колбу воздуха произошел сильный взрыв с появлением языка пламени. Экспериментатору обожгло лицо. Специалисты, расследуя аварию, пришли к выводу, что взрыв произошел из-за образования перекисей. Чрезвычайно легкая окисляемость калия на воздухе с образованием надперекиси, которая взрывается при контакте с многими органическими соединениями, представляет серьезную опасность. Отсюда ясно, что калий, если на то нет прямых указаний, не следует использовать как осушитель. |
Совместимость растворителей с осушителями 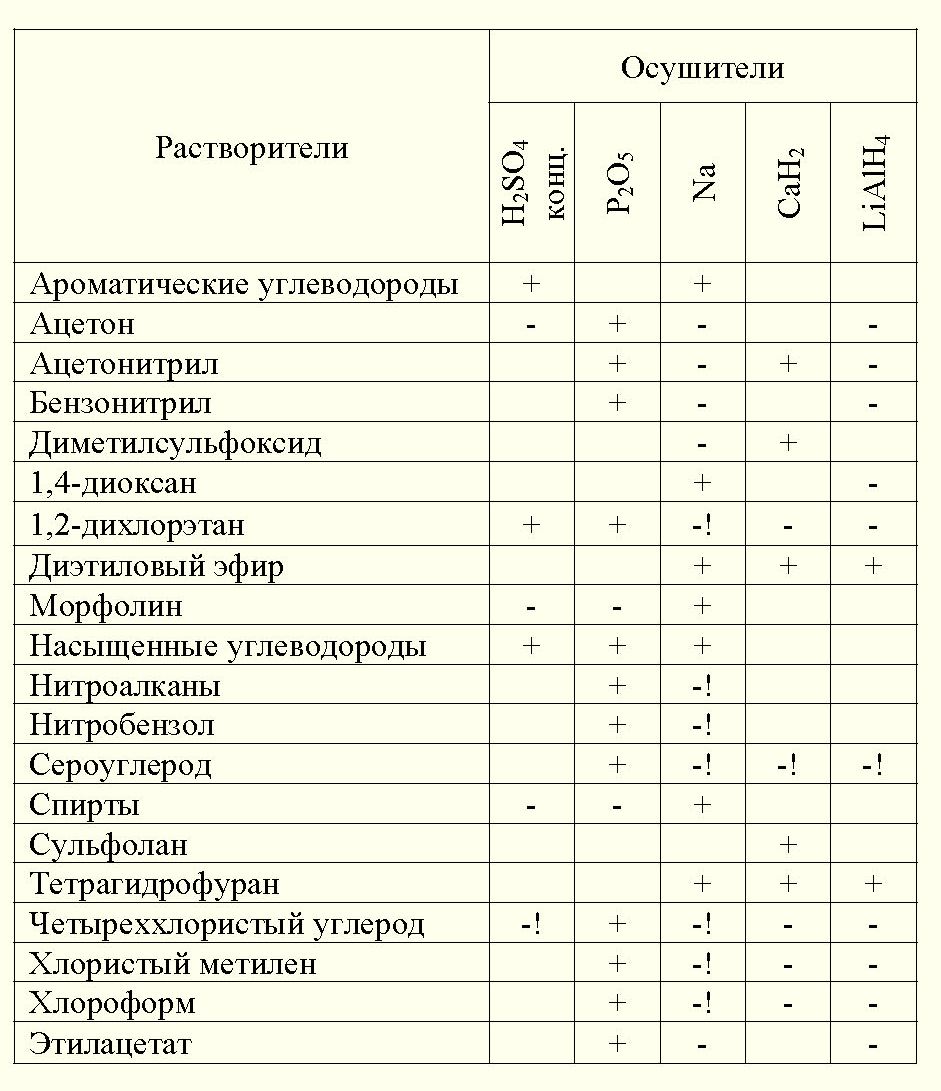
|

|
|
Внимательно следует подходить к выбору защитной жидкости при хранении и нарезке щелочных металлов. Ароматические углеводороды не годятся, подходят только высшие алканы.
Куски калия, побывавшие на воздухе и покрывшиеся желтой коркой, при разрезании могут взорваться даже под слоем защитной жидкости. Такие куски лучше не хранить, а уничтожить. Уничтожить остатки щелочных металлов можно с помощью реакции со спиртами. Для лития и натрия годятся этиловый или изопропиловый спирты (в последний можно добавить немного воды) От небольших обрезков лития можно избавиться, бросая их в воду (не в раковину!). Для уничтожения сплава натрия с калием или металлического калия можно использовать только трет. бутанол, который к тому же следует разбавить ксилолом или, другим инертным растворителем. Известен также способ уничтожения остатков натрия в двухслойной системе вода-бензин. Слой бензина, плавающий сверху, препятствует воспламенению выделяющегося водорода. Очередной небольшой кусочек натрия можно добавлять только после растворения предыдущего. Остатки щелочных металлов можно и сжигать. Небольшие кусочки - на железных поддонах с бортиком - прямо в вытяжном шкафу. Глаза должны быть защищены от яркого света. В случае нужды остатки щелочного металла могут быть переплавлены под слоем инертного высококипящего растворителя. Стоит, кстати, упомянуть еще одно опасное и неожиданное свойство щелочных металлов: резко экзотермическую реакцию с ртутью. Во время приготовления амальгамы кусочки натрия при погружении в ртуть дают вспышку. Во избежание взрывов и разбрызгивания ртути амальгаму стоит готовить под слоем керосина или другой защитной жидкости. Несколько слов о других опасных осушителях. Ангидрон (перхлорат магния), часто применяемый для осушки газов, почти не пригоден для органических, растворителей: это почти всегда угрожает взрывом. Однажды такой взрыв произошел при высушивании трипропилфосфина ангидроном даже без нагревания при комнатной температуре. Активность окиси кальция как осушителя сильно зависит от способа приготовления. Кусочки правильно приготовленного препарата при попадании на них небольшого количества воды раскаляются настолько сильно, что начинают светиться в темноте. При попадании большего количества воды (например, при мытье посуды после перегонки растворителя) возможно разбрызгивание щелочного раствора. Перекаленные (полученные при слишком высокой температуре) образцы CaO или давно хранящиеся его препараты неактивны. Опасность взрыва перекисей при очистке или использовании органических растворителей обсуждалась многократно (см., например, Химию и Жизнь 1987, № 10, с. 105). С точки зрения образования перекисей, среди растворителей наиболее опасны простые эфиры включая циклические (тетрагидрофуран, диоксан), ацетали, декалин. Чемпион среди них - диизопропиловый эфир. Самый простой способ обнаружить перекиси основан на реакции окисления йодид-иона. К нескольким миллилитрам исследуемой жидкости добавляют около миллилитра 10%-ного подкисленного раствора йодистого калия. Тщательно встряхивают. Появление желтой окраски указывает на наличие перекисей. Перед использованием и, в особенности, перед перегонкой перекиси должны быть удалены. Проще всего это достигается пропусканием растворителя через колонку с хроматографической окисью алюминия (I-II степени активности по Брокману). При этом, кстати, удаляется и большая часть воды. Можно также обработать растворитель в делительной воронке концентрированным раствором сульфата железа (II) или метабисульфита натрия. После этого нужно вновь проверить растворитель на наличие перекисей. Перекиси чаще всего взрываются при перегонке, когда большая часть растворителя уже отогналась. Особенно опасно "гнать досуха". Чтобы застраховаться, в перегонную колбу полезно добавить нелетучее вазелиновое масло. |

Диэтиловый эфир |
МЫТЬЕ ПОСУДЫ
Выполнение этой весьма распространенной процедуры почти всегда сопряжено с использованием агрессивных жидкостей. Встряхивая и переворачивая посудину, вы всегда рискуете, что моющая смесь попадет на вас. Значит, защитная одежда при этой почти кухонной процедуре строго обязательна.
Одно из самых популярных в лаборатории моющих средств - хромовая смесь. Ее готовят либо на концентрированной серной, либо на концентрированной азотной кислоте. Смешивать такие смеси между собой нельзя. Кроме того, хромовый ангидрид летуч и токсичен, так что постоянная работа с этим моющим средством может приводить к хроническому отравлению, вплоть до нарывов и прободения носовой перегородки. Хромовая смесь должна храниться в закрытом сосуде под тягой. Посуду нередко моют и слегка подкисленным или подщелоченным раствором перманганата калия. Следует твердо помнить, что попытка использовать концентрированную серную кислоту вместо разбавленной приведет к взрыву. Хорошими моющими свойствами обладает перекись водорода, подкисленная уксусной или соляной кислотой. Щелочной ее раствор также удаляет некоторые загрязнения, но его применять не стоит из-за склонности к взрывоопасному "вскипанию". Если загрязнения упорно не отмываются, иногда пробуют применять смеси, содержащие плавиковую кислоту. Такая процедура крайне опасна из-за сильного действие HF на кожу и органы дыхания. Опасно также отмывать фарфоровые ступки растиранием в них смеси плавикового шпата и серной кислоты. Описан случай, когда всего двухминутное соприкосновение пальцев с парами плавиковой кислоты привело к потере нескольких суставов. Если "безнадежные" органические загрязнения невелики, то от них можно попытаться избавиться, расплавляя в отмываемом сосуде калиевую или натриевую селитру. Происходит сильно экзотермическая реакция, и органика выгорает (осторожно, очки!). Способ может быть применен только для небольших островковых или пленочных загрязнений. При мытье обязательно следует учитывать химическую природу загрязнений. Нельзя, например, использовать моющие средства с серной кислотой для посуды, содержащей соли бария (это приведет лишь к осаждению на стекле прочного слоя BaSO4), а хлороформ - для отмывания остатков анилина (в щелочной среде получится изонитрил с отвратительным запахом). Остатки щелочных металлов, гидридов, пирофорных веществ должны быть уничтожены до мытья. Знать природу загрязнений, которые вы беретесь отмывать,- обязательное условие безопасной работы. |

Старинная химическая посуда фото museum.ru |
ПЕРЕГОНКА
Можно выделить два вида факторов, порождающих риск. Первые связаны с собственно перегонкой, превращением жидкости в пар и последующей его конденсацией, вторые - с сопутствующими обстоятельствами (горючестью перегоняемых жидкостей или вакуумом).
Факторы первой группы универсальны. Почти любая жидкость может бурно вскипеть при нагревании, выпрыгнув из перегонной колбы в потолок вместе с частью установки. Чтобы воспрепятствовать этому, при простой (не вакуумной) перегонке применяют "кипелки" - маленькие кусочки битого фарфора или перевернутые вверх запаянным концом обрезки капилляров. При вакуумной перегонке эту же роль выполняет тонкий капилляр, соединенный с атмосферой. Такие приспособления делают кипение равномерным, устраняют риск толчка. Нужно только помнить, что "кипелки" должны быть помещены в перегоняемую жидкость заранее, до ее нагревания. Попытка поместить их в нагретую жидкость может закончиться тем же взрывообразным вскипанием. При перегонке высококипящих веществ нужно принимать во внимание термостойкость стекла. Критические места установки - внутренние спаи холодильника - могут не выдержать, если разность температур охлаждающей жидкости в рубашке и паров в форштосе превышает 130-150°С. Выход прост: водяной холодильник заменяют на воздушный. При высоких температурах его вполне хватает. Вещества, которые кристаллизуются при температурах, превышающих температуру охлаждающей жидкости, могут забивать холодильник или аллонж. Такая пробка создает опасность взрыва. Чтобы избавиться от нее, достаточно уменьшить скорость воды в рубашке, а если это не помогает - пустить более теплую воду. Горючесть перегоняемых жидкостей - причина наибольшего числа осложнений. Студент перегонял большое количество бензола. По неизвестной причине в перегонной колбе образовалось отверстие, бензол пролился на его одежду и загорелся. В лаборатории, где работали еще пять студентов, поднялась паника. Загоревшийся бросился к присутствующим, которые, перепугавшись, отталкивали его от себя. Наконец самый решительный сорвал с пострадавшего горящую одежду. Подошли другие с пожарным пледом и водой. Студент был отправлен в больницу, где много дней находился в критическом состоянии. С тех пор его лицо, шея и руки покрыты рубцами. Чтобы уменьшить риск подобных аварий, открытое пламя стараются заменить на электроплитки с закрытой спиралью, на водяные, масляные или песчаные бани. Если в перегоняемую жидкость добавлен щелочной металл, и он еще не полностью растворился, применять водяную баню нельзя. При перегонке крайне легко воспламеняющихся сероуглерода или диэтилового эфира воду для бани согревают отдельно и лишь по мере необходимости подливают в баню. Простая перегонка должна иметь свободное сообщение с атмосферой. За этим нужно особенно внимательно следить, когда отверстие аллонжа закрыто хлоркальциевой трубкой, поскольку CaCl2 может постепенно разбухнуть и сделать ее непроходимой. Главная опасность при проведении вакуумной перегонки - взрыв. Чрезмерные механические напряжения в установке или попадание твердых загрязнений на шлифы - весьма вероятные его причины. |

Перегонка фото wikipedia.org |

Вакуумная перегонка |
РАБОТА С БАЛЛОНАМИ
Баллоны настолько упрощают эксперименты с газами, что исследователи готовы мириться с возникающими неудобствами и опасностями. Присмотримся к баллонам повнимательнее.
Они могут различаться по размеру, агрегатному состоянию начинки и, главное, по ее свойствам. Два последних классификационных признака имеют наибольшее отношение к безопасности. Баллоны со сжиженными газами могут быть двух конструкций: с сифонной трубкой и без нее. Если возникла необходимость отобрать часть содержимого в сосуд Дьюара, то баллон без сифонной трубки должен быть перевернут. Операцию нужно проводить в вытяжном шкафу или на открытом воздухе, обязательно применяя вентиль тонкой регулировки. Материал, из которого он сделан (как и материал вентиля на баллоне), зависит от природы газа. Для ацетилена, аммиака и хлора избегают медных сплавов - используется сталь. Резьбы, соединяющие баллон с редуктором (во избежание путаницы и впуска кислорода в редуктор с горючим газом), делаются разными. Для кислорода правыми, для водорода и других горючих газов - левыми. Редукторы для азота, аргона и других негорючих газов сделаны с правой резьбой и совместимы с кислородными. Взрыв баллона чреват тяжелыми разрушениями. Чтобы избежать этого, его лучше оберегать от ударов и нагревания. Резиновые кольца на баллонах, колпаки, защищающие вентиль, надежное закрепление самих баллонов в вертикальном положении - все это сильно снижает вероятность рокового удара. Их также следует устанавливать на почтительном расстоянии от источников нагревания, стараясь при этом выбирать место, с которого баллон можно быстро эвакуировать в случае пожара. Баллоны удобно располагать по нескольку штук в едином стояке. Нужно лишь помнить о недопустимости совместного пребывания емкостей с окислителями и горючими газами. Несколько видов баллонов внушают особые опасения. Кислородные - из-за возможности попадания горючей органики в пространство с высоким давлением кислорода. Баллоны с хлором - из-за сочетания высокой токсичности газа со столь же высокой коррозионной активностью. Вентили на таких баллонах часто "заедают", провоцируя на приложение физических усилий, ведущих иногда к срыву резьбы и неконтролируемому выделению газа. Не зря инструкция предусматривает обязательное наличие противогазов в комнате с таким баллоном, а также (на складе) ванны, заполненной раствором тиосульфата натрия. Ацетилен из-за его способности к самопроизвольному, иногда взрывному, разложению не хранят в сжатом или сжиженном состоянии. Ацетиленовые баллоны заполняют активированным углем, который пропитан раствором ацетилена в ацетоне. Такой способ хранения резко снижает вероятность самопроизвольного разложения ацетилена. Чтобы не допускать образования в баллоне газовых подушек, ацетилен не следует выпускать из баллона со скоростью более 20-25 л/мин. Если баллон все же начал самопроизвольно разогреваться, его следует немедленно вынести на улицу и выпустить из него газ, проследив за отсутствием поблизости пламени. Завершая наши уроки, напомню несколько самых общих правил. - Не проводите экспериментов в одиночку. Рядом должен быть коллега, способный помочь в критическую минуту. - Реактивы без этикеток подлежат безжалостному уничтожению 1. Не позволяйте себе наносить на пустую тару новую надпись, не уничтожив прежнюю. - Поручая кому-либо присмотреть за своей установкой, вводите коллегу полностью в курс дела. __________________________________________ 1 В наше время это правило часто неприменимо - учитывая, что химикам приходится покупать реактивы за собственные деньги (- прим. ред.). |

Газовые баллоны |

Кислородные баллоны |
Баллоны с горючим газом |
ЧТО ЧИТАТЬ О ТБ
К. Эгли, Е. Рюст. Несчастные случаи при химических работах. Л.; Научное химико-техническое издательство, 1926. Н. В. Костин. Техника безопасности работы в химической лаборатории. М.; Изд-во МГУ, 1966. <ссылка> К. А. Юдин. Техника безопасности при работе с химическими веществами. М.; Профиздат, 1964. <ссылка> Л. Н. Захаров. Техника безопасности в химических лабораториях. Л.; Химия, 1985. <ссылка> М. П. Селиванов. Безопасность работ в химических лабораториях. М.; Медгиз, 1954. <ссылка> Химия и жизнь
|

|