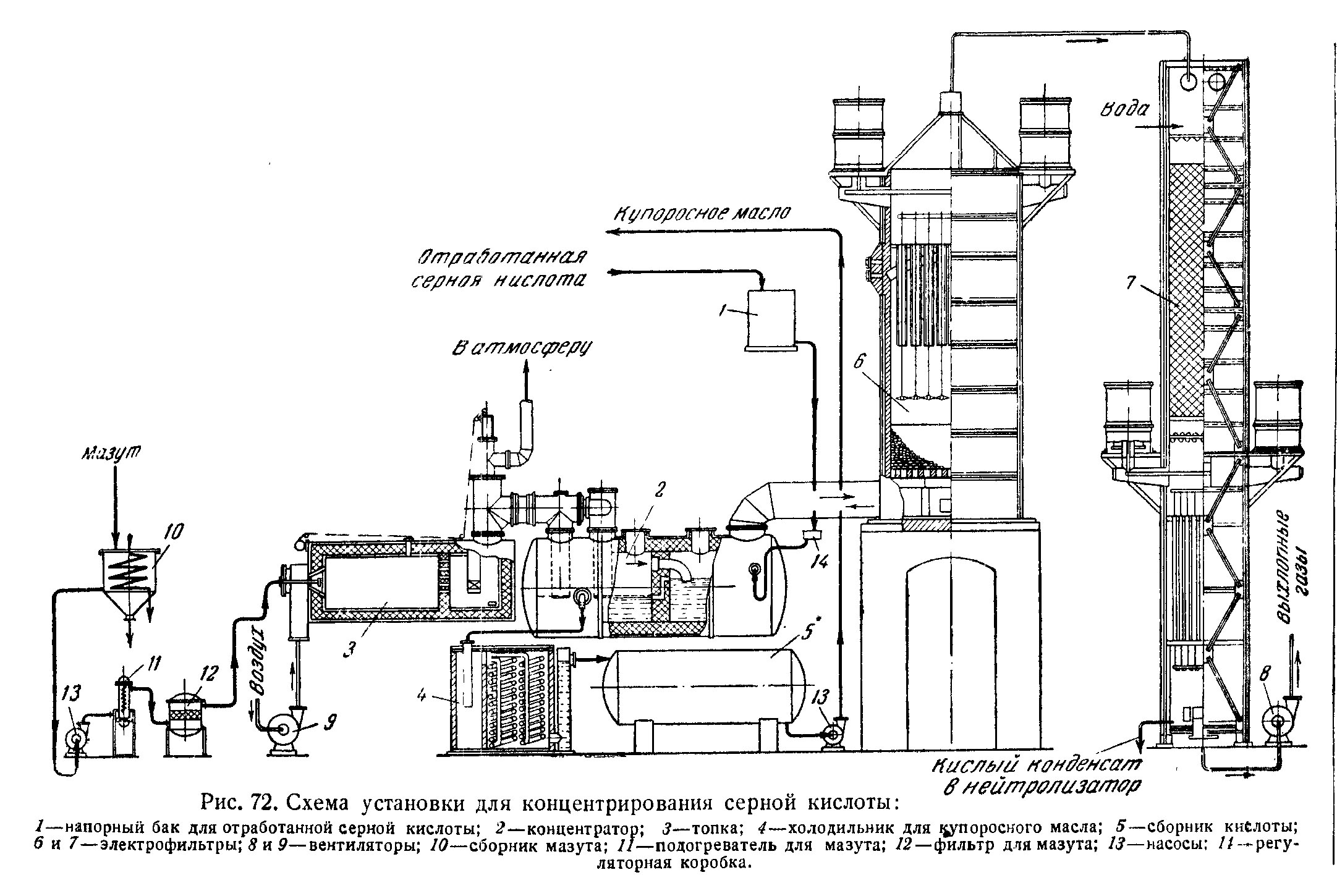
Рис.1. Промышленный способ концентрирования серной кислоты
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 5 2013 Журнал Химиков-Энтузиастов |
О проблеме концентрирования серной кислоты в научных, учебных и домашних лабораториях в условиях действия законов о прекурсорах Ing.P |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
На сегодняшний день химия оказалась в исключительно сложном положении: большое количество веществ, которые выпускаются миллионами тонн в год и абсолютно необходимы, как для предприятий, так и для исследовательских лабораторий, фактически объявлены вне закона. Еще полтора десятка лет назад эти вещества свободно продавались в хозмагах и магазинах реактивов, сегодня же их приобретение и хранение угрожает тюремным сроком. В русский язык прочно вошло английское слово "прекурсоры" [1].
В общепринятом значении под "прекурсором" понимают вещество, которое можно в одну стадию превратить в запрещенное наркотическое вещество [2]. Однако в большинстве постсоветских стран "прекурсорами" объявлено большое количество химических соединений: от экзотических до самых обыденных - таких, как толуол, ацетон, перманганат калия и соляная кислота. Разумеется, из соляной кислоты, "марганцовки" или толуола получить наркотические вещества в одну стадию невозможно, но чиновников и журналистов это противоречие ничуть не волнует. Кроме списка "прекурсоров" есть и другой запретный список - т.н. "сильнодействующих и ядовитых веществ", в частности в Украине этот список расширили до ужасающих масштабов. Хотя сама идея запрещать вещества абсурдна, так же, как идея запрещать определенные технические изделия или информацию, подобные законы принимаются повсеместно. Перед теми, кто не желает отказываться от химии в пользу коллекционирования почтовых марок, возникает задача разработки технологий производства запрещенных веществ из доступных, и более общие задачи - разработка методов разделения и регенерации этих веществ. Последняя задача тем более актуальна, поскольку даже доступные реактивы дороги, а работа в домашней лаборатории требует полного исключения утрусок, утечек и всякого рода вредных выбросов. Первое и основное вещество, на производстве которого основаны многие другие производства - это концентрированная серная кислота. Серную кислоту недаром называют кровью химии. Проведение многих реакций и процессов - сульфирования, нитрования, дегидратации, растворения - требует больших количеств концентрированной серной кислоты. При этом имеется одна особенность - во многих реакциях кислота не расходуется, а только разбавляется. Следовательно, концентрирование серной кислоты в лаборатории решает не только проблему ее приобретения, но и проблему утилизации больших количеств разбавленной кислоты. Известны три основных способа получения концентрированной серной кислоты: ректификация разбавленной кислоты, пиролиз сульфатов (как вариант - гидросульфатов или полисульфатов) и контактный способ, заключающийся в окислении сернистого газа до серного ангидрида с последующим поглощением его водой или разбавленной кислотой. В свою очередь, эти способы могут быть реализованы в виде периодических или непрерывных процессов. Традиционно в лабораториях вещества получают периодическим способом, помещая в колбу или аппарат разовую загрузку и работая с ней. При необходимости получения больших количеств процесс повторяют несколько раз. Такой подход вполне оправдан, пока разовые загрузки сравнительно невелики, получаемые продукты ценны, что имеет место при стабильном снабжении лаборатории основными реактивами. Сегодня сложилась ситуация, не имевшая аналогов в истории, за исключением разве что периодов послевоенной разрухи, или тех давних времен, когда вещества еще не были изучены и не производились промышленностью. Остро стала задача снабжения лабораторий (не только домашних) базовыми реактивами и химическим сырьем с минимальной затратой труда, времени и энергоресурсов [3]. При таких требованиях приходится обратить внимание на промышленные методы производства химических веществ, которые большей частью являются непрерывными. Главный недостаток реализации промышленных процессов в домашней лаборатории - необходимость создания сложной и специфичной для каждого процесса аппаратуры. Тем не менее, именно непрерывные процессы наиболее перспективны для решения поставленных выше задач, поэтому они будут рассмотрены в статье наряду с традиционными периодическими. Схема промышленного способа концентрирования разбавленной серной кислоты показана на рис. 1. Рисунок взят из книги В.И. Атрощенко и С.И. Каргина "Технология азотной кислоты", 1949г [ссылка]. _____________________________________________________ 1 Обратите внимание, что когда т.н. "прекурсоры" (серная и соляная кислоты, марганцовка и т.д.) находились в свободной продаже, по улицам не бродили толпы наркоманов, по подъездам не валялись залежи использованных шприцов, а по телевизору каждый день не сообщали об очередном теракте. 2 В данном случае речь идет о прекурсорах именно наркотических веществ, т.к. смысл этого слова более широкий: прекурсор - вещество-предшественник целевого продукта. 3 Современное положение дел до боли напоминает т.н. натуральное хозяйство, которое сформировалось в период расцвета феодализма. При натуральном хозяйстве все необходимые товары производились на месте и обмена товарами или услугами между разными регионами почти не было. Торговля была невыгодна из-за постоянных войн, плохих дорог, высоких пошлин, грабежей на дорогах и т.п. |

Рис.1. Промышленный способ концентрирования серной кислоты |
|
Ректификация серной кислоты под атмосферным давлением теоретически позволяет достичь концентрации 98,3%, а практически - лишь до 96%, причиной этого является возрастание доли серной кислоты в парах при подходе к азеотропу (см. рис.2 и 3). В результате растут теплопотери и снижается скорость процесса.
Понижение давления благоприятствует концентрированию, однако применение пониженного давления (вакуума) в домашних условиях затруднительно - в домашних лабораториях часто используются стеклянные аппараты, от разрушения которых трудно застраховаться, а разлив горячей концентрированной кислоты неприемлем и должен быть полностью исключен. Создание же стальных аппаратов со вставными стеклянными частями, разгруженными от давления атмосферы, или аппаратов из коррозионно-стойкой стали чрезвычайно трудоемко. |
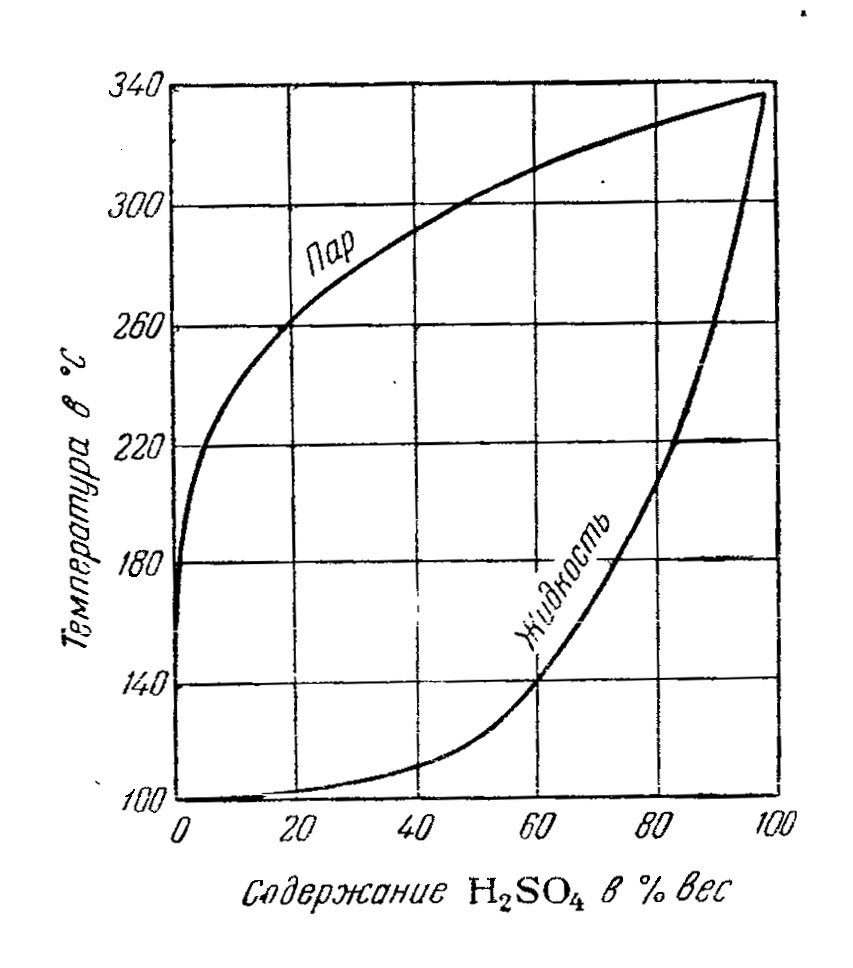
Рис.2. Зависимость состава жидкости и пара от температуры (при 1 бар) |
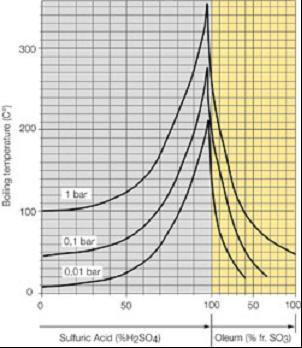
Рис.3. Зависимость состава жидкости от температуры и давления |
|
Как показывают многочисленные опыты, кипение серной кислоты под атмосферным давлением происходит с сильными толчками: серная кислота склонна к перегреву, и даже применение кипелок не обеспечивает равномерного кипения. Гораздо большими преимуществами обладает другой известный способ - барботаж воздуха, желательно (но необязательно) сухого, по сути своей аналогичный перегонке с водяным паром (и описываемый той же теорией). Сушить воздух (или хотя бы не допускать повышения упругости водяного пара над конденсатом в приемнике) можно слабой кислотой или другим доступным осушителем, допускающим регенерацию и не изменяющимся от кислоты. Хороши силикагель и безводный сульфат меди.
Нагнетать барботируемый воздух можно обычным аквариумным компрессором - подача порядка 1 л/мин вполне достаточна, и напора в 150 миллибар, типичного для большинства моделей, хватает с избытком. Таким способом, однако, удобно работать лишь до концентрации порядка 80% (плотность 1,74-1,75). При более высокой концентрации кислоты начинается образование тумана, осадить из которого мельчайшие капли кислоты полностью не удается даже электрофильтром. Поэтому для домашней лаборатории можно рекомендовать замкнутую схему (см. рис. 4), в которой циркулирует одна и та же порция воздуха, перекачиваемая специальным газовым насосом, изготовление или приобретение которого и является главной трудностью. Здесь перспективна переделка какого-либо пластмассового мембранного насоса с заменой уязвимых частей на такие же, выполненные из коррозионно-стойких материалов (нержавейка, титан, фторопласт, силикон, фарфор; стойкость силикона, однако, вызывает вопросы). Следует напомнить о важной роли гидравлического затвора, выполненного из U-образной трубки - он не позволяет давлению в аппарате значительно отклоняться от атмосферного при нагреве или остывании. |
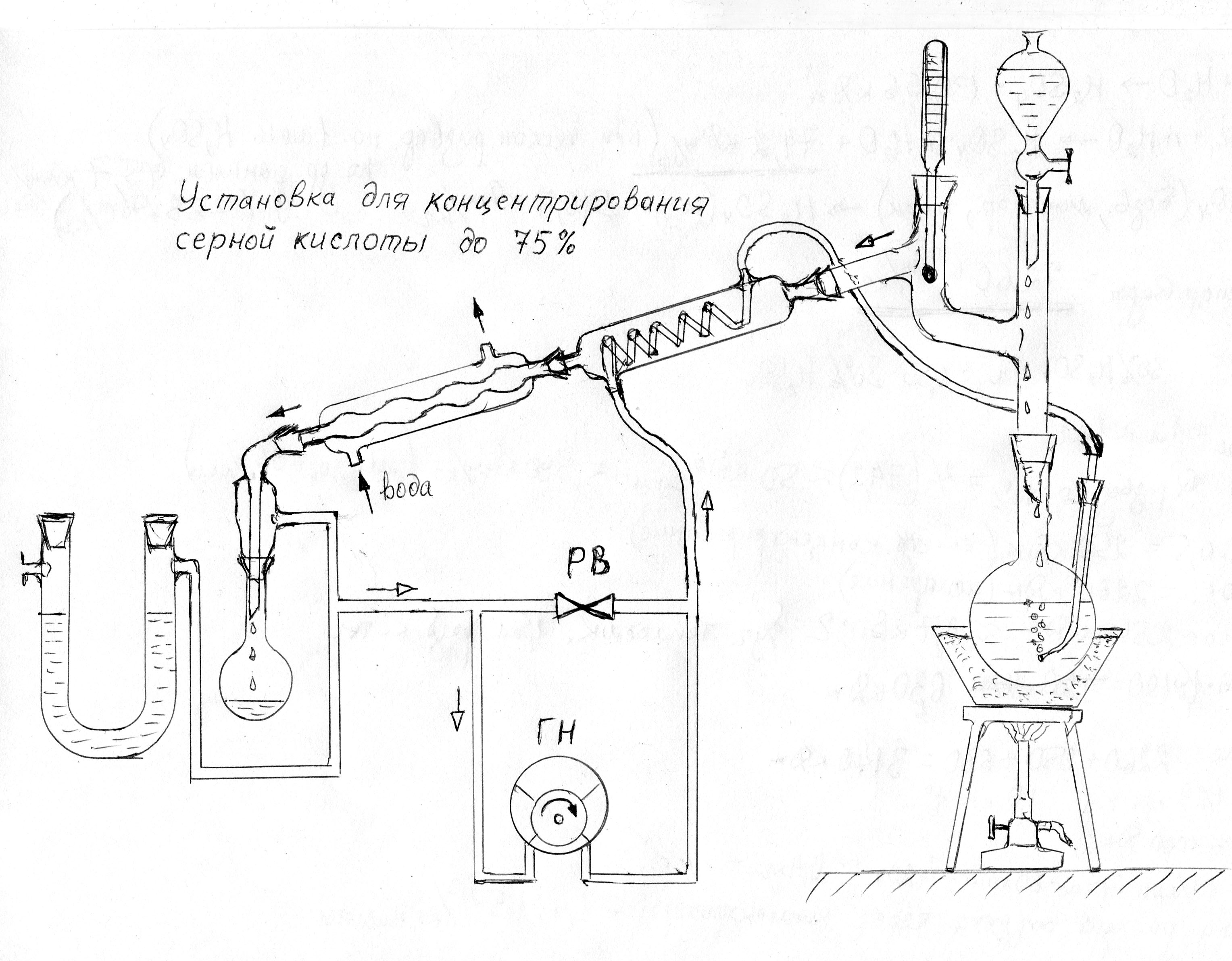 Рис.4. Замкнутая (циркуляционная) установка для концентрирования.
ГН - газовый насос; РВ - регулировочный вентиль |
|
Лабораторный периодический способ концентрирования серной кислоты, который, по-видимому, можно считать весьма удовлетворительным и к которому следует стремиться в домашней лаборатории (рис. 5), состоит из двух стадий. На первой стадии в колбу емкостью 1 или 2 литра (что есть в наличии) с соответствующим колбонагревателем помещают 2/3 (до 3/4) объема серной кислоты, присоединяют барботажную насадку, отвод с термометром и нисходящим холодильником и приемник с аллонжем и начинают газовым насосом продувать в колбу воздух из приемника. Очень желательно применять для работ по концентрированию кислот новые колбы, поскольку малейшие царапины резко снижают устойчивость стекла к термоударам (таким, как попадание воды на горячее стекло). Так, хорошее термостойкое стекло устойчиво к перепадам температуры до 200°С.
Пускают воду в холодильник, включают газовый насос и только потом включают обогрев колбы. Если начать барботаж воздуха после того, как кислота станет горячей, это приведет к резкому вскипанию и выбросу загрузки. Столь же опасно кратковременное (более чем 5-10 сек.) прекращение барботажа при работе установки. Отгонка дистиллята начинается при температуре в парах от 100 до приблизительно 101,5°С, в зависимости от начальной концентрации. Процесс продолжают, пока не начнет отгоняться вода со следами серной кислоты (концентрация достигает 80%). Более высокую концентрацию (до 85-90%) получают, тщательно утепляя колбу и отвод сверху. Обычные ткани, даже брезент, для этого не годятся (приобретают коричневый цвет и даже обугливаются). Следует применять стеклоткань, базальтовую вату или, в крайнем случае, асбест (асбест при работе с ним следует увлажнить, чтобы он не пылил, и пускать установку после полного высыхания). Если позволяет конструкция отвода или число горл колбы, можно установить капельную воронку с запасом кислоты для пополнения убыли жидкости в колбе, однако капли холодной кислоты из воронки не должны попадать на нагретое стекло (оно может лопнуть), а должны падать непосредственно в горячую кислоту, т.е. воронка должна стоять в отдельном вертикальном горле. Кроме того, как показывает опыт, горячая кислота сильно разъедает смазку крана капельной воронки, которая вытекает по шлифу наружу и загрязняет кислоту в кубе (она заметно желтеет). По окончании процесса отключают обогрев и газовый насос, затем прекращают подачу воды в холодильник и дожидаются полного остывания аппарата. Снимают насадки и переливают упаренную кислоту в подходящий сборник (хороши бутыли из-под шампанского). Как показывает опыт, упаривание 1,5 л 30% аккумуляторной кислоты до 80% (приблизительно 1 л дистиллята) на конфорке мощностью 800 Вт занимает около 8 часов. Уже 70-80% кислота заметно отличается от 30% своей маслянистостью - вязкостью и способностью смачивать поверхности. В установке согласно рис. 4 возможно концентрирование кислоты и до 96%, если снабдить колбу 40-сантиметровой колонкой Вигре с умеренной теплоизоляцией (слой асбестовой ткани, несколько слоев стеклоткани или обмотка асбестовым шнуром), приблизительно так, как в статье [3a], однако при этом значительно возрастают теплопотери и расход электроэнергии; кроме того, часть кислоты переходит в приемник для дистиллята. _________________________________________________________ 3a Эфиры азотной кислоты: этиленгликольдинитрат и тринитроглицерин ч.1. Получение дымящей азотной кислоты [ссылка] |

Рис.5. Лабораторная концентрационная установка циркуляционного типа |
|
Теория требует следующих энергозатрат на концентрирование кислоты:
1) теплота гидратации при бесконечном разведении - 74,2 кДж/моль безводной серной кислоты (по другим данным - 75,7 кДж/моль); данное значение соответствует 788 кДж/кг; для концентрирования от 30% до 80% было принято 500 кДж/кг; 2) теплота испарения воды - 2260 кДж/кг; 3) теплота, приходящаяся на теплоемкость разбавленной кислоты (принимается равной теплоемкости воды 4,2 кДж/кг·град), при нагреве кислоты от н.у. до 200°С (на 180°С) требуется 4,2·180 = 756 кДж/кг. Таким образом, всего требуется 500·0,5кг (собств. концентрирование) + 2260·1 кг (испарение) + 756·1,5 кг (подогрев) = 3644 кДж или 1,01 кВт·ч. Фактически было израсходовано 8ч·0,8кВт = 6,4 кВт·ч. КПД установки составил, таким образом, 1,01/6,4 = 0,16 или 16%. Небогато. Основной причиной, естественно, являются теплопотери. Однако из расчета видно, что заметную экономию может дать подогрев кислоты, поступающей на концентрирование, уходящим паром (рис. 6), и эта экономия тем больше, чем выше крепость кислоты в кубе (выше температура паров). |
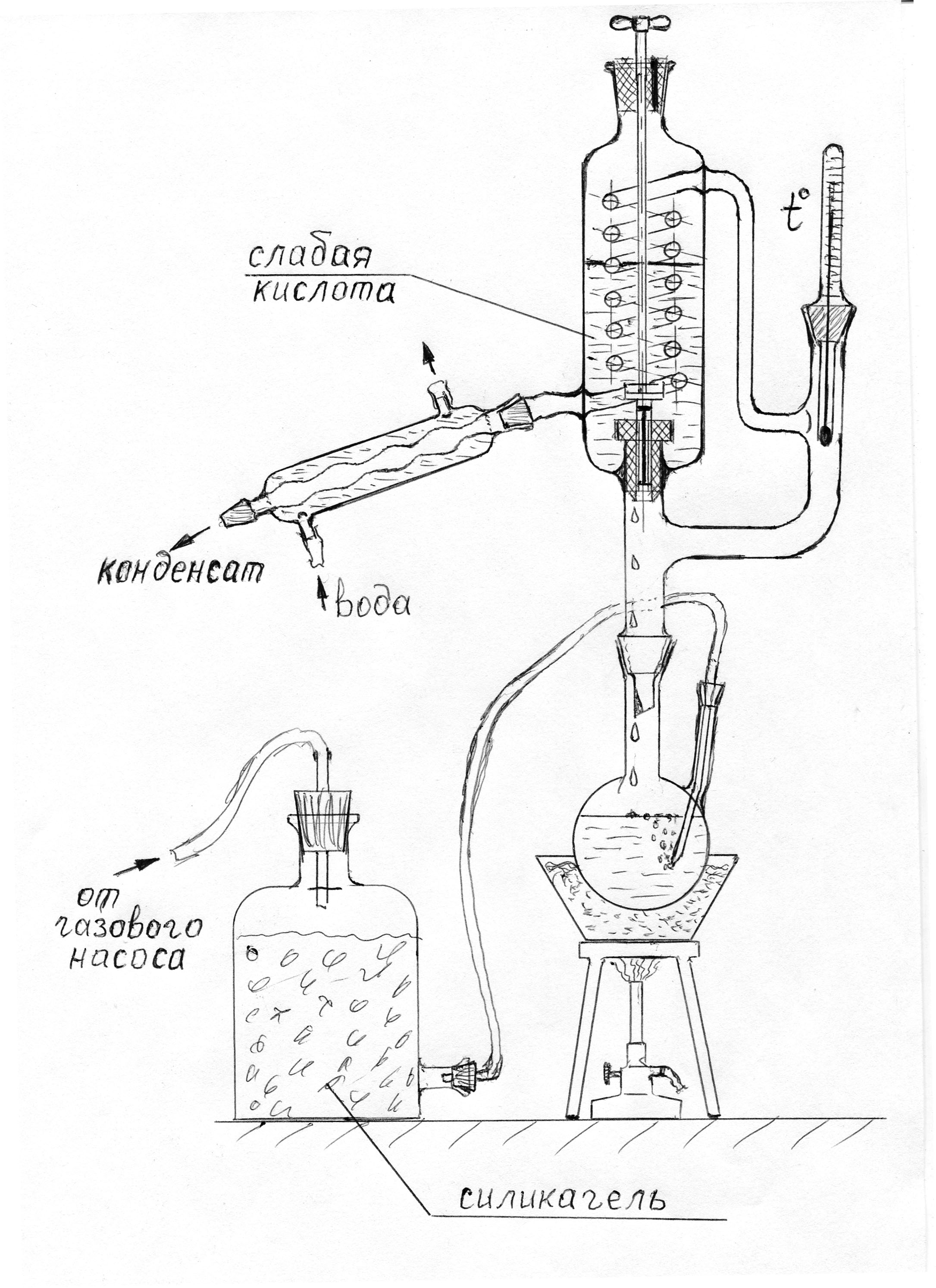
Рис.6. Фрагмент циркуляционной установки с регенерацией тепла |
|
Возможен также подогрев барботируемого воздуха. Эффективность этой меры, однако, очень низка. В самом деле, принимая подачу газового насоса равной 1 л/мин, теплоемкость воздуха 1006 Дж/кг·град, среднюю плотность воздуха 1,23 кг/куб.м и перепад температур 180°C, получим 1/60 л/сек · 1006 · 1,23/1000 · Дж/л·град · 180°C = 3,7 Вт, ничтожную долю мощности нагревателя. При этом объем воздуха, приходящийся на килограмм крепкой кислоты, составляет 1 л/мин · 60 · 8 час /1000 · 0,5 кг кислоты = 0,96 куб.м воздуха / кг кислоты, что вполне соответствует значению этого показателя у промышленных установок типа изображенных на рис.1 (1,4-1,5 куб.м / кг). Поэтому предпочтительна установка согласно рис. 6, а не установка согласно рис. 4.
Недостатком установки на рис.6 является наличие трудоемкого узла - капельной воронки с подогревом и внутренним краном, полностью исключающим утечки. Данное изделие, скорее всего, не удастся изготовить из выпускаемых промышленностью спиральных холодильников, поскольку форма спиралей не позволяет пропустить стержень крана по оси холодильника, а холодильники других типов (шариковые и пр.) имеют слишком малый внутренний объем. Вторая стадия заключается в нагревании смеси подготовленной 70-80% серной кислоты с эвтектикой солей - сульфатов натрия, калия и магния (в журнале "Химия и химики" [4] описан способ производства серного ангидрида и олеума пиролизом гидросульфата натрия, аналогичный способу Вольтерса; в выдержке из "Основ химии" Д.И. Менделеева указывается, что двойная соль Na2Mg(SO4)2 стабильнее индивидуальных сульфатов и комплексный полисульфат легче отдает серный ангидрид (см. рис. 7). Избыток серной кислоты в смеси с солями приводит к доле полисульфатов в пиросульфатах, однако результатом оказывается лишь снижение крепости олеума, если же нужна крепость не более моногидрата, то полисульфатам следует отдать безусловное предпочтение. Эвтектика сульфатов, в отличие от фосфорной кислоты, практически не реагирует со стеклом и не разъедает колбу. Стоит отметить, что полисульфаты типа NaH3(SO4)2 получают смешиванием сульфата с серной кислотой и нагреванием с отгонкой лишней воды. По литературным данным, полисульфаты - кристаллические вещества с температурой плавления 95-100°С, являющиеся превосходными сульфирующими агентами. Их действием можно получать ди- и даже трисульфокислоты; полисульфаты калия дают особенно высокие выходы. Вот выдержки из статьи "Нордгаузенская кислота" Энциклопедии Брокгауза и Ефрона, содержащие описание способа Вольтерса. "…Железный купорос отдает (даже теоретически) в форме серного ангидрида лишь половину заключающейся в нем серы, остальная же ее половина выделяется в виде сернистого ангидрида, по уравнению: 2FeSO4=Fe2O3+SO3+SO2. Прочие серно-кислые соли, с одной стороны, сами по себе представляют обыкновенно уже более дорогой материал, а с другой, и разложение их совершается при высшей температуре, при которой большая часть серного ангидрида распадается на кислород и SO2. Большие выгоды при известных условиях может дать пиросерно-натровая соль Na2S2O7, легко получаемая при слабом прокаливании так наз. бисульфата, или кислой серно-натровой соли NaHSO4, образующейся при действии H2SO4 на Na2SO4 (сульфат, см.), а также составляющей отброс при производстве азотной кислоты (см. Крепкая водка). Разложение идет по уравн.: 2NaHSO4=Na2S2O7+H2O и далее Na2S2O7=Na2SO4+SO3, но последняя реакция требует весьма высокой температуры (около 600°С). Поэтому Вольтерс предложил (1878) прибавлять к расплавленной Na2S2O7 в пайном отношении безводную серно-магнезиальную соль MgSO4, которая разлагает пиросерно-натровую соль при значительно низшей температуре, выделяя из нее SO3 и образуя двойную соль Na2Mg(SO4)2, по уравнению: Na2S2O7+MgSO4=Na2Mg(SO4)2+SO3..." __________________________________________ 4 См. статью Получение SO3 и олеума [ссылка] |

Рис.7. Рекомендации по выбору солей для получения пиросульфатов (из книги Д.И. Менделеев. Основы химии т.2, глава 20, стр. 210, вероятно - 13-е изд. 1947 г.) |
|
"…Разложив оставшуюся двойную соль растворением в воде и кристаллизацией, можно затем ту же MgSO4 употреблять для превращения нового количества Na2S2O7, и т. д. Вместо MgSO4 можно брать и др. соли того же типа, кристаллизующиеся с 7H2O, а в том числе и легкодоступный по цене железный купорос. Этот способ Вольтерс тогда же предложил и для превращения обыкновенной серной кислоты (66° и 60°Б. [5]) в дымящую, прибавляя последнюю к пайной смеси безводных Na2SO4 и MgSO4, отгоняя при плавлении воду из образовавшейся (по уравнению: Na2SO4+H2SO4=2NaHSO4) кислой серно-натровой соли и затем умеренно прокаливая полученную смесь Na2S2О7 + MgSO4. По отгонке SO3 остаток [двойная соль Na2Mg(SO4)2] измельчается и вновь смешивается с серной кислотой и, таким образом, может служить для превращения неопределенно больших количеств этой последней…"
"…В 1881 г. Вольтерс взял патент на следующий способ, получивший действительное применение на некоторых заводах (напр. у нас на Тентелевском заводе в СПб.): бисульфат NaHSO4 нагреванием в чугунной реторте превращается в пиросульфат, и затем последний смешивается с избытком моногидрата H2SO4; образующийся при этом SO3 (по уравнению: Na2S2О7+H2SO4=2NaHSO4+SO3) отгоняется (около 150°) и поглощается крепкой серной кислотой в конденсационных сосудах или осаждается в свинцовой камере в твердом виде, а остающаяся в реторте NaHSO4 служит вновь материалом для повторения того же процесса, и т. д. Понижение температуры разложения при добывании нордгаузенской кислоты из серно-кислых и пиросерно-кислых солей или через их посредство из обыкновенной серной кислоты является весьма важным обстоятельством, так как оно прежде всего содействует существенному сбережению топлива, далее, увеличивает выход продукта вследствие уменьшения % разложения SO3 на SO2 и кислород и, наконец, сохраняет самые аппараты, предоставляя в то же время большую свободу в выборе материала для их устройства…" "…Кроме того, при добывании Н. кислоты из купоросного камня и из искусственной серно-железной соли или через посредство последней из серной кислоты [6] понижение температуры важно еще и в том отношении, что получающаяся, в качестве побочного продукта, окись железа не пережигается и дает затем, с одной стороны, лучшего качества мумию, а с другой - сохраняет способность легче растворяться в серной кислоте…" (подчеркнуто автором статьи) В домашней лаборатории процесс может быть оформлен так. В литровую колбу из термостойкого стекла (хороши Rasotherm или Schott Duran, возможно применение глиняного сосуда, например, из-под "Рижского бальзама" или некоторых сортов вина, но это требует проверки, глиняный сосуд можно снабдить собственной электроспиралью, рис. 8) помещают 100 гр. эвтектики (с температурой плавления 645°C) сульфатов натрия, калия и магния (в отношении 51:17:32 мольных долей или 51,5:21,1:27,4 массовых долей соответственно с температурами плавления 890, 1076 и 1127°C) и заполняют подготовленной серной кислотой на 2/3 объема. Вносят несколько кусочков пористого фарфора (кипелки). Колбу помещают в песочную баню с хорошей теплоизоляцией, стоящую на нагревателе мощностью 1,0-1,5 кВт, причем уровень смеси в колбе должен оставаться выше уровня песка. В песок вблизи колбы втыкают хромель-копелевую термопару, соединенную с микроамперметром, имеющим возможно меньшее сопротивление рамки и предварительно откалиброванным на температуру. Для улавливания паров серной кислоты и серного ангидрида после предварительного обезвоживания подключают поглотительную колонку, орошаемую той же 75% серной кислотой. Процесс заканчивают после получасовой выдержки при 600°C (красное каление, видимое в темноте). _________________________________________ 5 " °Б " - Градусы Боме (внесистемная единица плотности, которая использовалась в прошлом) 6 Т. е., пользуясь остающейся при разложении Fe2(SO4)3 окисью железа и превращая ее вновь с помощью H2SO4 в Fe2(SO4)3, и т. д. |

Рис. 8. Глиняная реторта с нагревательной спиралью |
|
Все эти схемы имеют ряд недостатков. Первый - медленная работа, в том числе из-за необходимости ожидать полного остывания для начала работы с новой загрузкой, соответственно, малая производительность и значительные габариты. Второй - опасность разлива всей загрузки при разрушении установки (термоудар или случайное повреждение установки по неловкости самим экспериментатором или кем-нибудь из домашних при работе в домашней лаборатории, где иногда бывает недостаточно просторно для таких работ). Третий - низкий КПД, значительные затраты электроэнергии (в промышленности для получения тепла используется горючее - мазут или природный газ). От этих недостатков свободна установка непрерывного действия, схема которой показана на рис.9.
Установка представляет собой цепочку однотипных каскадов, каждый из которых состоит из пробирки большого диаметра с загнутым вниз отводом, закрытой фторопластовой пробкой 7 с четырьмя отверстиями. Через центральное отверстие проходит тонкая длинная пробирка 2 из кварца или, что несколько хуже, из термостойкого стекла. Внутри этой пробирки находится электронагреватель 3 (спираль на керамическом каркасе) с засыпкой кварцевым песком 4, занимающий половину пробирки по высоте и изолированный сверху асбестовым шнуром или набивкой 6. В три других отверстия вставлены три стеклянные трубки - газоотвод, оканчивающийся на два-три сантиметра выше отвода пробирки (без брызгоуловителя), перелив 1, доходящий до дна, и барботер 5, оканчивающийся приблизительно на границе между песчаной засыпкой нагревателя и его асбестовой теплоизоляцией. Отвод пробирки предыдущего каскада соединяется с переливом следующего, а барботер предыдущего - с газоотводом следующего (барботер и газоотвод могут быть одной деталью). Тем самым обеспечивается массообмен в противотоке. |
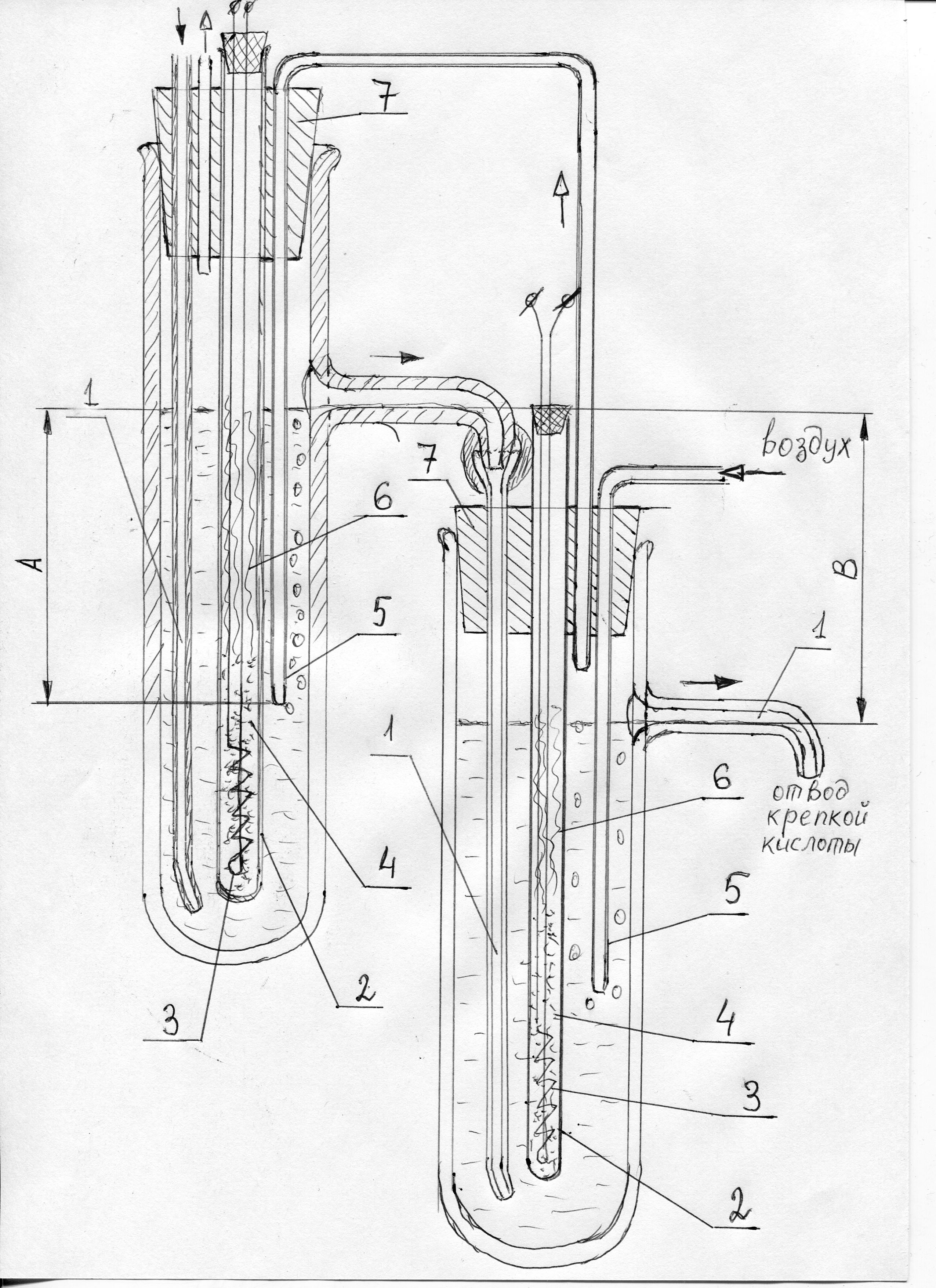
Рис. 9. Лабораторная установка для непрерывного концентрирования |
|
Потребное число каскадов концентратора определяется интенсивностью процессов (суммарной мощностью нагревателей и подачей компрессора). Задаваясь производительностью установки 1,8 кг (1 литр) 96% кислоты в сутки, получаем расход сырья (30% кислоты) 6 кг, или около 5 литров. Задаваясь КПД установки 50%, находим приближенно суммарную мощность нагревателей:
Q = 500·1,8кг + 2260·4,2кг + 756·6 = 15000 кДж или 4.15 кВт·ч; - потребная теплота Qпотреб = Q / КПД = 8,3 кВт·ч; - мощность P = Q/t = 8,3 / 24 = 350 Вт (без учета регенерации тепла противоточной схемой (-) и без учета теплопотерь (+)). Мощность одного миниатюрного нагревателя трудно сделать более 100 Вт, поэтому число каскадов в данном случае должно быть не менее четырех. Его можно уточнить, вычисляя по критериальному уравнению коэффициент теплоотдачи на поверхности нагревателя (увы, число Нуссельта). Последний каскад концентратора можно снабдить дополнительным наружным обогревом. Электроспираль не должна касаться обычного, не кварцевого стекла, поэтому пробирку следует обмотать несколькими слоями стеклоткани, уже поверх которой намотать нихромовую проволоку. Необычной должна быть пробка (поз.7). Особенность заключается в том, что фторопласт имеет очень высокий коэффициент теплового линейного расширения и при нагревании от комнатной температуры до 200°С, типичных для пробки концентратора, он увеличивается в размерах на 2,5%. Если не принять мер, то пробка раздавит пробирку изнутри. Проблему решают глубокие кольцевые канавки на поверхности пробки (авторский вариант), или изготовление рабочей части пробки из стопки фторопластовых шайб, выштампованных из ленты, или кольца, аналогичные поршневым и распираемые пружинами из нержавеющей стали, в канавках пробки. Кроме того, на стеклянные трубки в месте их прохождения через пробку следует надеть отрезки силиконового шланга, сделав подобие сальника (рис. 10). |
Рис.10. Конструкция пробки концентратора 1 - фторопластовая пробка, 2 - кварцевая пробирка, 3 - трубка, 4 - уплотнение |
|
Теплоизоляции и кожуху всего концентратора следует уделить самое пристальное внимание, не меньшее, чем механической прочности монтажа. Каждую пробирку следует снабжать собственным трубчатым кожухом из кровельного железа или готовой дюралевой трубы диаметром 60-70 мм, с прорезью на 30-50 мм от верхнего края для бокового отвода, а кроме того, наружным кожухом должен быть окружен весь концентратор (температура внутри наружного кожуха не должна быть выше 100°C).
Принимая расход воздуха 1,2 куб.м / кг кислоты, получаем потребную подачу компрессора 1,2·1,8·1000 / (24·60) = 1,5 л/мин. Темп подачи слабой кислоты в концентратор 5л·1000 / (24·60) = 3,5 мл / мин. Скорость кислоты в трубках при внутреннем диаметре 3 мм: v = 3,5 / 60·(3,14·0,32 / 4) = 0,83 см/с, т.е. гидравлическим сопротивлением можно пренебречь. Объем кислоты в каскаде находим, принимая диаметр пробирки 30 мм, нагревателя 10 мм, длину 200 мм: (3,14/4)·20·(32 - 12) = 125 мл. Средняя продолжительность пребывания кислоты в концентраторе (период полусмены) составит 125мл / 2·3,5мл/мин = 18 мин, чего вполне достаточно для установления равновесия между жидкостью и паром. Компоновка установки должна обеспечивать необходимые разности уровней жидкости в каскадах. Избыточное давление, которое должен преодолеть газ в барботере, определяется глубиной его погружения (размер A на рис. 9). Это же давление, действуя над поверхностью жидкости в последующем (нижележащем) каскаде, заставляет жидкость в нем подниматься по переливу 1 на равную высоту. Для безнапорного течения кислоты по отводу пробирки необходимо, чтобы размер B был больше размера A на 1,5-2 см, т.е. чтобы стык отвода с переливом не омывался кислотой под напором и мог быть уплотнен гибким соединением (отрезком силиконового шланга). Данное соединение описано в книге: Ю.В. Карякин, И.И. Ангелов "Чистые химические реактивы", М.: Госхимиздат, 1955, стр. 284, рис. 36, б (Автоматический генератор для получения HCl по Живову, деталь соединения трубок) [ссылка]. Переливы поз.1 легко могут быть изготовлены из пипеток Мора. Пробирка большого диаметра с отводом - изделие не из распространенных, однако часто встречающийся даже в школьных лабораториях прибор Кирюшкина (прибор для получения газов, ППГ) своей основой имеет именно такую пробирку (рис.11). Ее отвод следует загнуть вниз. При использовании не слишком тонких стеклянных трубок (общим числом 3) кварцевая пробирка уже не помещается (бывают, впрочем, тонкие кварцевые пробирки для анализа методом ЭПР [7], но они являются дорогостоящей редкостью), поэтому обогрев придется делать только наружным. _____________________________________________ 7 ЭПР - электронный парамагнитный резонанс. ЭПР - распространенный метод исследования в химии и физике (в частности, в химии комплексных соединений и химии свободных радикалов). |

Рис. 11. Прибор для получения газов |
|
Вытекающая из концентратора кислота имеет очень высокую температуру (выше 300°С), кроме того, дополнительная теплота уходит из установки с водяным паром. Все это тепло можно регенерировать по схеме на рис. 12. Для этого нужны два спиральных холодильника Грэхема. Кислота в обоих холодильниках проходит по змеевику, а водяной пар в верхнем и воздух в нижнем холодильниках пропускаются через рубашку.
Данную установку можно рекомендовать не только для домашней лаборатории, но также для учебных и научных лабораторий, причем размеры ее могут определяться в соответствии с необходимой производительностью. Она должна сравняться по распространенности с обычным дистиллятором воды. |
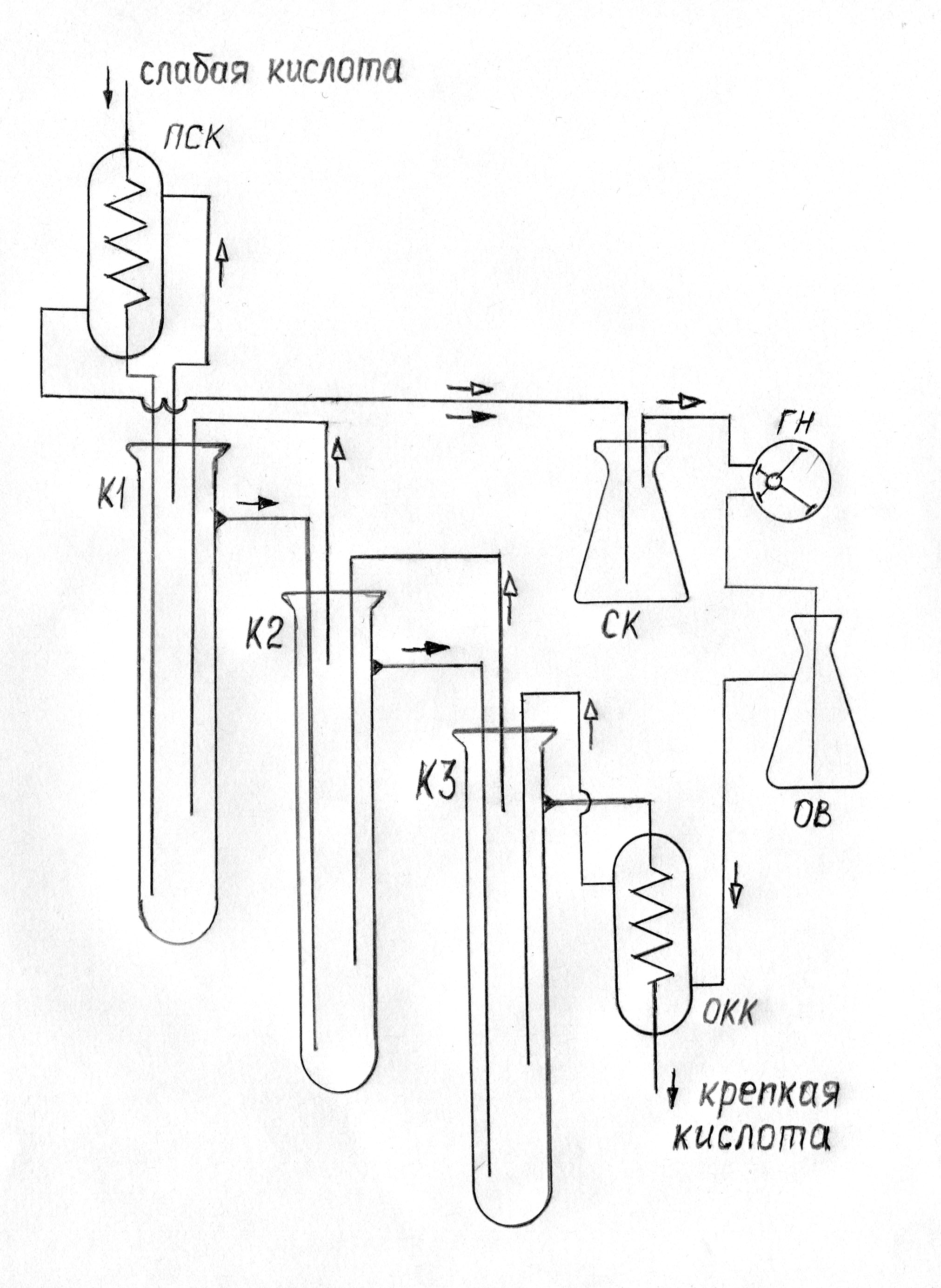
Рис. 12. Схема концентратора с регенерацией тепла ПСК - подогреватель слабой кислоты, К1, К2, К3 - концентраторы, СК - сборник конденсата, ГН - газовый насос, ОВ - осушитель воздуха, ОКК - охладитель крепкой кислоты. |
|
Схема установки, таким образом, аналогична промышленному концентратору, работающему в установке на рис.1 и подробно изображенному на рис. 13 (из книги "Справочник сернокислотчика", изд.2-е, под ред. К.М. Малина, М.: Химия, 1971 г.) [8]. Копировать конструкцию промышленного аппарата в стекле, разумеется, бессмысленно - ее следует адаптировать, и установка на рис. 9 является адаптацией, возможно, не лучшей.
_______________________________________________ 8 Малин К.М. (ред.) Справочник сернокислотчика (1971) [ссылка] |
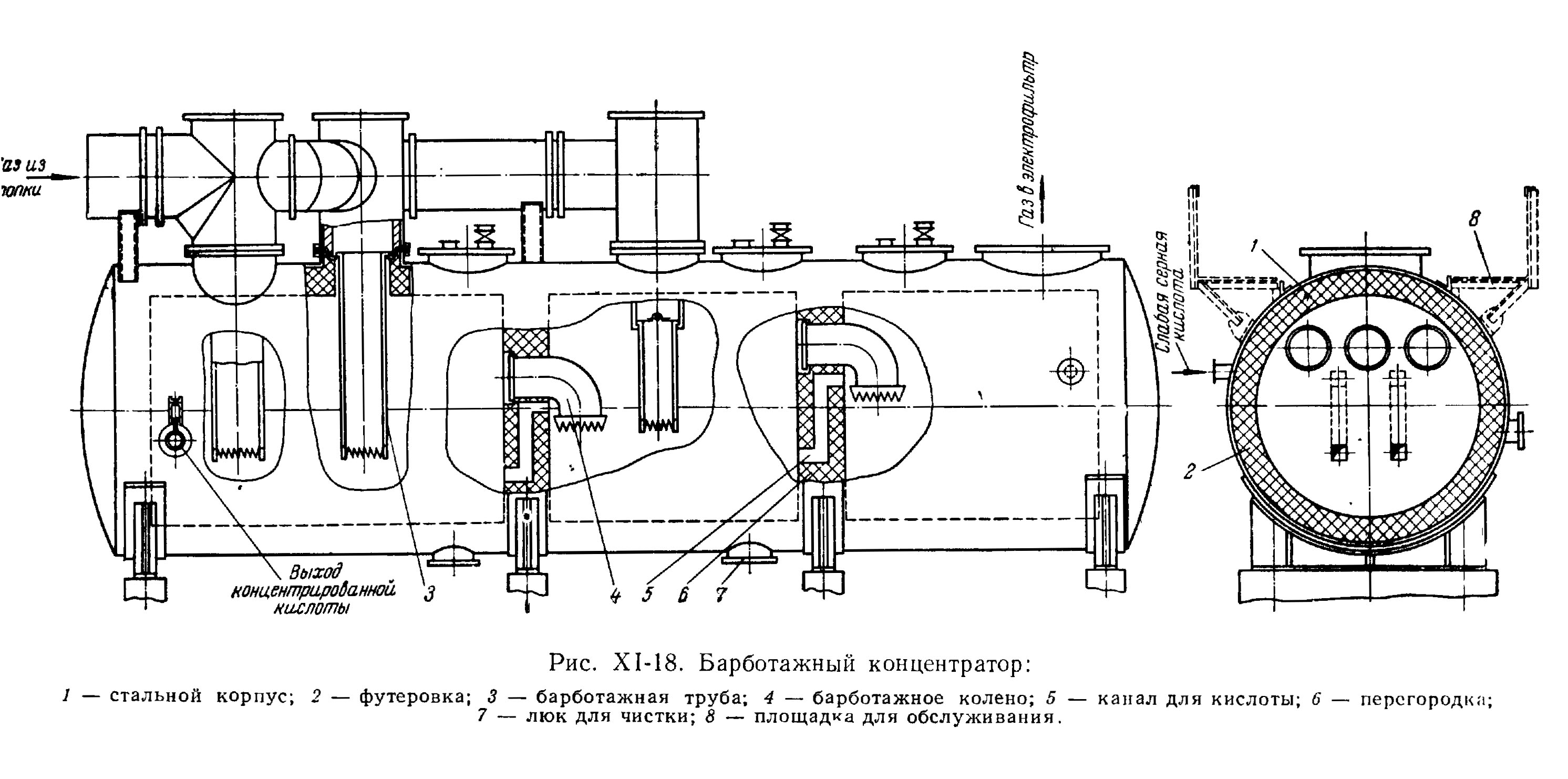
Рис.13. Концентратор промышленной установки по рис. 1 |
|
Постройка непрерывного концентратора для получения олеума пиролизом полисульфатов наталкивается на технические трудности, которые кажутся непреодолимыми. Действительно, необходимо осуществить циркуляцию расплава солей между концентратором кислоты и регенератором соли, а для этого нужен насос. Однако непрерывное концентрирование азотной кислоты перегонкой в присутствии нитрата магния с циркуляцией его расплава реализовано в промышленности и считается прогрессивным методом. В частности, расплав гексагидрата нитрата магния перекачивают насосом обычной конструкции, как указывается уже упомянутой книге "Технология азотной кислоты", по всей видимости, шестеренным, пластинчато-роторным или даже, при больших подачах, центробежным.
Оригинальное решение этой проблемы найдено автором настоящей статьи. Идея заключается в использовании винта Архимеда - одного из простейших насосов, только винт должен располагаться не на наружной поверхности цилиндра, а на внутренней, точно так, как устроена бетономешалка (автобетоносмеситель с грушевидным барабаном, вращение которого в одну сторону перемешивает бетон, а в другую - осуществляет выгрузку). Конструкция аппарата приведена на рис. 14. Принцип действия ясен из рисунка. В корпусе наклонно установлена на подшипниковых опорах с приводом вращающаяся реторта из кварца или керамики, имеющая на своей внутренней поверхности однозаходную винтовую лопасть с достаточно большим числом витков (15-20). В реторту помещены соли, обеспечивающие отсутствие азеотропной смеси кислоты с водой. Для обогрева снаружи реторты имеется электроспираль, ток к которой подводится через контактные кольца (реторта может обогреваться и непосредственно пламенем горелки). Расплав солей зачерпывается лопастью и поднимается по винтовой линии при вращении реторты. Достигнув последнего, самого верхнего витка лопасти, расплав возвращается по нескольким трубкам-переливам, расположенным равномерно по окружности. Количество расплава в реторте выбрано таким, чтобы выходы трубок-переливов были скрыты под поверхностью расплава, препятствуя смешиванию газов из верхнего и нижнего концов реторты. В нижнюю часть реторты подается слабая кислота. Попадая в расплав солей, она теряет воду и образует полисульфат. По мере продвижения порций расплава соли вверх, выделяющиеся пары обогащаются серной кислотой, и при соответствующем выборе мощности обогрева и подачи слабой кислоты, вблизи верхнего конца (горловины) реторты полисульфаты переходят в пиросульфаты и выделяют серный ангидрид. Эффективности аппарата способствует использование принципа роторного испарителя (пленочное испарение). Диаметр горловины реторты равен внутреннему диаметру винтовой лопасти, и с малым зазором между ними внутрь реторты входит труба, разделенная продольной перегородкой на два канала, каждый открывающийся своим зевом, по которым производится отвод паров из реторты. Сравнительно большое число витков лопасти обеспечивает повышение гидравлического сопротивления, но все же полностью избежать смешивания паров из верхнего и нижнего концов реторты, снижающего эффективность концентратора, невозможно. Выход из положения - подача в среднюю часть реторты инертного газа (хотя бы сухого воздуха), расходящегося двумя потоками вверх и вниз и разносящего по отдельности потоки паров кислоты и водяного пара. |
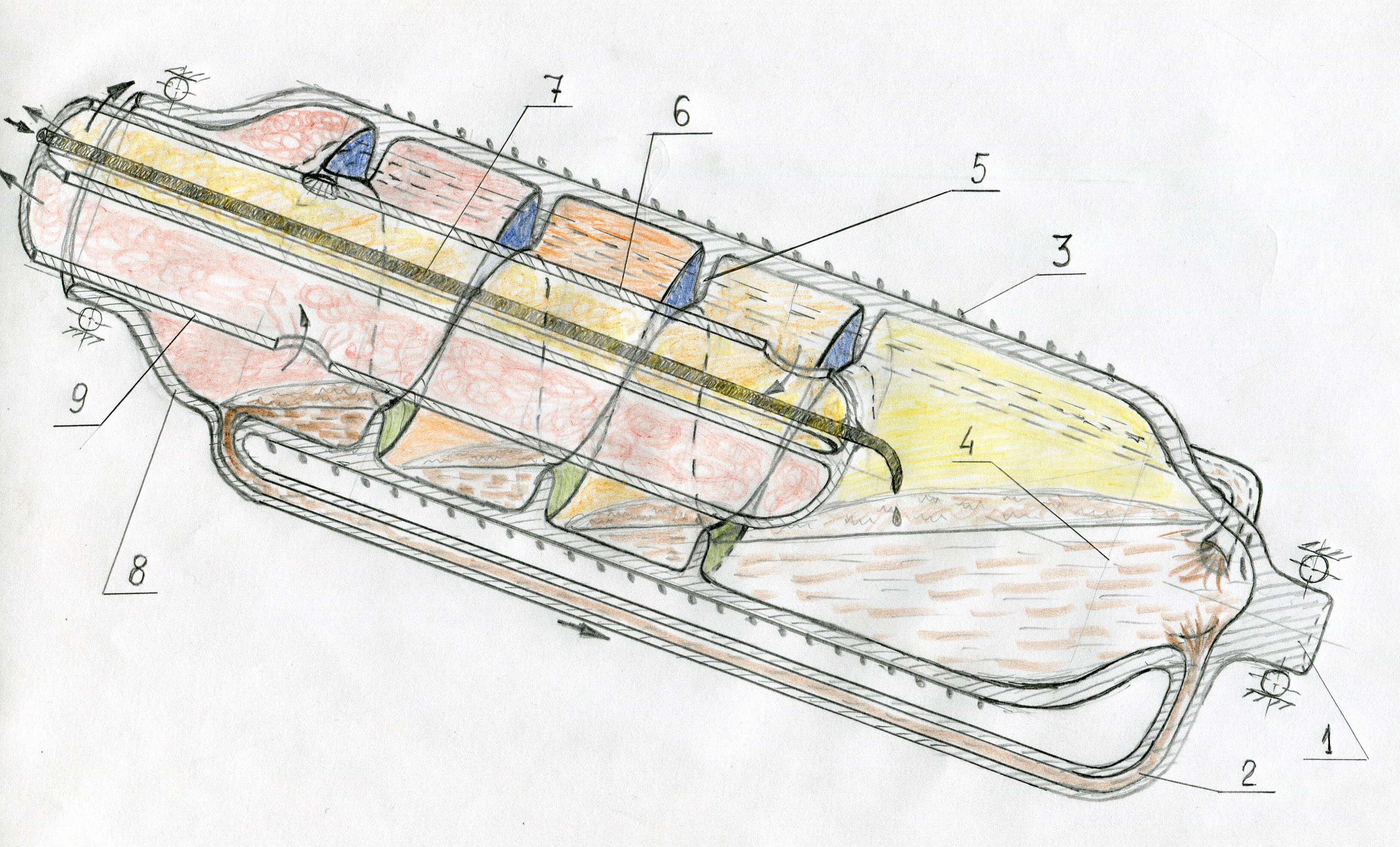
Рис. 14. Непрерывный универсальный концентратор (разрез) 1 - цапфа, 2 - перелив, 3 - нихромовая спираль, 4 - расплав солей, 5 - винтовая лопасть, 6 - верхняя часть неподвижной внутренней трубы с перегородкой для отвода паров воды, 7 - трубка для подвода слабой кислоты, 8 - вращающаяся реторта, 9 - нижняя часть трубы для отвода паров крепкой кислоты
|
|
Аппарат чрезвычайно прост, пригоден для концентрирования как серной, так и азотной кислоты (при использовании соответствующей соли), а возможно, и для разделения изотопов методом изотопного обмена в многокаскадной установке, но его единственная главная деталь - реторта с внутренней винтовой лопастью и переливами - не может быть изготовлена в домашней лаборатории. Автор выражает надежду, что промышленность освоит массовый выпуск этой детали, и данный концентратор также станет широко распространенным.
В заключение надо еще раз напомнить, что концентрированная серная кислота является опасным веществом, вызывающим тяжелые ожоги. Аппаратура должна иметь прочные крепления, и обязательно следует предусматривать возможность разлива горячей кислоты (ставить поддон, лучше с песком для отнятия тепла и прекращения испарения кислоты). При работе с аппаратурой следует соблюдать правила техники безопасности и по возможности избегать риска. |

|