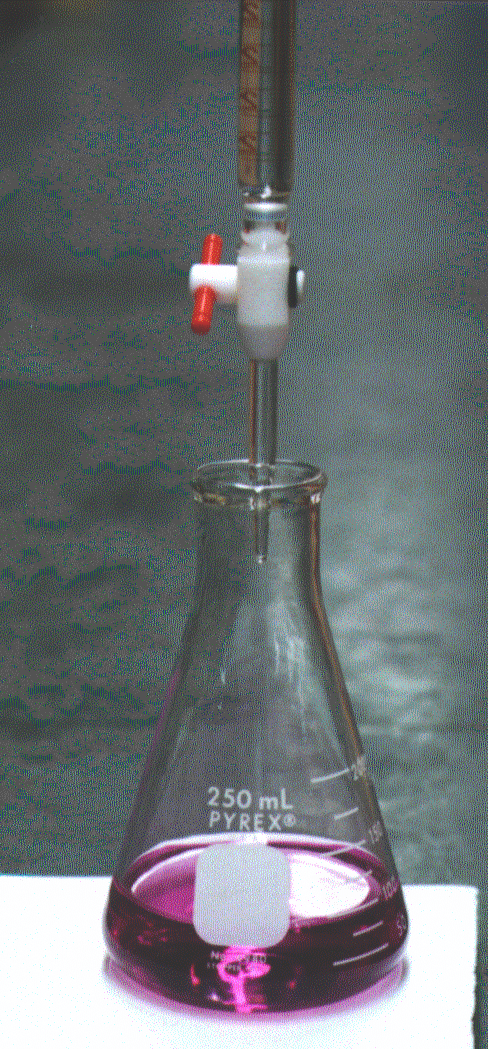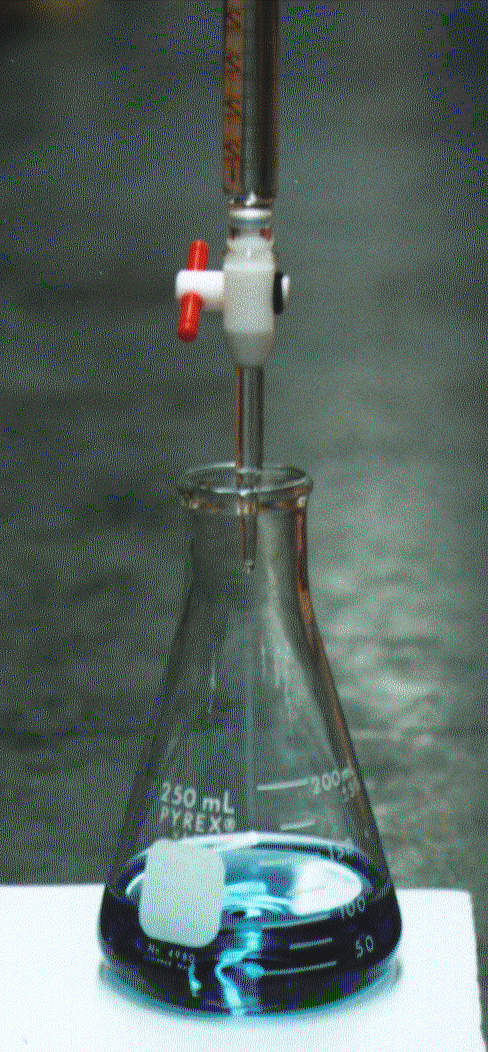|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
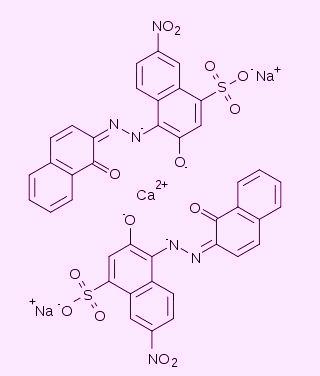
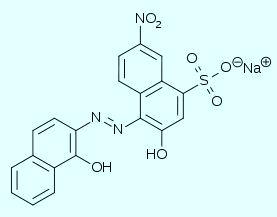
Эриохром черный Т - индикатор, который широко используется в аналитической химии для определения металлов (методом прямого или обратного комплексонометрического титрования). Обычно титрование с эриохромом черным ведут в среде аммиачного буфера (рН примерно 9.5) [1]. В частности, так определяют общую жесткость воды (содержание катионов кальция, магния и железа).
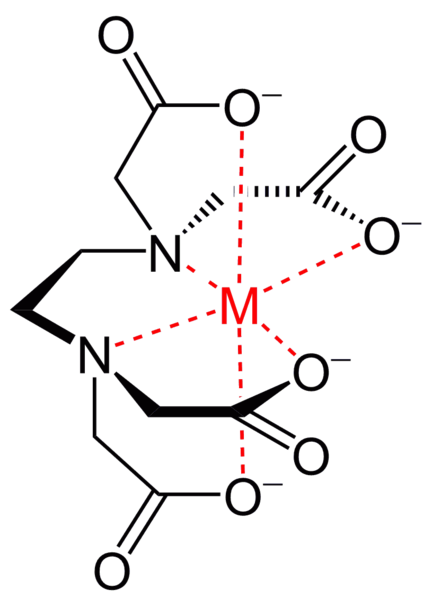
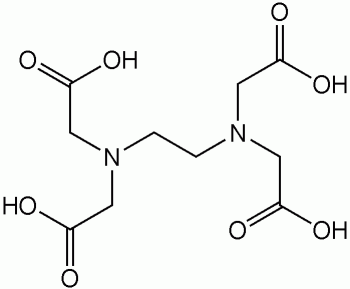
Метод основан на том, что эриохром черный Т образует окрашенные комплексы с солями двух-, трех- и четырехвалентных металлов. Данные комплексы менее прочны, чем комплексы этих же металлов с этилендиаминтетрауксусной кислотой, поэтому при действии последней они разрушаются. В результате происходит переход окраски.
При прямом титровании к аликвоте (заданному объему) анализируемого раствора прибавляют буфер и индикатор (буквально на кончике маленького шпателя) и титруют раствором ЭДТА (другие названия: трилон Б, натриевая соль этилендиаминтетрауксусной кислоты) до начала перехода винно-красной окраски в голубую.
В случае обратного титрования к аликвоте анализируемого раствора добавляют избыток раствора ЭДТА (точно известное количество), затем буфер и индикатор, после чего титруют солью цинка или магния (с точно известной нормальностью) до начала перехода голубой окраски в винно-красную.
В среде аммиачного буфера эриохром черный окрашен в голубой цвет. С катионами некоторых металлов (например, Mg, Ca, Zn) эриохром черный образует комплексы, окрашенные в винно-красный цвет. При действии ЭДТА эти комплексы разрушаются, что и объясняет изменение окраски при титровании.
До широкого внедрения в практику физико-химических и физических методов анализа титрование с ЭДТА (комплексонометрическое титрование) активно применялось для определения содержания металлов в растворах. Наряду с эриохромом черным Т используются и другие комплексонометрические индикаторы, например, ксиленоловый оранжевый и мурексид.
|