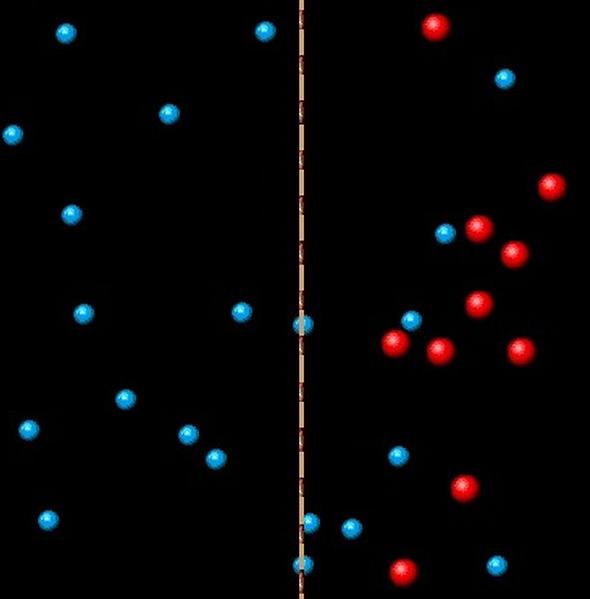
Схема осмоса. Частицы растворителя (синие) способны пересекать полупроницаемую мембрану, частицы растворенного вещества (красные) - нет
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 7 2014 Журнал Химиков-Энтузиастов |
Осмос В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Что такое осмос?
Представим себе сосуд, разделенный на две части вертикальной перегородкой. Слева в сосуд налита вода справа - водный раствор (какого-либо вещества). Уровни жидкостей одинаковы. Перегородка непростая. Она представляет собой полупроницаемую мембрану, которая пропускает молекулы воды (в обоих направлениях), но не пропускает молекулы растворенного вещества.
|

Схема осмоса. Частицы растворителя (синие) способны пересекать полупроницаемую мембрану, частицы растворенного вещества (красные) - нет
|
|
Слева - в чистой воде концентрация молекул H2O, разумеется, будет больше, чем справа, где кроме молекул воды присутствуют также молекулы растворенного вещества. В результате слева направо (т.е. из воды в раствор) будет переходить больше молекул H2O, чем в обратном направлении (т.е. из раствора в чистую воду). В результате уровень раствора в правой части сосуда будет увеличиваться, а уровень воды в левой части будет падать.
|
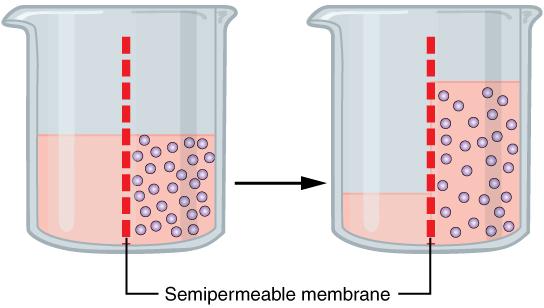
Схема осмоса (молекулы растворенного вещества обозначены шариками, молекулы воды не показаны). |
|
Перепад уровней создаст гидростатическое давление, которое усилит переход молекул H2O в обратном направлении - справа налево (из раствора в воду). Чем больше разница уровней жидкости в сосудах, тем выше и гидростатическое давление. В определенный момент наступит равновесие, когда через мембрану в обоих направлениях будет переходить одинаковое количество молекул воды. Подъем жидкости в сосуде с раствором прекратится.
Как уже было сказано, что для молекул растворенного вещества переход через полупроницаемую мембрану запрещен. В общем случае в одной из частей сосуда может находиться не вода, а более разбавленный раствор того же вещества (см. рисунок ниже). |
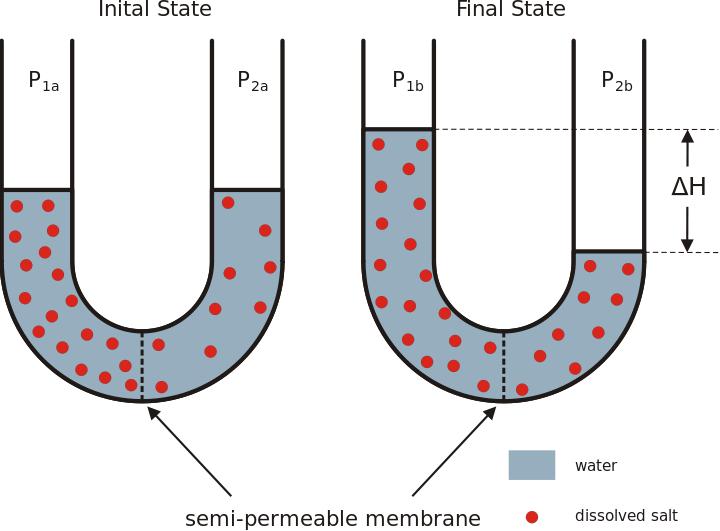
Схема осмоса (молекулы растворенного вещества обозначены шариками, молекулы воды не показаны) Обратите также внимание, что на рисунке в правой части сосуда налит более разбавленный раствор, а в левой - более концентрированный раствор. В приведенном до этого примере вместо более разбавленного раствора была чистая вода. |
|
Такой процесс перехода молекул растворителя через полупроницаемую мембрану в направлении раствора с более высокой концентрацией растворенного вещества называется осмосом.
Давление, которое создает растворитель в результате осмоса, называется осмотическим давлением. В описанном выше опыте осмотическое давление уравновешивается гидростатическим давлением за счет перепада уровней жидкостей между правой и левой частью сосуда. Осмотическое давление выражается формулой. π = C·R·T где π - осмотическое давление, Па; C молярная концентрация раствора, моль/м3; R - универсальная газовая постоянная [ 8.31 Дж/(моль·К) ]; T - температура раствора, К Нетрудно видеть, что уравнение для осмотического давления похоже на уравнение состояния идеального газа (уравнение Клапейрона). Обычно уравнение Клапейрона записывают так: p·V = (m/M)R·T где p - давление; V - объем; m - масса газа; M - молярная масса газа. Учитывая, что молярная концентрация газа, С равна C = m/(M·V) Можно записать уравнение состояния идеального газа в форме: p = [m/(M·V)]·R·T = C·R·T Уравнения состояния идеального газа p = C·R·T и осмотического давления π = C·R·T не только подобны по внешнему виду, но аналогичны по своей физической сути.
Мембраны для осмоса
А где взять полупроницаемую мембрану для осмоса?
Раньше был широко распространен целлофан. В прозрачную целлофановую пленку часто упаковывали пищевые продукты. Внешне такая пленка напоминает полиэтиленовую, люди часто их путали. Однако, полиэтилен - это полимер этилена [-CH2-CH2-]n, фактически - высокомолекулярный насыщенный углеводород. Целлофан состоит из целлюлозы, т.е. это полимер, в котором чередуются остатки глюкозы [C6H10O5]n. Целлофан получают из технической целлюлозы (через "вискозу" - ксантогенат целлюлозы). В наши дни целлофан почти вышел из массового употребления. По крайней мере, у нас. При этом целлофан является биоразлагаемым полимером - в отличие от полиэтилена. Все новое - хорошо забытое старое. Если полиэтилен обладает гидрофобными свойствами и не пропускает воду, то целлофан гидрофильный и воду пропускает. Причем целлофан как раз и может играть роль полупроницаемой мембраны - которая пропускает молекулы воды, но не пропускает молекулы растворенного вещества. Целлофан можно отличить от полиэтилена действие пламени: полиэтилен морщится, затем - плавится и горит. Целлофан просто горит, как бумага. Перед опытом целлофан нужно замочить в дистиллированной воде (чтобы он набух) и убедиться, что пленка не пропускает воду (в смысле, что через нее не прокапывает вода - за счет трещин в пленке). Другой вариант - пергамент (пергаментная бумага). Раньше она также часто использовалась для упаковки пищевых продуктов. В последнее время я пергамента не встречал, но - в отличие от целлофана - его можно легко получить в домашних условиях - действием серной кислоты на бумагу [1]. Пергамент перед опытом также замачивают в воде. Честно говоря, пергаментная бумага в качестве полупроницаемой мембраны у меня не вызывала особого доверия (такое впечатление было чисто субъективным). Хотелось поробовать целлофан. К счастью, целлофановая пленка оказалась у коллеги. Причем именно та, которая подходит для демонстрации осмоса. Уже замоченная. Поэтому сразу приступим к эксперименту. __________________________________________________ 1 Получение пергамента - см. Гроссе Э., Вайсмантель X. - Химия для любознательных. Основы химии и занимательные опыты. Изготовим пергаментную бумагу [ссылка] |

Целлофан |

Целлофан |

Целлофановая мембрана, замоченные в воде (перед опытом) |

|

|

Пергамент (пергаментная бумага) |
|
Осмос - эксперимент
Можно было, конечно, попытаться разделить сосуд на две части целлофановой перегородкой, как это описано в начале статьи, но я решил, что чем проще - тем лучше. Закрыл дно стеклянной трубки (диаметром 2 см) целлофановой пленкой. Для плотного соединения тщательно примотал пленку к трубке капроновой ниткой. Закрепил трубку в штативе и налил в нее дистиллированной воды, подержал несколько минут - убедился, что вода не прокапывает (сквозь возможные трещины в пленке или неплотности в месте присоединения целлофана к трубке).
|

Мембрана из целлофана (перед опытом) |

|

|

|
|
Вылил из трубки дистиллят. Растворил 7 г хлорида натрия в 20 мл дистиллированной воды (небольшая часть соли не растворилась, но я не стал ждать и слил раствор с осадка, т.к. мы проводим не количественный, а качественный эксперимент). Посмотрел по справочнику: приготовленный раствор хлорида натрия близок к насыщенному (при 20° С растворимость хлорида натрия 35.9 г в 100 мл воды). Перелил раствор в трубку с целлофановой мембраной. Уровень раствора отметил на стекле маркером.
Поместил трубку в полулитровую банку с дистиллированной водой и закрепил ее в штативе - так, чтобы уровень воды в банке и уровень раствора трубке совпадали. |

|

|

|

|

|

|

|

|

|
|
Теперь осталось ждать. Уже через 20 минут стало заметно, что уровень воды в трубке поднимается. Оставил на ночь, накрыв банку с трубкой полиэтиленовым кульком (чтобы уменьшить испарение). Температура в лаборатории - около 10°С.
Утром обнаружил, что раствор в трубке поднялся на 45 мм относительно уровня воды в банке. Уровень воды в банке немного опустился (что было видно по метке, нанесенной маркером на трубке). Вода из банки перешла через полупроницаемую мембрану в трубку с насыщенным раствором хлорида натрия. Это и есть осмос. Через несколько часов убедился, что уровень воды в цилиндре больше не поднимается: равновесие достигнуто. Таким образом, я впервые в жизни проделал успешный эксперимент по наблюдению осмоса (в 38 лет...) Собственно, можно было и закругляться. |

|

|

|

|

|

|
|
Однако это еще не все.
Во-первых, когда я увидел, что уровень воды в банке опустился ниже метки, нанесенной на трубку, решил добавить в банку еще немного воды - чтобы уровень воды в банке поднялся до метки на трубке. Добавляя дистиллированную воду, обнаружил, что она не сразу смешивается с водой в банке (когда струя врывается в воду, возникает диффузная граница раздела). Это означало одно: что в банке уже не дистиллят, а раствор хлорида натрия. Попробовал содержимое банки на вкус - так и есть: вода солоноватая (пробовать что-либо из лабораторной посуды очень не рекомендуется, но я не удержался). Вывод: целлофановая мембрана является полупроницаемой только теоретически. На практике оказалось, что она пропускает не только молекулы воды, но и растворенное вещество (ионы натрия и хлора). Конечно в меньшей мере, чем молекулы воды (иначе бы не было осмоса). Во-вторых, в момент начала опыта внутри трубки был насыщенный раствор хлорида натрия, но в результате осмоса в трубку (через мембрану) устремилась вода. В результате раствор перестал быть насыщенным и его осмотическое давление уменьшилось. Раз так, в трубку с раствором можно добавить еще твердого хлорида натрия - он должен раствориться (за счет воды, которая перешла в трубку из банки). В результате раствор в трубке должен подняться еще выше (т.к. после поступления очередной порции воды раствор в трубке остался бы насыщенным - разбавление компенсировалось бы растворением новых порций соли). Переместил трубку в стакан со свежей дистиллированной водой. Укрепил так, чтобы уровень воды в стакане совпал с меткой на трубке (которая зафиксировала начальный уровень воды в момент начала опыта в банке). Добавил в трубку 4 г твердого NaCl. Отметил новый уровень раствора в трубке (после добавления соли уровень раствора чуть поднялся, поскольку твердая соль вытеснила равный по массе объем воды - по закону Архимеда). |

|

|

|

|

|
|
Решил подкрасить воду в цилиндре красителем (чтобы эксперимент был более наглядным). Под руку попался мурексид (используется как индикатор для комплексонометрического титрования). Добавил на кончике ножа мурексида в трубку с раствором хлорида натрия. Жидкость в трубке окрасилась розовый цвет. - Это позволило сделать более четкое фото, поскольку вода в стакане оставалась бесцветной.
Однако вскоре я обнаружил, что вода на дне стакана слегка окрасилась в розоватый цвет. Сначала - очень слабо и только на дне. Окраску было четко видно глазом, но ее едва ли удалось зафиксировать на фотографиях. |

|

|

|

|

|

|

|

На фотографиях это видно плохо, но вода в стакане быстро стала слегка розовой: молекулы красителя прошли сквозь целлофановую мембрану
|

|

Нижняя метка - уровень раствора до добавления твердого хлорида натрия, верхняя метка - после добавления |
|
Уже через 10 минут стало заметно, что вода в трубке поднимается. - Осмос на лицо, но это еще не все.
Вода в стакане все более отчетливо окрашивалась мурексидом. Розовый цвет был как и раньше бледным, но со временем он становился все более заметным. |

|

|

|

|

|

|
|
Оставил на ночь.
На следующий день уровень раствора в трубке поднялся на 73 мм выше уровня воды в стакане, причем уровень воды в стакане упал ниже метки. Оставил стакан с трубкой на выходные (2 дня). Когда пришел на работу после выходных, обнаружил, что вода в стакане сильно окрасилась в розовый цвет. Причем не вся, а только та ее часть, которая была ниже целлофановой мембраны. Верхний слой воды в стакане остался почти бесцветным. Наблюдаемые явления объяснить просто. Через "полупроницаемую" целлофановую мембрану проходят не только ионы натрия и хлора, но и молекулы красителя. - Именно потому вода в стакане окрасилась. Вода в стакане разделилась на два слоя, потому что ниже мембраны собрался более тяжелый раствор хлорида натрия, который к тому же окрасился мурексидом. А выше мембраны осталась неокрашенная вода (в которую попало гораздо меньше соли, поэтому она имеет меньшую плотность). |

|

|

|

|

|

|

|

|
|
В следующие дни уровень воды в трубке с раствором хлорида натрия стал падать. Это логично: если ионы натрия и хлора проникают за счет диффузии через целлофановую мембрану, значит разница концентраций соли (между жидкостью в трубке и стакане) уменьшается, следовательно, уменьшается и осмотическое давление.
Через определенное количество дней концентрация соли в стакане и трубке должны сравняться (за счет диффузии), в результате сравняется и уровень растворов в стакане и трубке - т.к. осмотическое давление станет равным нулю. Но я не стал этого ждать и прекратил эксперимент.
Изотонический коэффициент (еще раз про "неидеальности")
Теперь некоторые дополнения. Приведенное в начале статьи уравнение для осмотического давления π = C·R·T работает для разбавленных растворов, причем, только тогда, когда вещество в растворе не диссоциирует - т.е. не является электролитом. Если имеет место электролитическая диссоциация растворенного вещества, уравнение приобретает вид: π = i·C·R·T где i - изотонический коэффициент. Например, для очень разбавленного раствора хлорида натрия i=2 NaCl, поскольку формульная единица хлорида натрия диссоциирует в растворе на 2 частицы (напомню: степень диссоциации хлорида натрия в растворе равна 1, т.к. хлорид натрия - сильный электролит). NaCl = Na+ + Cl- Если степень диссоциации какого-то бинарного электролита AB меньше единицы (неполная диссоциация), значит, для него будет i<2. Теоретически для сильных электролитов изотонический коэффициент равен числу ионов, на который данный электролит диссоциирует в растворе. На практике не все так просто. Например, для 0.05 моляльного раствора NaCl изотонический коэффициент i равен 1.9 вместо 2 - поскольку в растворе имеет место взаимодействие между ионами (ионная ассоциация). Причем, для электролитов с двух- и многозарядными ионами эта разница еще более существенна, чем для хлорида натрия (однозарядные ионы). Обратите внимание, что изотонический коэффициент i не во всех случаях больше единицы (или равен единице). Ведь кроме диссоциации вещества в растворе может происходить и противоположный процесс - ассоциация молекул. Например, карбоновые кислоты (уксусная, бензойная и др.), будучи растворенными в бензоле, образуют димеры (за счет водородных связей): |
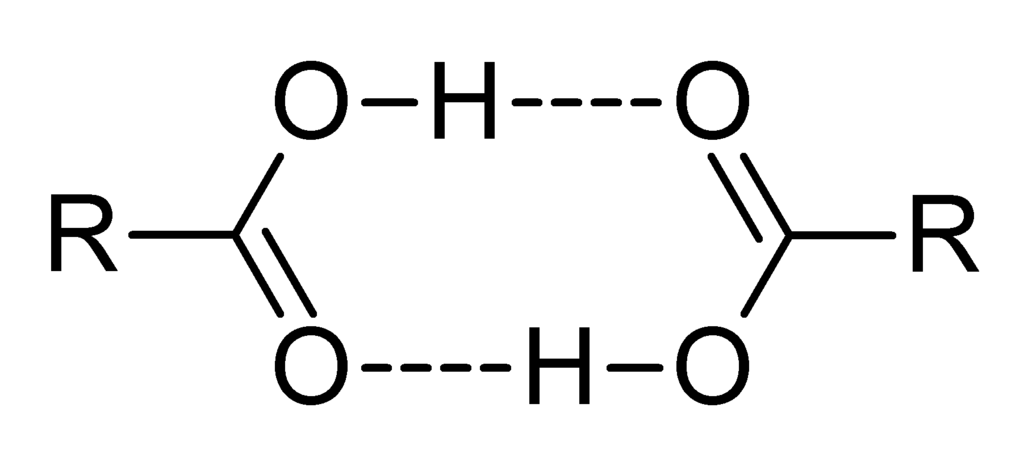
Димеры карбоновых кислот |
|
Осмос в природе
У читателей могло сложиться впечатление, что осмос - что-то вроде забавной игрушки: налил раствор в трубку - и он поднялся. Впечатление это неверное: осмос играет огромную роль в живой природе, науке и технике. Оболочки живых клеток представляют собой именно полупроницаемые мембраны, которые пропускают молекулы воды, кислорода, но для многих других молекул, например, молекул белков оболочки живых клеток непроницаемы или проницаемы ограничено.
Осмос исключительно важен для поддержания и регулирования процессов жизнедеятельности организмов. Подъем воды и питательных веществ от корней растения к стеблям и листьям происходит не только за счет капиллярного эффекта, но и за счет осмотического давления. Листья непрерывно испаряют воду (а также используют ее для фотосинтеза), что позволяет поддерживать концентрацию растворенных веществ, а с ней - и осмотическое давление внутри растения. Когда мы посыпаем овощи или фрукты солью или сахаром - они "пускают сок". Это одно из многих проявлений осмоса. Например, посыпая клубнику сахаром, мы создаем на поверхности плодов более высокую концентрацию сахара, чем внутри клубники. В результате вода переходит из растительных клеток наружу. Аналогичное происходит, когда мы добавляем соль к нарезанной капусте - с целью ее заквасить. Капуста "пускает сок" [2]. Кровь человека - не чистая вода, а сложный раствор, который имеет свое осмотическое давление. Изменение этого осмотического давления может иметь весьма неприятные последствия (вплоть до трагических). Поэтому для инъекций (уколов) или капельниц используют не чистую воду, а физиологический раствор (изотонический раствор, "физраствор") - стерильный раствор солей, который имеет такое же осмотическое давление, как и плазма крови. В простейшем случае это 0.9% раствор хлорида натрия NaCl. Физиологический раствор также используют в качестве частичного заменителя крови. В микробиологии при работе с бактериями микробиологи используют для разбавления исследуемых препаратов не воду, а физиологический раствор. В чистой (дистиллированной) воде бактерии могут попросту разбухнуть и лопнуть - за счет внутреннего осмотического давления. Если в организм человека вместо чистой воды или физиологического раствора ввести крепкий раствор соли, - безвредной соли вроде хлорида натрия (или хлорида калия), то последствия могут быть непоправимыми: смерть или потеря здоровья. Повышение осмотического давления крови несовместимо с нормальной жизнедеятельностью человека. __________________________________________________ 2 Эксперименты по осмосу в растениях описаны в книге Олег Ольгин - Опыты без взрывов. ОТЧЕГО ЯГОДЫ ПУСКАЮТ СОК [ссылка] |
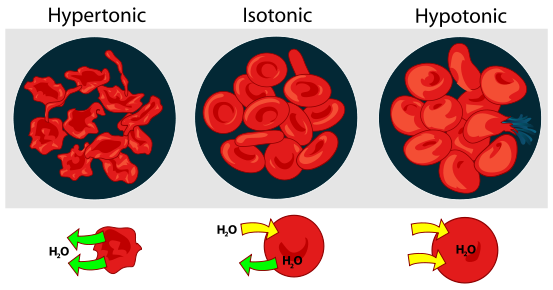
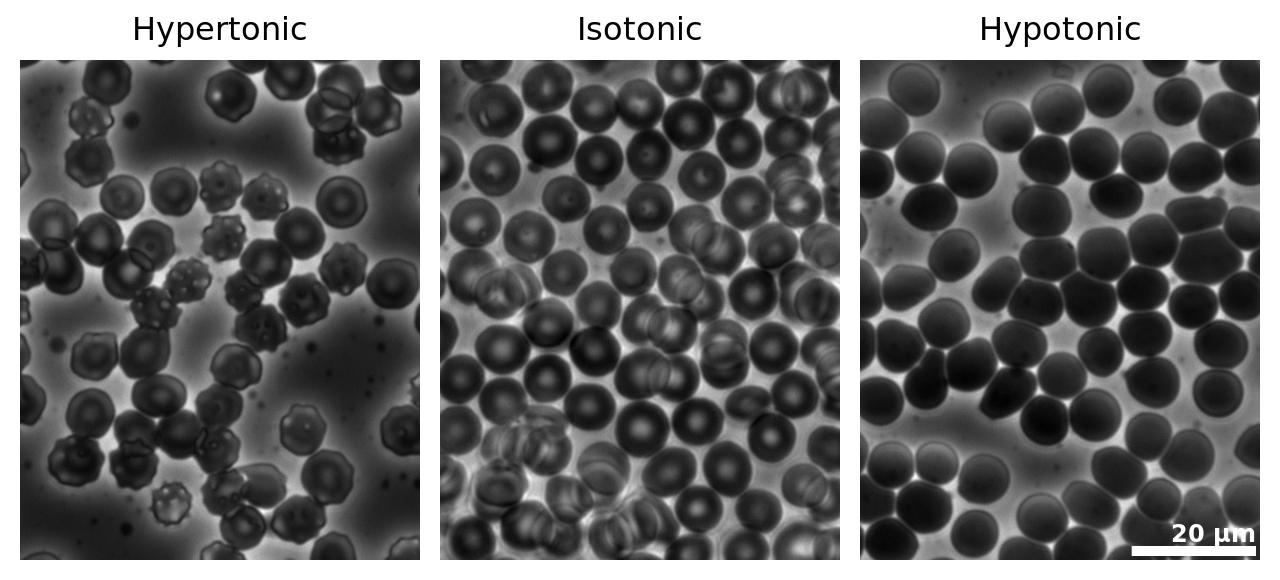
Эритроциты (красные кровяные тельца) в случае высокого (слева), нормального (в центре) и пониженного (справа) осмотического давления крови.
Сверху дана схема, внизу - фотография под микроскопом. Стрелочками показано направление перемещения воды сквозь мембрану клеток. |
|
|
По аналогичной причине концентрация растворенных солей сильно влияет на водные организмы. Конкретные биологические виды и целые экосистемы приспособились жить в воде с определенной соленостью. Одни организмы живут в пресной воде, другие - в соленной, третьи - в настоящем рассоле. Если концентрация солей (и других растворенных веществ) в водоеме выйдет за допустимые пределы (поднимется или упадет), то обитатели этих водоемов могут погибнуть из-за неблагоприятного осмотического давления (высокого или наоборот - низкого).
Величина осмотического давления в живых организмах
Согласно Большой советской энциклопедии:В оптимальных условиях осмотическое давление клеточного сока наземных органов болотных растений колеблется от 2 до 16 ат, у степных - от 8 до 40 ат. В разных клетках растения осмотическое давление может резко различаться (так, у мангровых осмотическое давление клеточного сока около 60 ат, а осмотическое давление в сосудах ксилемы не превышает 1-2 ат). У гомойосмотических организмов, т. е. способных поддерживать относительное постоянство осмотического давления, средние величины и диапазон колебаний осмотического давления различны (дождевой червь - 3.6-4.8 ат, пресноводные рыбы - 6.0-6.6, океанические костистые рыбы - 7.8-8.5, акуловые - 22.3-23.2, млекопитающие - 6.6-8.0 ат). У млекопитающих осмотическое давление большинства биологических жидкостей равно осмотическому давлению крови (исключение составляют жидкости, выделяемые некоторыми железами, - слюна, пот, моча и др.). Осмотическое давление, создаваемое в клетках животных высокомолекулярными соединениями (белки, полисахариды и др.), незначительно, но играет важную роль в обмене веществ. Для сравнения: 4%-ный раствор сахара при комнатной температуре имеет осмотическое давление около 3 ат, а 53%-ный - около 1020 ат (!); осмотическое давление морской воды - около 2.7 ат. (Физическая энциклопедия)
Осмос в науке и технике
Явление осмоса широко используется в науке. Например, для определения концентрации растворов и исследования превращений веществ в растворе (диссоциация, ассоциация, степень полимеризации и т.д.) Осмос исключительно важен при исследованиях биологических систем.
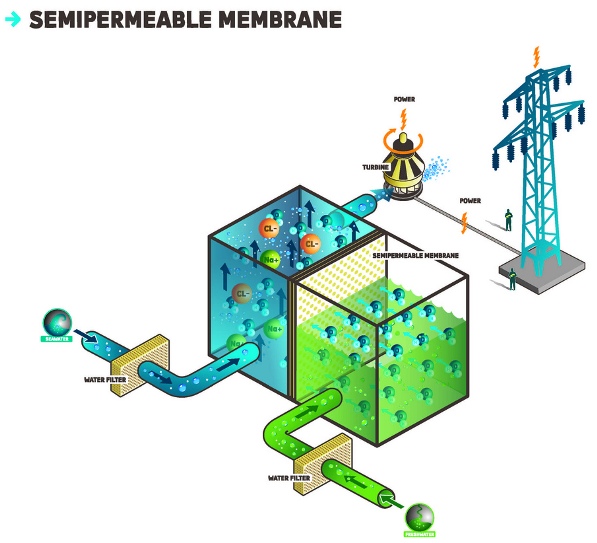
Осмос можно и нужно использовать для получения электрической энергии. В месте, где река впадает в море, мы имеем два вида воды с различным осмотическим давлением: пресную воду реки и соленую морскую. Если речную и морскую воду разделить полупроницаемой мембраной, то уровень морской воды будет подниматься - за счет осмотического давления. Поднятую вверх воду можно пустить на турбины для выработки электроэнергии по принципу ГЭС (гидроэлектростанция). Собственно, поднимать столбик воды не обязательно: уже само возникшее избыточное давление воды можно использовать для выработки электрической энергии. В Норвегии в 2009 году построена первая опытная электростанция, которая работает за счет осмоса. Осмотическое давление, которое возникает между морской водой и пресной водой фьорда, служит для выработки электроэнергии. Основная проблема подобных установок - мембраны. Такая же проблема остро стоит и в установках обратного осмоса, которые описаны ниже. Отмечу также, что осмотическая электростанция не работает по принципу вечного двигателя, поскольку она потребляет "энтропийную энергию" (энергию за счет перепада концентраций растворенных веществ). Чтобы такая электростанция работала, необходим приток энергии Солнца, которая тратится на испарение воды из моря, чтобы потом эта вода (уже пресная) могла попасть в реку. Другими словами, градиент (разница) концентраций растворенных веществ в морской и речной воде поддерживается за счет Солнца, которое играет роль нагревателя в гигантской перегонной установке. |

Первая в мире осмотическая электростанция (Норвегия) |
|
|
Обратный осмос
В технике явление обратного осмоса используется для опреснения и очистки воды. Обратный осмос основан на том, что воду и раствор соли разделяют полупроницаемой мембраной. Роль раствора соли может, например, играть морская вода, которую нужно опреснить. При "обычных обстоятельствах" молекулы воды должны переходить из чистой воды в раствор соли - за счет осмотического давления. Но если к раствору соли приложить внешнее давление, которое превышает осмотическое, то молекулы воды пойдут через мембрану в обратном направлении. Объем чистой воды увеличится, а объем раствора соли уменьшится (зато концентрация соли в последнем возрастет). В результате мы получим чистую воду и более крепкий рассол, который отбрасывают.
Другими словами, при обратном осмосе под действием внешнего давления молекулы воды переходят через мембрану из раствора с меньшей концентрацией растворенного вещества в раствор с бОльшей концентрацией растворенного вещества. Опреснение воды или очистка сточных вод - далеко не единственное применение обратного осмоса. С помощью обратного осмоса получают чистую (и практически стерильную) воду для нужд медицины и научных исследований. Обратный осмос позволяет проводить концентрирование соков, молочной сыворотки и других пищевых жидкостей без их термической обработки. Вместе с тем, технология обратного осмоса довольно сложная и дорогая в реализации. Чтобы превысить осмотическое давление растворов, необходимы специальные насосы и трубопроводы, способные работать в условиях высокого давления. Например, осмотическое давление морской воды около 0.27 МПа (2.7 ат), причем для эффективной работы установки эту величину нужно многократно превысить (в частности, потому что в процессе опреснения концентрация солей в "отжатой" морской воде увеличивается, а с ней растет и осмотическое давление). Осмотические мембраны очень капризны, в частности, они очень боятся механических загрязнений (которых может быть сколько угодно в природной или сточной воде). |

|

Мембрана для обратного осмоса |