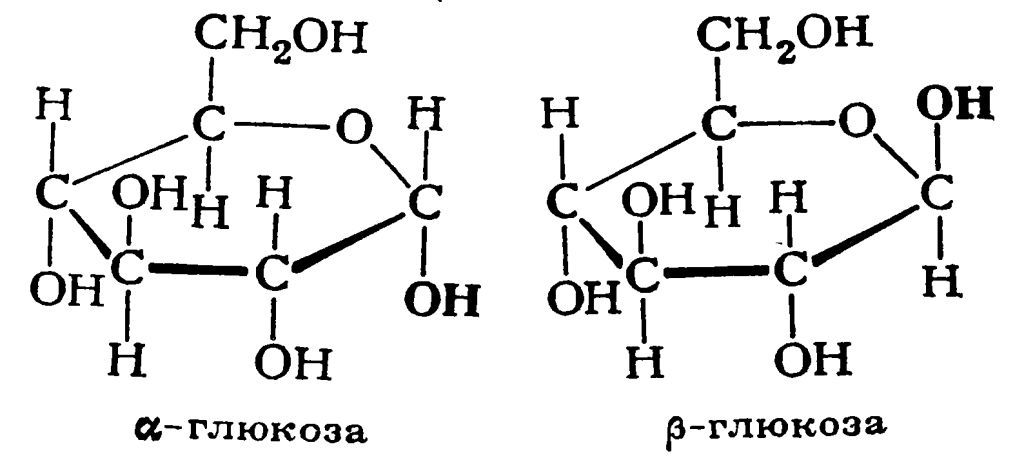
Глюкоза
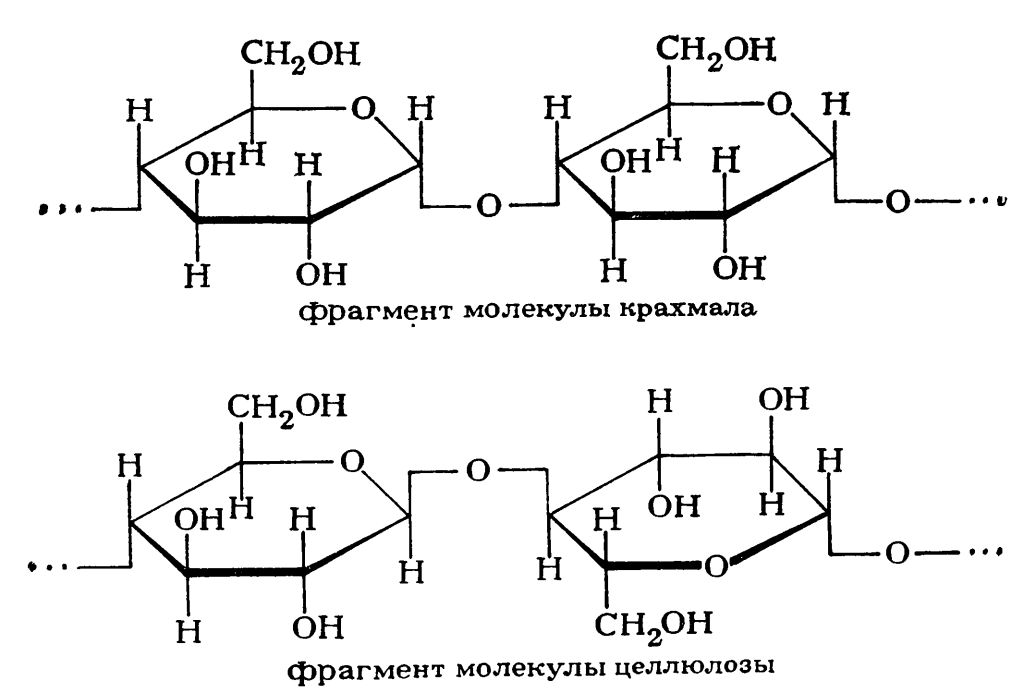
Крахмал и целлюлоза
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 8 2013 Журнал Химиков-Энтузиастов |
Реактив Швейцера и растворение целлюлозы В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Целлюлоза - биологический полимер, который состоит из звеньев β-глюкозы. Целлюлоза является важным строительным материалом растений. В отличие от другого полимера - крахмала, который состоит из звеньев α-глюкозы, целлюлоза практически нерастворима в воде.
|

Глюкоза |

Крахмал и целлюлоза |
|
Крахмал можно растворить в воде, целлюлозу - нет, но даже в случае крахмала существует особенность. Чтобы приготовить раствор крахмала в воде (крахмальный клейстер), нужно нагреть воду до кипения, затем взболтать несколько чайных ложек крахмала в небольшом количестве холодной воды - чтобы образовалась негустая, однородная суспензия. И, наконец, эту суспензию тонкой струйкой выливают в кипящую воду - при хорошем перемешивании. Образуется крахмальный клейстер. Если же вы попробуете добавлять твердый крахмал в горячую воду, то, скорее всего, получите комки.
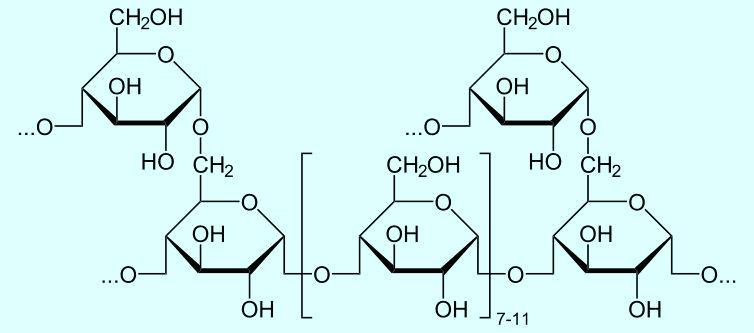
Кстати, крахмал бывает разный. В растениях встречаются две разновидности крахмала: амилоза и амилопектин. Существует также и "животный крахмал" - гликоген [1-1]. Чем отличаются упомянутые полимеры глюкозы? Амилоза - линейный полимер, амилопектин имеет разветвления цепи, гликоген содержит гораздо больше разветвлений и имеет бОльшую молекулярную массу. ___________________________________________________ 1-1 Название "животный крахмал" применительно к гликогену не совсем верное, но оно употребляется часто. |
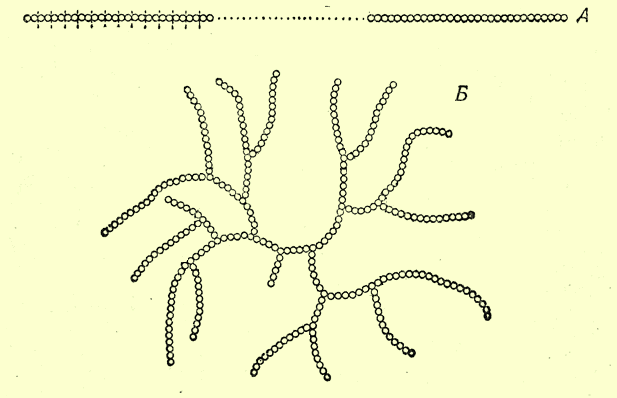
Молекула амилозы (А) и амилопектина (Б) |
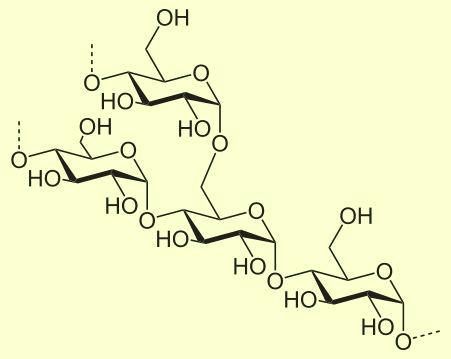
Строение молекулы амилопектина (показано место разветвления) |
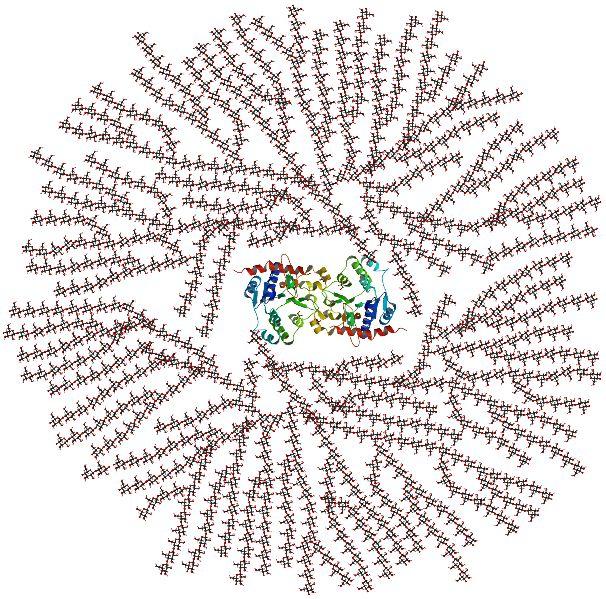
Молекула гликогена (в центре показан белок гликогенин, который играет роль "затравки", на которой начинается превращение глюкозы в гликоген) |
Строение молекулы гликогена |
|
С крахмалом мы разобрались, теперь вернемся к целлюлозе. Тот факт, что целлюлоза нерастворима в воде, не означает, что ее нельзя растворить. Во-первых, существуют способы перевести целлюлозу в раствор с ее разрушением - путем гидролиза или окисления.
При кипячении целлюлозы с разбавленными растворами кислот (серной или соляной) целлюлоза гидролизуется с образованием β-глюкозы (другими словами, растворяется). Этот изомер глюкозы не усваивается человеческим организмом, но из него с успехом производят спирт [K1]. Такой спирт называется "гидролизным". Правда, гидролизный спирт малопригоден "для внутреннего" употребления, поскольку он содержит немало вредных примесей, в частности - метанол [K2]. Ведь древесина, которая служит сырьем для получения сперва глюкозы, а затем гидролизного спирта - не чистая целлюлоза. При нагревании фильтровальной бумаги, которая состоит в основном из целлюлозы, с концентрированной хлорной кислотой бумага растворяется. Если хлорная кислота достаточно крепкая, бумага исчезает бесследно: раствор сначала становится коричневым, но вскоре обесцвечивается. Как вы уже догадались, хлорная кислота окисляет бумагу до углекислого газа и воды. Однако ломать - не строить. Существуют ли способы обратимо перевести целлюлозу в раствор, т.е. так, чтобы потом целлюлозу снова можно было выделить из раствора? Оказывается, да и их несколько. Обработанная щелочью целлюлоза растворяется при действии сероуглерода, при этом образуется ксантогенат целлюлозы. При действии на ксантогенат целлюлозы раствора серной кислоты целлюлоза снова выделяется в твердую фазу. Этот метод лежит в основе производства вискозного шелка и целлофана. Раствор ксантогената целлюлозы (который в технике называют "вискоза") через маленькие отверстия - фильеры подают в т.н. "осадительную ванну" - раствор, который содержит разбавленную серную кислоту (а также сульфат цинка и сульфат натрия). В результате целлюлоза выделяется в виде нитки, которую наматывают на бобины. При производстве целлофана вискозу продавливают в осадительную ванну через специальные щели, в результате образуется тонкая прозрачная пленка. |

Вискозное волокно |
Получение вискозного волокна (прядильная машина). В осадительную ванну через узкие фильеры подается раствор ксантогената целлюлозы. Осадительная ванна представляет собой раствор серной кислоты, сульфата цинка и сульфата натрия. В результате образуется целлюлоза в виде тонкой нити (а также выделяется сероводород и сероуглерод).
Аналогичным методом получают целлофан, только раствор ксантогената целлюлозы продавливают не через фильеры, а через узкую щель |

Целлофан |
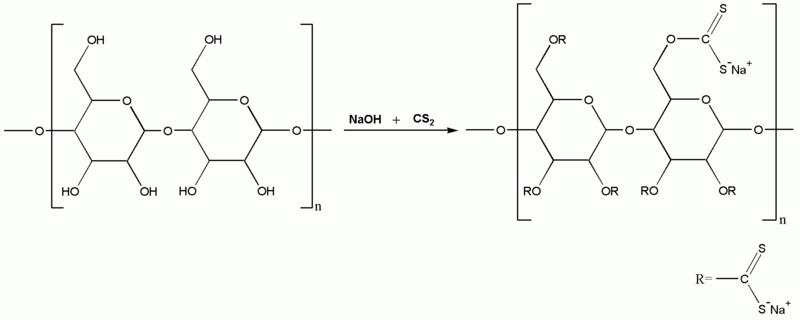
Получение ксантогената целлюлозы (вискозы) |
|
Описанный выше способ производства вискозного шелка и целлофана довольно вреден для здоровья людей и окружающей среды, ведь при реакции ксантогената целлюлозы с серной кислотой выделяется не только целлюлоза, но также сероводород и сероуглерод - ядовитая, очень летучая и очень огнеопасная жидкость. Не удивительно, что данный процесс стараются заменить другими - более безопасными и экологичными способами производства волокон из целлюлозы. Например, целлюлозу растворяют в N-метилморфолин-N-оксиде (NMMO), полученные таким способом вискозные волокна называют лиоцелл.
|
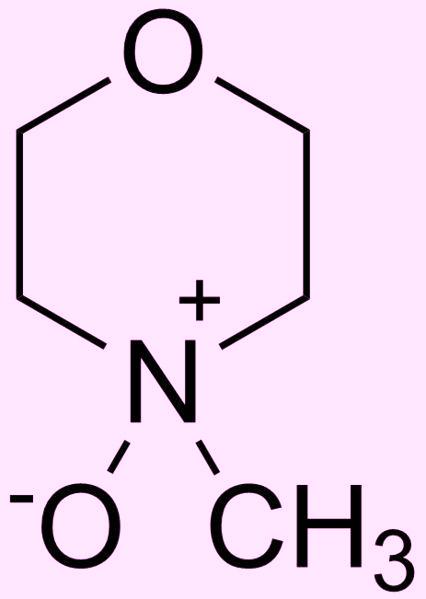
N-метилморфолин-N-оксид (NMMO) |
|
Существует еще один способ получения искусственного шелка из целлюлозы: сначала целлюлозу растворяют в аммиачном растворе гидроксида меди, затем из этого раствора получают нитку, продавливая раствор в разбавленную серную кислоту. Волокна, полученные таким способом, называют "медно-аммиачный шелк". Несмотря на то, что в описанной технологии не используется опасный сероуглерод, в наши дни она имеет лишь историческое значение (по крайней мере, автор не слышал, чтобы сейчас где-то остался завод производства шелка по медно-аммиачному способу). Вероятная причина - сложность технологического процесса и необходимость регенерации из растворов соединений меди, ведь медь - дорогой металл, а при высоких концентрациях - еще и токсичный.
Однако, растворение целлюлозы в аммиачном растворе гидроксида меди и последующее ее осаждение раствором кислоты - один из самых эффектных опытов, при этом совсем не важно, что соответствующая технология потеряла промышленное значение. Аммиачный раствор гидроксида меди, предназначенный для растворения целлюлозы, называется "реактив Швейцера". Готовят его следующим образом: из раствора сульфата меди [или другой соли меди (II)] осаждают гидроксид, который фильтруют, промывают и растворяют в избытке концентрированного (25%) раствора аммиака. При этом образуется аммиачный комплекс меди (II) интенсивно-синего цвета. CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 Растворение клетчатки в реактиве Швейцера Свежеосажденный гидрат окиси меди растворяют в аммиаке. Показывают, что в таком концентрированном растворе хлопчатобумажное волокно (берут гигроскопическую вату) [1-2] при взбалтывании или помешивании палочкой растворяется уже на холоду; растворение ускоряется при нагревании. При добавке кислоты клетчатка выделяется в виде студенистой массы. [Концентрированный раствор клетчатки рекомендуется влить, хорошо размешивая палочкой, в стакан с разбавленной соляной или серной кислотой (10-20%). Целлюлоза выделяется обратно в виде хлопьевидной белой массы. Реактив Швейцера проще всего получают растворением углемедной соли в 20%-ном аммиаке с таким расчетом, чтобы раствор содержал около 2,5% меди. Опыты проводят в широких конических бокалах. Как известно, аммиачный раствор клетчатки служит для изготовления искусственного волокна Паули ("Glanzstoff"). В. И.]" __________________________________________________ 1-2 В технике при получении искусственного волокна применяют мерсеризованную целлюлозу. Основный карбонат меди (он же: "углемедная соль", "основная углекислая медь", "основной карбонат меди") у меня был, но решил приготовить реактив Швейцера из более доступного сульфата меди (медный купорос). Взял 10 г медного купороса. Молярная масса медного купороса CuSO4·5H2O - 249.685 г/моль, молярная масса меди - 63.546 г/моль [K3], следовательно, в 10 г медного купороса содержится 10·63.546/249.685 =2.6 г меди. Для того чтобы перевести сульфат меди в гидроксид CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 необходимо: 2·10·40.00/249.685=3.2 г едкого натра (где 40.00 г/моль - молярная масса едкого натра). Я взял аж 10.7 г - потому что поленился делать расчет и взвесил едкий натр с явным избытком. Это оказалось ошибкой. Когда растворил вещества в воде и прибавил едкий натр к медному купоросу, то вместо голубого гидроксида меди я получил синий осадок: часть гидроксида перешло в черный оксид, который если и растворяется в аммиаке, то плохо. Что бы там не писали в учебниках, характерное свойство гидроксида меди - терять воду и переходить в оксид в присутствии избытка крепкой щелочи. Чтобы при растворении гидроксида меди получить раствор с концентрацией меди 2.5%, нужно добавлять раствор аммиака до тех пор, пока масса раствора будет равна 2.62/2.5·100= 105 г (что соответствует объему менее 100 мл). Осадок с фильтра перенес в стакан и добавил аммиак (25%) до тех пор, пока общий объем смеси не достиг 130 мл. Это гораздо больше, чем необходимо (не более 90-100 мл), но я надеялся растворить ту часть гидроксида меди, которая перешла в оксид. Большая часть осадка легко растворилась, однако немного оксида меди осталось на дне. Реактив Швейцера был готов к употреблению, но я перелил его в колбу и закрыл пробкой, отложив эксперименты на следующий день т.к. было уже поздно. Утром обнаружил, на дне осталось не так уж и мало черного оксида меди, однако, это было не страшно: концентрация меди в растворе 2.5% является желательной, но не обязательной. Сразу же можно сделать вывод, что при осаждении гидроксида меди для реактива Швейцера не стоит использовать большой избыток едкого натра, и, видимо, имеет смысл смешивать разбавленные растворы сульфата меди и щелочи. Раствор аммиаката меди осторожно декантировал с осадка в стакан и приступил к экспериментам. ________________________________________________________________________ 1 Г. Рупе Лекционные опыты по органической химии (1935) [ссылка] |

Сульфат меди |

Растворение сульфата меди |

Едкий натр |

Осаждение, фильтрование и промывка гидроксида меди |

|

|

|

|

|

|

|

|

|

Растворение гидроксида меди в аммиаке (собственно приготовление реактива Швейцера) |

|

|

Реактив Швейцера готов (если не считать небольшого количества осадка CuO) |
|
В стакан с реактивом Швейцера небольшими порциями стал добавлять хлопковую вату, перемешивая содержимое пластмассовым шпателем. Первые порции ваты быстро растворились, потом стал добавлять вату более крупными кусками - они растворялись гораздо медленнее, для этого требовалось интенсивное перемешивание и растирание шпателем. Когда раствор приобрел консистенцию киселя, я перестал добавлять вату: было ясно, что целлюлоза будет растворяться в реактиве Швейцера не бесконечно. После какого-то определенного предела очередная порция добавленной целлюлозы уже не растворится (причем я до сих пор не знаю, какое количество целлюлозы можно было добавить).
Реактив Швейцера непрозрачен, что уменьшает наглядность опыта, но продемонстрировать зрителям, что целлюлоза именно растворилась, а не просто осела на дно темно-синей жидкости очень легко. Например, можно перелить жидкость из стакана в стакан. |

Растворение целлюлозы в реактиве Швейцера |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Чтобы из полученного раствора выделить целлюлозу, его необходимо вылить в избыток разбавленной кислоты - соляной или серной. Я же взял 40 мл 60% азотной кислоты и развел ее в 100 мл воды. Для начала использовал половину этого раствора. Почему азотная кислота? Потому, что достать серную и соляную кислоту у нас очень проблематично - приходится их экономить.
Разбавленную азотную кислоту налил в стакан и стал понемногу прибавлять к ней раствор целлюлозы. Целлюлоза выделялась в осадок в виде темно-синих комков, которые при дальнейшем действии кислоты становились голубыми (аммиакат меди переходил в нитрат меди). При перемешивании комочки целлюлозы постепенно переходили в хлопья. В результате реакции азотной кислоты и аммиака выделялся белый дым нитрата аммония: для осаждения целлюлозы все-таки лучше брать серную кислоту. В один прекрасный момент кислота в стакане израсходовалась и раствор стал интенсивно-синим (аммиакат меди), пришлось добавить оставшуюся порцию азотной кислоты. Большую часть раствора целлюлозы вылил в кислоту, часть оставил. Хлопья целлюлозы по возможности быстро процедил через чайное ситечко [2] и хорошо промыл водой (разбавленные кислоты гидролизуют целлюлозу). Получилась масса, на ощупь похожая на раскисшую бумагу. Как оказалось, отмыть целлюлозу от солей меди не так и просто: необходима многократная тщательная промывка. Почти наверняка это обстоятельство существенно осложняло жизнь технологам при производстве медно-аммиачного шелка. Желающим подробнее узнать о технологии химических волокон рекомендую соответствующий раздел из книги "Химия для любознательных" [3]. __________________________________________________ 2 Я использовал стальное ситечко, но лучше взять пластмассовое, т.к. разбавленная кислота и соли меди могут вызвать коррозию стали (даже нержавеющей). 3 Гроссе Э., Вайсмантель X. - Химия для любознательных. Основы химии и занимательные опыты; раздел Химия одевает нас красивее и лучше [ссылка] |

Осаждение целлюлозы кислотой |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

Осажденная целлюлоза |

|
|
Что еще интересного можно сделать с целлюлозой? Например, ее можно нитровать, а полученную нитроцеллюлозу сжечь на ладони [4].
В заключение немного интересных фактов. Мы уже знаем, что животный аналог крахмала - гликоген. А существует ли в животном царстве аналог целлюлозы? Оказывается - да, хотя здесь родство не столь близкое, как между крахмалом и гликогеном. Членистоногие имеют панцирь из хитина, который играет роль внешнего скелета. Хитин представляет собой полисахарид, который подобно целлюлозе или крахмалу состоит из звеньев глюкозы, однако, в хитине в каждом звене глюкозы одна гидроксильная группа -OH замещена ацилированной аминогруппой -NH-С(=O)-CH3. __________________________________________________ 4 Получение и горение нитроцеллюлозы (огонь на ладонях) см. в подборке Полимеры, Мономеры, Природные полимеры, Пластмассы [ссылка] |
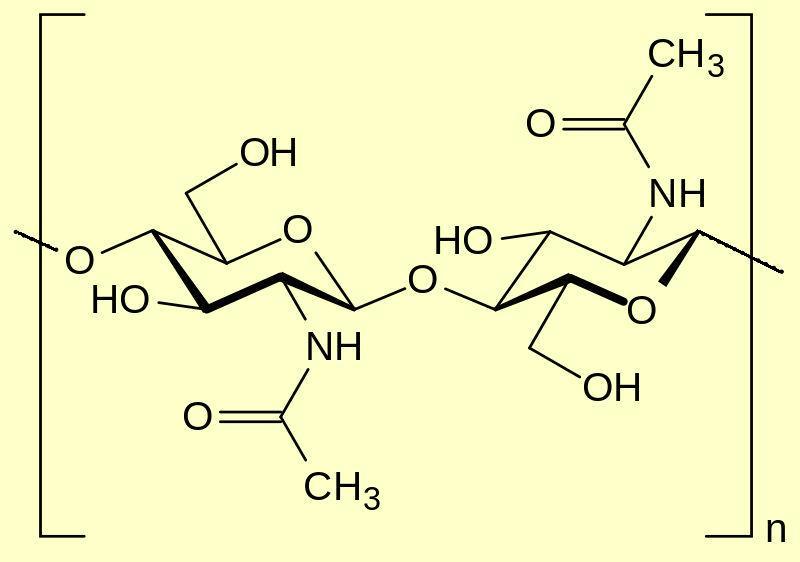
Хитин |

Рак-богомол (креветка-богомол) - одно из многих животных, которые используют хитин Это безобидное на вид животное - грозный хищник, способный разбить даже стекло аквариума (удар клешнями соответствует пуле 22-го калибра).
|
|
Комментарии
К1
В воде глюкоза находится в виде равновесной смеси 5 изомеров: 1 линейная, альфа- и бета- фуранозы и альфа- и бета- пиранозы, поэтому гидролизная глюкоза из древесины спокойно усваивается организмом
К2 Источником метанола в гидролизном спирте является лигнин - второй основной компонент древесины. При кислотном гидролизе целлюлозы оксиметильные группы лигнина также гидролизуются с образованием метанола. Так как древесина может содержать до 30% лигнина (хвойные породы), то и количество "лигнинового" метанола может быть значительным. В странах бывшего СССР гидролиз древесной целлюлозы выполняют в основном нагреванием древесины с раствором серной кислоты с последующей нейтрализацией раствора мелом и отделением гипса. Неудивительно, что образовавшийся из лигнина метанол при этом остается в растворе и в конечном итоге загрязняет этиловый спирт. В развитых странах используют технологию гидролиза древесной целлюлозы концентрированной соляной кислотой (точнее, хлороводородом в присутствии сравнительно небольшого количества воды в автоклавах при повышенной температуре и давлении). По окончании гидролиза значительная часть HCl регенерируется, и при этом отделяются и другие летучие продукты, в том числе метанол. Получаемый из такого гидролизата этиловый спирт практически не содержит метанола. Однако капитальные затраты на оборудование оказываются выше, чем в сернокислотном способе. К3 Молярная масса меди - 63.546 г/моль (в тексте было "65.33 г/моль" - исправлено). |