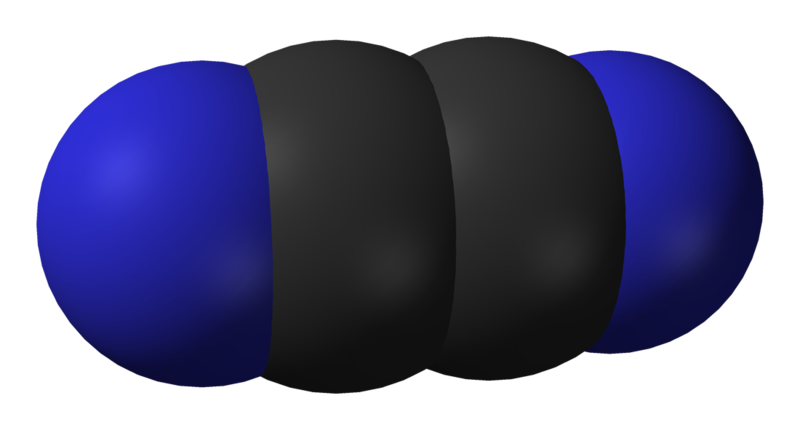
Образование и горение дициана
В.Н. Витер

| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 3 2010 Журнал Химиков-Энтузиастов |
|
Образование и горение дициана В.Н. Витер |

|
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Дициан (циан), C2N2 - бесцветный газ с резким запахом. В результате длительного нагревания (в отсутствие воздуха) он образует полимер парациан (CN)x, (х ≈ 2000-3000) - темноокрашенный аморфный порошок, который при 800°C разлагается на азот, углерод и циан. По химическим свойствам дициан частично напоминает галогены, например, C2N2 взаимодействует с водными растворами щелочей аналогично хлору:
(CN)2 + 2KOH = KCN + KCNO + H2O При сгорании в кислороде C2N2 дает очень горячее пламя (температура более 4500°C). В смеси с озоном при низких давлениях температура сгорания может достигать 5000-5300°C. Дициан C2N2 - очень ядовитый газ, поэтому работать с ним можно только в специально оборудованной лаборатории. C2N2 получают при термическом разложении некоторых неорганических цианидов (в частности, ртути и серебра), дегидратации диамида щавелевой кислоты (CONH2)2, а также при действии солей меди (II) на цианиды щелочных металлов: 2CuSO4 + 4KCN => C2N2 + 2CuCN + 2K2SO4
В небольших количествах C2N2 образуется при пиролизе азотсодержащих органических соединений, в результате чего он присутствует в коксовом и доменном газах. С помощью метода спектроскопии дициан обнаружен в кометах и в атмосфере Титана (спутник Сатурна). Учитывая высокую токсичность дициана, с ним не стоит проводить эксперименты в домашних и даже лабораторных условиях. Исключением может служить разве что опыт по образованию и горению дициана при разложении красной кровяной соли K3[Fe(CN)6]. При нагревании данного вещества происходит несколько параллельных реакций, в результате чего образуется ряд продуктов: Насыпьте в пробирку красной кровяной соли, чтобы высота ее слоя была несколько сантиметров. Закройте отверстие пробкой с газоотводной трубкой, которая сужается в конце, закрепите пробирку в лапке штатива и поставьте все это под хорошую вытяжку. Нагрейте K3[Fe(CN)6] в пламени горелки, когда соль начнет темнеть, подожгите газ на выходе из газоотводной трубки. Дициан загорится желтовато-сиреневым пламенем. При разложении красной кровяной соли образуется мало дициана, поэтому пламя через несколько минут погаснет. Содержимое пробирки станет черным. Твердые продукты разложения красной кровяной соли содержат цианид и потому представляют опасность, их недопустимо хранить или выбрасывать в мусор. Подождите, пока пробирка остынет, и высыпьте ее содержимое в большое количество раствора перманганата калия, хлорной извести, перекиси водорода или другого окислителя [K2]. __________________________________________________ 1 Обратите внимание: это не уравнение конкретной реакции, а общая условная схема процесса. Уравнения реакций могут быть, например, такими (в зависимости от температуры): 6K3[Fe(CN)6] => 18KCN + 2Fe3C + N2 + 8C2N2 (350°C) 6K3[Fe(CN)6] => 18KCN + 2Fe3C + 10C + 6N2 + 3C2N2 |
Образование и горение дициана |
Пламя дициана |
|
Комментарии
К1
В школьные годы я нагревал красную кровяную соль в пробирке, не подозревая, что выделяется в газовую фазу (и что остается в твердой). Хорошо, что газ, который выделялся, я поджег.
Незнание может обойтись слишком дорого. Красную кровяную соль тогда использовали для обработки негативов, насколько я помню - при передержке (слишком большой выдержке при съемке), поэтому она продавалась во многих фотомагазинах. До недавнего времени для опытов с люминолом я использовал кровяную соль из пакетика, купленного много лет назад в фотомагазине. Кстати, и красная кровяная соль, которая использовалась для получения дициана, также была куплена в фотомагазине в школьные годы. Автор К2 Остатки цианида в пробирке можно обезвредить также железным купоросом. radical |