Химия и Химики № 2 2009
Журнал Химиков-Энтузиастов
|
Оглавление №2 2009 Оглавление №7 2009 |
Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2009 Журнал Химиков-Энтузиастов |
Серпентарий на лабораторном столе. (Фараонова змея) Pharaoh's Serpents (Pharaoh's Snakes) В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Фараонова змея (разложение роданида ртути Hg(CNS)2)
Вариант 1. Pharaoh's Serpent (Pharaoh's Snake): Mercury (II) Thiocyanate Decomposition Растворите в небольшом объеме воды 6.5 г. нитрата ртути Нg(NO3)2, добавьте к нему небольшими порциями раствор, который содержит 3 г. NH4NCS или 4 г. KNCS. Выпадает белый осадок роданида ртути: Нg(NO3)2 + 2NH4NCS = Нg(NCS)2 + 2NH4NO3
Осадок Нg(NCS)2 фильтруют и слегка сушат. Из еще влажной соли формируют брикетик размером примерно 1 см. После этого тиоцианат ртути окончательно сушат в теплом месте или эксикаторе. Полученный брикетик Нg(NCS)2 положите на огнестойкую поверхность и подожгите. Тиоцианат ртути(II) после поджигания быстро разлагается с образованием черного сульфида ртути(II) НgS, желтого объемистого нитрида углерода состава С3N4 и дисульфида углерода СS2 (сероуглерод), который на воздухе воспламеняется и сгорает, образуя диоксид углерода СО2 и диоксид серы SO2: 2Нg(NCS)2 = 2HgS + C3N4 + CS2
Нитрид углерода вспучивается образующимися газами, при движении он захватывает черный сульфид ртути(II), и получается желто-черная пористая масса. CS2 + 3O2 = CO2 + 2SO2 В результате из кусочка роданида ртути полезет большая змея с черно-желтой окраской. Такая окраска делает нашу "змею" очень похожей на ужа или гадюку. Голубое пламя, из которого выползает "змея" - это пламя горящего сероуглерода СS2. В случае удачного опыта, рекомендованного количества реактивов достаточно чтобы получить "змею" длиной в 20-30 см. По возможности количество роданида ртути желательно увеличить. |

Фараонова змея (разложение роданида ртути Hg(CNS)2) Pharaoh's Serpent (Pharaoh's Snake): Mercury (II) Thiocyanate Decomposition |

|

|

|

|

|

|

|
|
Вариант 2.
Растворите в небольшом объеме воды 6.5 гр. Нg(NO3)2, добавьте к нему небольшими порциями раствор, который содержит 4 г. KNCS или 3 г. NH4NCS. Полученный осадок роданида ртути фильтруют и слегка сушат. Но в отличие от предыдущего варианта из него формируют палочки толщиной с карандаш. Нагревают на огне песчаную баню и на раскаленный песок кладут палочку роданида ртути. Из нее во все стороны быстро выползают, изгибаясь и извиваясь "змеи". По телу "змей" бежит бледно-синий огонь, они часто сплетаются в клубок. Вся картина очень напоминает скопление настоящих змей. Внимание! Соли ртути ядовиты и работа с ними требует осторожности. Поджигать роданид ртути можно только под вытяжкой или на улице. |

|

Горение смеси: бихромат калия, нитрат калия, сахар (K2Cr2O7 + KNO3 + С12Н22О11) Burning of the Mixture: Potassium Dichromate, Potassium Nitrate and Sugar |

|

|

|
|
Сладкая зеленая "змейка"
Другой способ изготовления смеси для дихроматной "змеи" включает смешивание порошков 1 г дихромата аммония (NH4)2Cr2O7, 2 г нитрата аммония NH4NO3 и 1 г сахарной пудры. Эту смесь смачивают водой, лепят из нее палочку и сушат на воздухе. Если палочку поджечь, из нее в разные стороны поползут черно-зеленые змеи. При этом происходят следующие реакции: (NH4)2Cr2O7 = Cr2O3 + N2↑ + 4H2O
При разложении дихромата аммония образуются азот N2, водяной пар и зеленый оксид хрома(III) Сr2O3. Реакция протекает с выделение теплоты. В реакции термического разложения нитрата аммония выделяется бесцветный газ - оксид диазота N2O (закись азота), который уже при слабом нагревании разлагается на кислород O2 и азот N2. А горение сахара дает еще один газ - диоксид углерода СО2, вдобавок происходит обугливание - выделение углерода. Много газов плюс твердые продукты окисления - вот причина "змеиного" поведения горящей смеси.
NH4NO3 = N2O↑ + 2H2O↑ C12H22O11 + 6O2 = 6CO2↑ + 11H2O + 6C |

Схожий опыт. Химический вулкан и фараоновы змеи - горение смеси: нитрат аммония, уротропин, бихромат аммония. Подробнее: [ссылка] |

|
|
Содовая гадюка
Это очень простой и изящный опыт. Чтобы его осуществить, в столовую тарелку насыпают 3 - 4 чайные ложки сухого просеянного речного песка и делают из него горку с углублением в вершине. Затем готовят реакционную смесь, состоящую из 1 чайной ложки сахарной пудры и 1/4 чайной ложки гидрокарбоната натрия (пищевой соды). Пропитывают песок 96-98%-ным этанолом и засыпают в углубление горки приготовленную реакционную смесь, а после этого поджигают спирт. Через 3 - 4 минуты на поверхности смеси появляются черные шарики, а у основания горки - черная жидкость. Когда почти весь спирт сгорит, смесь чернеет и из песка медленно выползает извивающаяся толстая черная "гадюка". У основания она окружена воротником догорающего спирта.Диоксид углерода СО2, выделяющийся при разложении гидрокарбоната натрия и горении этилового спирта в соответствии с реакцией: 2NaHCO3 = Na2CO3 + H2O↑ + CO2↑
вспучивает горящую массу, заставляя ее ползти, как змея. Чем дольше горит спирт, тем длиннее получается змея, состоящая из карбоната натрия, смешанного с мельчайшими частичками угля, который образуется при окислении сахара.
Селитряная "змея"
Такую змею можно наблюдать, если для опыта с поджиганием сахара и спирта использовать нитрат аммония. В этом случае реакционная смесь должна состоять из 1/2 чайной ложки нитрата аммония и 1/2 чайной ложки сахарного песка, тщательно перетертых в ступке. Эту смесь засыпают в углубление пропитанной этиловым спиртом песочной горки, а потом зажигают спирт. После того как он почти весь выгорит, с вершины горки начинает сползать "гадюка".Ее появление на свет вызвано реакцией нитрата аммония с сахаром: 2NH4NO3 + C12H22O11 = 11C + 2N2↑ + CO2↑ + 15H2O↑
Приводят в движение "гадюку" опять-таки образующиеся газы: азот N2, диоксид углерода CO2 и пары воды.
Черный "удав" из стакана
Этот опыт представляет собой захватывающее зрелище. Сахарную пудру в количестве 75 г помещают в высокий стеклянный стакан, смачивают ее 5-7 мл воды и перемешивают длинной стеклянной палочкой. Потом к влажному сахару приливают по этой палочке 30-40 мл концентрированной серной кислоты Н2SO4. (Осторожно!)
Затем быстро перемешивают содержимое стеклянной палочкой, которую оставляют в стакане, заполненном смесью. Через одну-две минуты содержимое стакана начинает чернеть, вспучиваться и в виде объемистой, рыхлой и ноздреватой массы подниматься, увлекая вверх стеклянную палочку. Смесь в стакане сильно разогревается и даже немного дымится. Она медленно выползает из стакана. Серная кислота окисляет сахарозу C12H22O11 и превращается в диоксид серы SO2. Одновременно получается диоксид углерода СО2. Эти газы вспучивают образующийся уголь и выталкивают его из стакана вместе с палочкой. Уравнение, передающее эти химические превращения, таково: C12H22O11 + 2H2SO4 = 11C + 2SO2↑ + CO2↑ + 13H2O↑
Диоксиды углерода и серы вместе с парами воды увеличивают объем реакционной массы и заставляют ее перемещаться.
Можно также добавить серную кислоту в стакан с сухим сахаром. Вещества перемешивают стеклянной палочкой, после чего стакан ставят в банку с горячей водой. Менее чем через минуту начнется бурная реакция. Из стакана "выстрелит" столбик черной массы.В другом варианте опыта горячую кислоту осторожно приливают в стакан с сахаром. Данный опыт уже был описан в прошлом номере журнала [ссылка]. |
|
Обугливание сахара концентрированной серной кислотой |
||
|
Уротропиновый "дракон"
Купите таблетки уротропина (в аптеке) или "твердого спирта" - сухого горючего (в хозяйственном магазине). Сухое горючее бывает разных типов, поэтому не мешает проверить, содержит ли оно уротропин. Для этого надо отломить несколько кусочков сухого горючего, поло жить их в пробирку и немного нагреть. Если в нем есть уротропин, то вы почувствуете запах аммиака.Одну таблетку "твердого спирта" или аптечного уротропина - гексаметилентетрамина (СН2)6N4 положите на блюдце и 3-4 раза пропитайте концентрированным водным раствором нитрата аммония NH4NO3, капая его из пипетки, а потом высушивая. Каждый раз надо наносить 5-10 капель (0.5 мл раствора). Самое утомительное - высушивание таблеток: при комнатной температуре на воздухе оно продолжается слишком долго. Можно поставить блюдце на кипящий чайник, избегая попадания водяного пара на таблетку. К сожалению, более высокой температуры уротропин не выдерживает и разлагается. Разумеется, нельзя сушить таблетки и на открытом огне: они могут загореться. Пропитанную и высушенную таблетку на блюдце следует поджечь с одной стороны. И тут начнутся чудеса: появятся черные шарики кипящей жидкости, которые сливаются вместе и образуют подобие вырастающего "хвоста". Он изгибается, а за ним вырастает толстое тело "дракона". Разложение уротропина в смеси с нитратом аммония приводит к образованию пористой массы, состоящей из углерода, и большого количества газов - диоксида углерода СО2, азота N2 и воды. И химически чистый уротропин, и нитрат аммония разлагаются, не образуя твердых продуктов. Однако в сухое горючее на стадии формования таблеток добавляют связующие вещества - парафин и тальк. Вот почему появляется "тело дракона". А выделяющиеся газы вспучивают и двигают его.
Маленькая черная змейка
В центр таблетки уротропина капните 2-3 капли концентрированной серной кислоты H2SO4, после чего подожгите таблетку. При горении сухого спирта в месте, где была нанесена кислота, образуется небольшая черная змейка длинной 1-3 см. Опыт не отличается особой красотой, зато очень прост в исполнении.
|

Для опыта необходимо: всего 2-3 капли концентрированной серной кислоты H2SO4 и таблетка уротропина...
|

|

|
|
Глюконатная змея
Для получения глюконатной змеи достаточно поднести к пламени таблетку глюконата кальция, который продается в каждой аптеке. Из таблетки выползет змея, объем которой намного превышает объем исходного вещества. Разложение глюконата кальция, имеющего состав Са[CH2OH(CHOH)4COO]2·H2O приводит к образованию оксида кальция, углерода, углекислого газа и воды.
Нитратный "червяк"
Для выполнения этого опыта делают из жести трубочку диаметром 15-20 мм и длиной 6-7 см. С одной стороны ее закрывают тампоном из стеклянной ваты или увлажненного асбеста. Потом почти всю трубочку закапывают закрытым концом вниз в слой песка, помещенного в широкую железную банку.В верхнюю часть закопанной трубочки насыпают смесь, состоящую из тонко растертых в ступке 5 г сахара С12Н22О11 и 14 г нитрата аммония NH4NO3, так, чтобы вверху трубочки остался свободный объем соответствующий примерно 1 см ее высоты. В эту часть объема трубочки помещают "запал" - 0.25-0.26 г измельченных кристаллов перманганата калия КМnО4. Из них делают небольшую горку с углублением по середине. В это углубление вводят пипеткой или шприцем несколько капель глицерина С3Н5(ОН)3, не содержащего примеси воды. Теперь будьте осторожны: через 15-20 секунд запал воспламенится и зажжет смесь, находящуюся в трубочке! Как только будет добавлен глицерин, отойдите от банки на три-четыре метра. Из трубочки повалит черный дым, а вместе с ним выползет чёрный дымящийся "червяк" причудливой формы. Объясним это химическое явление. Запал самовоспламеняется из-за окислительно-восстановительной реакции между КМnО4 (окислителем) и глицерином (восстановителем). Продуктами реакции являются окси марганца(IV) МnO2, диоксид углерода СО2, карбонат калия К2CO3 и вода.
Фараонова змея (p-нитроацетанилид + серная кислота)
Налейте в высокий фарфоровый тигель несколько миллилитров серной кислоты и добавьте туда несколько шпательков p-нитроацетанилида. Содержимое тигля перемешайте. При этом масса станет темно-розового цвета. Поставьте тигель на огонь бунзеновской горелки.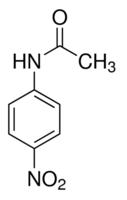
п-Нитроацетанилид, 4-Nitroacetanilide Через небольшое время из тигля выстрелит толстая черная змея (видео experiment.edu.ru). |

Фараонова змея (нитроацетанилид + серная кислота) |

|

|

|

|

|

|

|

|
|
|
|
Химия и Химики № 7 2009 Журнал Химиков-Энтузиастов |
"Холодное" пламя сероуглерода Is Carbon Disulfide Flame Cold? В.Н. Витер |
|
Сероуглерод обладает замечательным свойством - пламя CS2 настолько холодное, что в нем не обугливается даже бумага. В пламени сероуглерода можно держать руки, не боясь ожога. По крайней мере, так пишут в некоторых книгах и так думают немало химиков. Например, встретил довольно интересную олимпиадную задачу:
"Сероуглерод горит светло-синим пламенем, богатым фотохимически действующими лучами, и при этом обладающим такой низкой температурой, что в нем не обугливается даже бумага. Как это можно объяснить, ведь тепловой эффект велик? CS2 + 3O2 = CO2 + 2SO2 (H = -1080 кДж)" В книге Алексинский В.Н. Занимательные опыты по химии. М. Просвещение, 1980 [1] описан интересный опыт: "Невоспламеняющее пламя. В чашку под тягой наливают небольшое количество сероуглерода и поджигают. В пламя горящего сероуглерода помещают листок бумаги. Он не загорится!" __________________________________________________ 1 В.Н. Алексинский Занимательные опыты по химии: Пособие для учителей [ссылка] |

|

|
|
На первый взгляд, аналогичные примеры известны и для других веществ. Небольшие количества нитроцеллюлозы (нитрированная вата), эфира, ГМТД или перекиси ацетона сгорают на ладони, не причиняя ожога. Но тут дело вовсе не в "низкой" температуре пламени. Во-первых, эти вещества берутся в небольших количествах, во-вторых, они имеют высокую скорость горения - ладонь просто не успевает нагреться. Если же взять бОльшие количества перечисленных веществ или подержать над пламенем руку, то ожог неминуем [2], поскольку все они имеют высокую температуру горения.
Закономерно возникает вопрос: "Действительно ли пламя сероуглерода холодное?" __________________________________________________ 2 Перекись ацетона, ГМТД (гексаметилентрипероксиддиамин) и другие органические перекиси способны взрываться. В результате взрыва этих веществ можно остаться без кисти: увы, таких случаев много. |

|

|
|
Отвечу сразу - это утверждение не соответствует действительности. Сероуглерод относится не только к токсичным, но и к очень огнеопасным жидкостям. Он легко загорается, смесь паров сероуглерода с воздухом взрываются, а температура пламени сероуглерода CS2 достаточно высока. Сероуглерод много раз служил причиной пожаров и взрывов. Работа с CS2 связана с постоянным риском. Это относится и к лабораториям, и к химическим производствам.
В свое время автор работал на заводе вискозного волокна, в технологическом цикле которого использовали сероуглерод. Данное вещество доставляло массу неприятностей. Склад сероуглерода находился на значительном расстоянии от основных помещений, чтобы в случае пожара или взрыва ущерб был минимальным. В отличие от воды (а также серной кислоты или растворов щелочи) сероуглерод не перекачивали насосами, а передавливали из емкости в емкость с помощью азота. По возможности старались делать так, чтобы сероуглерод CS2 тек сам - сверху вниз. В цехах, где был сероуглерод, рабочим категорически запретили использовать инструменты из "черной" стали - такие инструменты могут дать искру, а результат - взрыв. Поэтому все инструменты (гаечные ключи, молотки и т.д.) были из нержавеющей стали или латуни. Хранить сероуглерод можно только под слоем воды или в атмосфере азота. |

Производство вискозных волокон. Раствор ксантогената целлюлозы (вискозу) выдавливают через узкие отверствия (фильеры) в разбавленную серную кислоту, которая течет по желобу. При этом образуются тонкие нити целлюлозы - вискозные волокна, а также сероуглерод и сероводород. Рабочие вынимают бабины ниток из серной кислоты вручную. Пол цеха мокрый от масла и серной кислоты. В отличие от случая, показанного на фотографии, рабочие на заводе "Черкасское химволокно" не пользовались защитными респираторами |
|
Даже далеким от химии людям известно, что сероуглерод применялся во Вторую мировую войну в качестве зажигательного вещества. Например, как противотанковое средство многие армии активно использовали "коктейль Молотова". Советский вариант представлял собой желто-зеленый или темно-бурый раствор фосфора и серы в сероуглероде, который имел низкую температуру кипения [2a]. Время горения бутылки, наполненной таким составом, было 2-3 мин, температура горения - 800-1000°С. Нескольких зажигательных бутылок иногда хватало, чтобы уничтожить легкий или средний танк. Отмечен случай, когда тяжелое самоходное орудие ягдпантера (jagdpanther) было уничтожено всего одной бутылкой зажигательной смеси, которую американский солдат кинул в открытый люк. При этом лобовую броню ягдпантеры часто не могли пробить танки союзников - даже при выстреле в упор.
__________________________________________________ 2a Рецептов "коктейля Молотова" очень много. Часто его делают из подручных средств и используют ввиду отсутствия более эффективного оружия (или когда последнее нельзя применять). Один из вариантов - бензин загущивают маслом или солидолом. Один раз бутылка с таким коктейлем упала в 1 м от автора (через 5 лет после написания данной статьи). Благо, при падении она погасла. |

"Коктейль Молотова" финского (слева) и советского (справа) производства. Советский "коктейль Молотова" представлял собой раствор фосфора и серы в сероуглероде |
|
Довольно эффективен был раствор фосфора в сероуглероде и в морской авиации. Бомба или торпеда, попавшая в корабль, оставляла команде шанс на спасение - пусть даже небольшой. Но если самолет выливал сверху на палубу корабля раствор фосфора в сероуглероде, шансов выжить у моряков не оставалось.
Конечно, фосфор или сера также вносят свой вклад в температуру пламени, но и одного сероуглерода вполне хватит, чтобы устроить сильный пожар - он дает достаточно жаркое пламя. Логично возникает вопрос: откуда же взялось утверждение, что сероуглерод горит холодным пламенем? Ведь трудно себе представить, что разные авторы этот факт просто "выдумали". Долже быть какой-то первоисточник. И он действительно нашелся. В книге Смуров В.С., Аранович Б.С. - Производство сероуглерода. Л. Химия, 1965. С. 20 написано: "Пламя сероуглерода имеет настолько низкую температуру, что в нем не обугливается бумага". Тут же приводилась ссылка на книгу академика Н. Семенова [3] - родоначальника учения о цепных реакциях. Саму книгу найти не удалось, но смысл ее вполне понятен из статьи автора в журнале Наука и Жизнь [4]: "Воспламенение паров фосфора, фосфина, сероуглерода при концентрации порядка сотых долей процента в воздухе не вызывает практически никакого повышения температуры". Теперь все стало на свои места. Возможность "холодного горения" при очень сильном разбавлении паров сероуглерода не вызывает сомнений. Но для того, чтобы наблюдать такое горение, необходимы сложные лабораторные установки. Если же просто поджечь жидкий сероуглерод, то будет наблюдаться совсем другая картина. В результате горения выделится вполне достаточно тепла, чтобы сжечь и бумагу, и руки неосторожного экспериментатора, и все помещение. Не исключено, что есть и другие источники, где сказано, что пламя сероуглерода имеет низкую температуру. Сути дела это не меняет: сначала одни авторы исказили факты, а затем другие бездумно переписали ошибочное утверждение. Дошло даже до описания "занимательного" эксперимента, - который сами авторы никогда не проводили. Так случайная ошибка размножилась по разным изданиям. __________________________________________________ 3 Семенов Н.Н. Цепные реакции. Госхимиздат, 1934. 4 Н. Семенов Теория цепных реакций: http://www.nkj.ru/archive/articles/5204/ |
Сероуглерод |
|
Как известно, химия - наука экспериментальная. Никакие утверждения не должны приниматься на веру. Один факт здесь ценится намного выше, чем целые тома умозаключений. Другими словами, нужно налить немного сероуглерода в тигель, поджечь его и внести бумагу в пламя. Бумага, конечно же, загорится.
На практике все оказалось сложнее. Когда автор взял бутылочку с надписью "Сероуглерод под дистиллированной водой", то выяснилось, что внутри осталась только вода - сероуглерод давно испарился от долгого хранения. И это неудивительно, ведь у CS2 температура кипения 46.2°С. По летучести (и пожарной опасности) он сопоставим с диэтиловым эфиром. Если сероуглерода нет, значит нужно его синтезировать. Для этого необходимо пропустить пары серы через слой раскаленного древесного угля [5]. В принципе ничего сложного тут нет, но не хотелось собирать установку и запускать ее в работу только ради того, чтобы получить несколько миллилитров сероуглерода. Один из коллег подсказал оригинальный выход: в опыте "Фараонова змея" [6] используется разложение роданида ртути. При этом образуется сульфид ртути, нитрид углерода и сероуглерод: 2Нg(NCS)2 = 2HgS + C3N4 + CS2
последний сразу же сгорает синим пламенем:CS2 + 3O2 = CO2 + 2SO2
Другими словами, нужно синтезировать роданид ртути провести его разложение и поджечь сероуглерод, который выделяется. Для начала автор решил провести реакцию разложения в закрытой пробирке с газоотводной трубкой. Оказалось, что разложение происходит слишком быстро и сопровождается активным образованием аэрозоля продуктов реакции. Как только пробирка с порошком Нg(NCS)2 была внесена в пламя, реакция закончилась за несколько секунд: о том, чтобы успеть поджечь газ на выходе, не было и речи. А главное - образование аэрозоля, который содержит соединения ртути, было небезопасно. Пришлось осуществить другой вариант: с помощью крахмального клейстера приготовить из порошка роданида ртути квадратики и просто их поджечь. В этом случае разложение происходит достаточно медленно. Фактически, это и есть эксперимент "Фараонова змея". Остается только внести в пламя сероуглерода бумажку. __________________________________________________ 5Получение сероуглерода описано в журнале Химия и Химики, № 2 (2009): Сероуглерод из серы и древесного угля [ссылка] 6 Описание разложения роданида ртути ("Фараонова змея") см. Химия и Химики, № 2 (2009): Серпентарий на лабораторном столе. (Фараонова змея) / Pharaoh's Serpents (Pharaoh's Snakes) [ссылка] |
Фараонова змея (разложение роданида ртути Hg(CNS)2) Pharaoh's Serpent (Pharaoh's Snake): Mercury (II) Thiocyanate Decomposition Разложение роданида ртути, горение сероуглерода и восспламенение бумаги в пламени сероуглерода
|

|
|
Как видите, бумажка сразу же загорелась в пламени сероуглерода. Вывод напрашивается сам собой: никаким источникам нельзя безоговорочно верить без независимого подтверждения. Иногда оказывается, что "независимые" утверждения в разных книгах и статьях восходят к одному и тому же первоисточнику, который не всегда бывает достоверным.
|

Цистерна с сероуглеродом |

Модель молекулы сероуглерода |