 |
Форум Химиков - Энтузиастов. Химия и Химики Эксперименты по Химии - Практическая Химия - Книги по Химии - Физика – Астрономия – Биология – Научный Юмор |
| Прежде чем отправить свое сообщение - ознакомьтесь с ПРАВИЛАМИ ФОРУМА. Прежде чем создать новую тему - воспользуйтесь ПОИСКОМ, возможно, аналогичная тема уже есть |
|
|
|
| It is currently 27 Apr 2024 08:50 |
View unanswered posts | View active topics
|
Board index » Химия » Неорганическая Химия All times are UTC [ DST ] |
 
|
Page 12 of 14 |
[ 263 posts ] | Go to page Previous 1 ... 9, 10, 11, 12, 13, 14 Next |
|
| Author | Message | |||||
|---|---|---|---|---|---|---|
| Volodymyr |
|
|||||
Joined: 04 Nov 2009 22:05 Posts: 62283 Location: Моя Батьківщина там, де моя лабораторія |
|
|||||
| Top | |
|||||
| Volodymyr |
|
|||||
Joined: 04 Nov 2009 22:05 Posts: 62283 Location: Моя Батьківщина там, де моя лабораторія |
|
|||||
| Top | |
|||||
| alexandrio |
|
|||||
Joined: 05 Nov 2015 13:31 Posts: 306 Location: самарская обл. |
|
|||||
| Top | |
|||||
| Volodymyr5 |
|
||||||
Joined: 16 Mar 2018 11:06 Posts: 3560 Location: My homeland is where my laboratory is |
|
||||||
| Top | |
||||||
| alexandrio |
|
|||||
Joined: 05 Nov 2015 13:31 Posts: 306 Location: самарская обл. |
|
|||||
| Top | |
|||||
| moonshine43 |
|
|||||
Joined: 24 Mar 2010 12:56 Posts: 1276 Location: צפת |
|
|||||
| Top | |
|||||
| alexandrio |
|
|||||
Joined: 05 Nov 2015 13:31 Posts: 306 Location: самарская обл. |
|
|||||
| Top | |
|||||
| Volodymyr |
|
|||||
Joined: 04 Nov 2009 22:05 Posts: 62283 Location: Моя Батьківщина там, де моя лабораторія |
|
|||||
| Top | |
|||||
| moonshine43 |
|
|||||
Joined: 24 Mar 2010 12:56 Posts: 1276 Location: צפת |
|
|||||
| Top | |
|||||
| alexandrio |
|
|||||
Joined: 05 Nov 2015 13:31 Posts: 306 Location: самарская обл. |
|
|||||
| Top | |
|||||
| antabu |
|
||||||
Joined: 24 Nov 2009 12:17 Posts: 10543 Location: Новосибирск |
|
||||||
| Top | |
||||||
| alexandrio |
|
|||||
Joined: 05 Nov 2015 13:31 Posts: 306 Location: самарская обл. |
|
|||||
| Top | |
|||||
| alexandrio |
|
|||||
Joined: 05 Nov 2015 13:31 Posts: 306 Location: самарская обл. |
|
|||||
| Top | |
|||||
| antabu |
|
||||||
Joined: 24 Nov 2009 12:17 Posts: 10543 Location: Новосибирск |
|
||||||
| Top | |
||||||
| alexandrio |
|
|||||
Joined: 05 Nov 2015 13:31 Posts: 306 Location: самарская обл. |
|
|||||
| Top | |
|||||
| Volodymyr |
|
|||||
Joined: 04 Nov 2009 22:05 Posts: 62283 Location: Моя Батьківщина там, де моя лабораторія |
|
|||||
| Top | |
|||||
| alexandrio |
|
|||||
Joined: 05 Nov 2015 13:31 Posts: 306 Location: самарская обл. |
|
|||||
| Top | |
|||||
| antabu |
|
||||||
Joined: 24 Nov 2009 12:17 Posts: 10543 Location: Новосибирск |
|
||||||
| Top | |
||||||
| Volodymyr |
|
|||||
Joined: 04 Nov 2009 22:05 Posts: 62283 Location: Моя Батьківщина там, де моя лабораторія |
|
|||||
| Top | |
|||||
| alexandrio |
|
|||||
Joined: 05 Nov 2015 13:31 Posts: 306 Location: самарская обл. |
|
|||||
| Top | |
|||||
 
|
Page 12 of 14 |
[ 263 posts ] | Go to page Previous 1 ... 9, 10, 11, 12, 13, 14 Next |
|
Board index » Химия » Неорганическая Химия All times are UTC [ DST ] |
Who is online |
Users browsing this forum: No registered users and 264 guests |
| You cannot post new topics in this forum You cannot reply to topics in this forum You cannot edit your posts in this forum You cannot delete your posts in this forum You cannot post attachments in this forum |
Powered by phpBB © 2000, 2002, 2005, 2007 phpBB Group




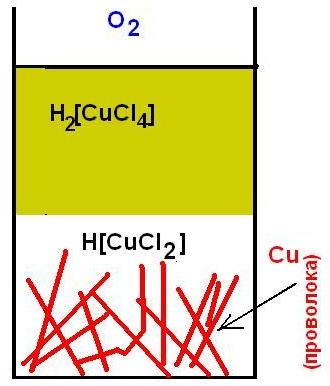
 ) ,залил уксусом и затянул плёнкой. Раз- два в день помешивал. Через неделю тёмно-синий раствор. Надо было снять, конечно.. если придётся повторить - сниму.
) ,залил уксусом и затянул плёнкой. Раз- два в день помешивал. Через неделю тёмно-синий раствор. Надо было снять, конечно.. если придётся повторить - сниму.