Химия и Химики № 2 2023
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 2 2023 Журнал Химиков-Энтузиастов |
Experiments with aluminium beverage cans - pt.3, 4 Эксперименты с алюминиевыми пивными банками В.М. Вітер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Potassium aluminate K[Al(OH)4] and nitric acid - pt.3 / Алюминат калия K[Al(OH)4] и азотная кислота
Concentrated nitric acid reacted with potassium aluminate, K[Al(OH)4]. At first aluminium hydroxide was precipitated. At the end of the reaction it was compleatly dissolved in the asses of nitric acid. The prosses of adding of nitric acid to the reaction mixture was accompanied by several cycles of precipitation - dissolution of the precipitate of aluminium hydroxide. Когда излагают методы получения нерастворимых гидроксидов металлов то, прежде всего, описывают метод осаждения гидроксида металла действием щелочи на раствор его соли. Например, гидроксид цинка осаждают действием едкого натра на раствор сульфата цинка. Так поступают в учебниках и учебных практикумах. Разумеется, методов получения нерастворимых гидроксидов металлов много, и на практике может оказаться, что описанные в учебниках методы не всегда оптимальные и далеко не всегда их используют в промышленности или в лаборатории. Почему же тогда так пишут авторы учебников? Их интересует стройность и систематичность изложения курса химии, а не такая мелочь, как его правильность и применимость на практике. Преподаватели стремятся к построению четкой модели: так легче учить им, и так легче учиться студентам, а насколько эта модель соответствует действительности (т.е. - нашей грешной жизни) - этот вопрос выносится за скобки. Важные для науки и практики подробности, которые не вписываются в упрощенную модель, часто опускаются. Или даются мелким шрифтом, как какая-то экзотика, хотя на практике это может быть банальность, которая экзотикой не является. Пример: растворение меди в разбавленной серной кислоте в присутствии воздуха - именно так получают медный купорос в промышленности (а не действием на медь концентрированной серной кислоты, как можно было бы решить, прочитав учебник). Вернемся к цинку. Много нерастворимых гидроксидов амфотерны, т.е., они проявляют не только основные, но и слабые кислотные свойства, поэтому амфотерные гидроксиды растворяются в избытке щелочей. Упомянутый гидроксид цинка растворяется в избытке гидроксида натрия с образованием цинката натрия (гидроксоцинката натрия): ZnSO4 + 2NaOH = Zn(OH)2 + Na2SO4 Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Разумеется, если к раствору гидроксоцинката натрия постепенно добавлять сильную кислоту, то она сначала нейтрализует избыток щелочи, а потом начнет разрушать цинкат натрия, в результате выпадет гидроксид цинка - вот вам и метод получения малорастворимого основания! При дальнейшем добавлении избытка кислоты осадок гидроксида цинка растворится. Na2[Zn(OH)4] + 2HCl = Zn(OH)2 + 2NaCl + 2H2O Zn(OH)2 + 2HCl = ZnCl2 + 2NaCl + 2H2O Т.е., если у нас изначально есть не раствор соли, содержащей катион металла (например, сульфата цинка), а раствор гидроксокомплекса этого металла (например, гидроксоцинкат натрия), то мы можем осадить гидроксид этого металла (в нашем случае - цинка) действием кислоты. К чему все эти рассуждения? В результате действия гидроксида калия на алюминиевую пивную банку в растворе образовался алюминат калия (гидроксоалюминат калия, K[Al(OH)4]). Также в растворе содержались избыток едкого кали, примесь карбоната калия и взвешенные твердые частицы - нерастворимые в щелочи примеси из алюминия банки. После фильтрования от механических примесей получился светло-коричневый раствор, а теперь из него можно получить гидроксид алюминия Al(OH)3 - действием азотной кислоты. Т.е. сейчас мы проведем с алюминием эксперимент, аналогичный описанному выше для цинка. Налил раствор гидроксиалюмината калия в стакан, взял концентрированную азотную кислоту (продажная) и стал добавлять по капле. Не перемешивал. Первая же капля, опускаясь на дно, превратилась в гелеобразный осадок! Почти бесцветный гелеобразный осадок... Такого я не ожидал: описанную выше процедуру с гидроксидом цинка я проводил на практике [1], и там нужно было добавить немало кислоты, чтобы начал выпадать гидроксид цинка (причем добавлять кислоту нужно осторожно, - чтобы гидроксид цинка моментально не растворился в ее избытке), а с алюминием первая же капля кислоты - и осадок гидроксида алюминия Al(OH)3! Следующие капли азотной кислоты также вызвали образование гелеобразного осадка, который преимущественно собирался на дне. При большом объеме осадок выглядел белым (при малом - бесцветным). Добавляю кислоту дальше - осадка на дне все больше: такого я НЕ ожидал. Наконец, перемешал реакционную смесь стеклянной палочкой. В результате осадок разбился на белые хлопья и... растворился полностью! Постепенно, не сразу, но при перемешивании ВЕСЬ гидроксид алюминия растворился, - он опять перешел в гидроксоалюминат калия, K[Al(OH)4]. Логично: в растворе все еще остался большой избыток едкого кали, и там, где он был ЛОКАЛЬНО нейтрализован, - выпал гидроксид алюминия, который потом растворился при перемешивании, поскольку благодаря перемешиванию избыток щелочи распределился по всему объему. Но все равно: объем осадка Al(OH)3 был значительный (по сравнению с объемом раствора) - психологически я не ожидал, что он ВЕСЬ растворится. Снова по капле добавляю кислоту - каждая капля вызывала образование прозрачного гелеобразного осадка - как и раньше. Но постепенно стала появляться разница: теперь осадок тонул не сразу, а с задержкой. Причина - образование осадка стало сопровождаться выделением пузырьков газа. Сначала выделение газа было слабым и осадок все равно тонул. Когда на дне накопилось достаточно осадка - снова перемешал. Осадок растворился. Опять по капле добавляю кислоту. Потом - бОльшими порциями. Опять гелеобразный осадок, только теперь выделение газа становится более заметным, часть осадка с шипением всплывает (за счет приставших к твердым частицам пузырьков). Перемешивание - осадок растворился. Потом - еще несколько таких цикла осаждения - растворения, но каждый из циклов уже не был точным повторением предыдущего. Дело в том, что при дальнейшем добавлении кислоты выделения газа стало более интенсивным. Осадок преимущественно всплывал и выглядел более белым - за счет пузырьков газа (без пузырьков осадок был почти бесцветным, полупрозрачным). Осадок снова растворился при перемешивании, но мне было понятно, что растворение осадка вскоре прекратится. Почему? Дело в том, что в растворе присутствует примесь карбоната калия. Во-первых, исходный гидроксид калия был неизвестного качества (он достался мне от предшественника) - примесь карбоната калия реактив мог содержать изначально. Даже, если бы исходный гидроксид калия был "абсолютно чистым", он поглотил бы углекислый газ из воздуха и воды - во время взвешивания, растворения и на протяжении самого эксперимента. В результате образуется карбонат калия. Когда гидроксид калия в избытке, с кислотой реагирует в первую очередь именно гидроксид калия, но, когда он подходит к концу, - с кислотой начинает реагировать и карбонат калия. В результате выделяется углекислый газ. Поэтому я перестал "осторожничать" и начал добавлять кислоту более существенными порциями, перемешивал, потом снова добавлял кислоту - так достиг точки, когда растворение осадка при перемешивании стало неполным, затем - прекратилось. Взвешенный белый осадок занял почти весь объем раствора, интенсивно выделялся углекислый газ. Система достигла точки, когда щелочь нейтрализована и весь алюминат калия перешел в гидроксид алюминия: KOH + HNO3 = KNO3 + H2O K[Al(OH)4] + HNO3 = Al(OH)3 + KNO3 + H2O Дальнейшее прибавление азотной кислоты будет вызвать уже не образование осадка гидроксида алюминия, а его растворение (с образованием нитрата алюминия): Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O И действительно: добавил еще азотной кислоты, перемешал - основная масса осадка быстро растворилась. Некоторое время оставалась мутная суспензия, потом опалесценция исчезла. Попробовал универсальной индикаторной бумагой - красная, т.е., раствор - сильнокислый. Эксперимент окончен. __________________________________________________ 1 См., например, статью Determination of zinc (Ukrainian 5 hryvnias coin). Определение цинка (украинская монета 5 гривен) [ссылка]. |
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-1.jpg)
Potassium aluminate K[Al(OH)4] and nitric acid Алюминат калия K[Al(OH)4] и азотная кислота |
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-2.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-3.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-4.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-5.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-6.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-7.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-8.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-9.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-10.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-11.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-12.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-13.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-14.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-15.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-16.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-17.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-18.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-19.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-20.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-21.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-22.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-23.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-24.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-25.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-26.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-27.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-28.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-29.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-30.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-31.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-32.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-33.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-34.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-35.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-36.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-37.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-38.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-39.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-40.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-41.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-42.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-43.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-44.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-45.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-46.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-47.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-48.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-49.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-50.jpg)
|
![Potassium aluminate K[Al(OH)4] and nitric acid. Алюминат калия K[Al(OH)4] и азотная кислота](http://chemistry-chemists.com/N2_2023/P13/Potassium_aluminate_nitric_acid-51.jpg)
|
|
Crystallization of potassium nitrate from solution (after neutralization of potassium aluminate by nitric acid) - pt.4 / Кристаллизация нитрата калия из раствора (после нейтрализации алюмината калия азотной кислотой)
The aluminum can reacted with potassium hydroxide. A solution of potassium aluminate was formed, then the solution reacted with nitric acid to form a solution of potassium and aluminum nitrates.This part of the article shows the crystallization of potassium nitrate: this compound forms large, beautiful needle-shaped crystals. The solubility of potassium nitrate increases very rapidly with increasing of temperature. This is very good for purifying a compound by recrystallization. После частичного растворения алюминиевой пивной банки в едком кали и фильтрования полученного раствора алюмината калия я стал добавлять концентрированную азотную кислоту. В результате сначала выпал гидроксид алюминия, который затем растворился в новых порциях азотной кислоты. В результате образовался почти бесцветный раствор, содержащий нитрат калия и нитрат алюминия. Вместо того, чтобы вылить эту жидкость, я перелил раствор в две банки и герметично закрыл их крышками. Через несколько часов обнаружил, что в банках выпало большое количество белого кристаллического осадка, над которым был желтоватый раствор. Что это может быть? Нитрат алюминия? Нитрат алюминия, нитрат калия или их смесь. Посмотрел на растворимость нитрата алюминия и ее температурную зависимость: anhydrous: 60.0 g/100ml (0°C) 73.9 g/100ml (20 °C) 160 g/100ml (100 °C) nonahydrate: 67.3 g/100 ml и сразу понял, что выпал нитрат калия, поскольку нитрат алюминия хорошо растворим, кроме того, в растворе нитрата калия содержится значительно больше (т.к. вся использованная для растворения пивной банки щелочь перешла в нитрат калия: и та, что прореагировала с алюминием, и та, что не прореагировала). У нитрата калия растворимость при комнатной температуре значительно ниже, чем у нитрата алюминия, но нитрат калия обладает замечательным свойством: при нагревании его растворимость в воде резко растет - значительно быстрее, чем у многих других солей. Это я помнил еще со школы: как можно не знать характер температурной зависимости для растворимости такого замечательного вещества? [K1] Имея нитрат калия, можно сделать черный порох, наблюдать горение уголька в расплаве нитрата калия, плавление пробирки во время реакции нитрата калия с серой и много других интересных вещей... Именно те вещества, растворимость которых быстро растет при увеличении температуры, легче очищать перекристаллизацией. 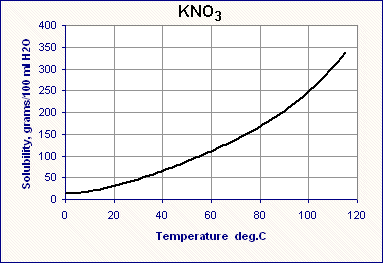 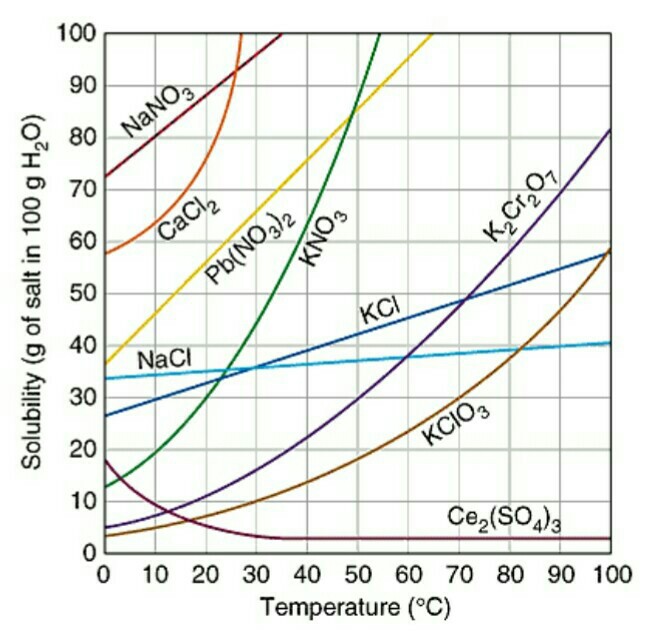
Solubility graphs for potassium nitrate and other salts Перелил раствор с осадком в стакан с целью заснять растворение нитрата калия при нагревании и последующую его кристаллизацию при охлаждении раствора. Задача очистить нитрат калия не стояла, - в нашем случае это нерационально (сначала вносить большую примесь алюминия, а потом ее "героически" отделять). Для получения нитрата калия достаточно было провести реакцию гидроксида или карбоната калия с азотной кислотой, или просто сходить в магазин и купить нитрат калия, который продается в качестве удобрения, - а потом уже при необходимости провести его перекристаллизацию. Т.е. наши эксперименты с пивной банкой для этой цели лишние. Визуально осадок нитрата калия занимал около 3/4 объема и только 1/4 - раствор над осадком. Поставил стакан на включенную электроплитку. Кто работал в лаборатории, из одного описания уже понял, насколько рискованной это была затея... Что тут такого? Дело в том, что при нагревании на плитке (или горелке) раствора с осадком на дне происходит неравномерное кипение жидкости, которое может иметь серьезные последствия. А для тех, кто не в курсе, - еще и неожиданные. Если просто поставит на плитку стакан с водой, вода возле дна нагревается, становится легче и поднимается вверх (с увеличением температуры плотность воды уменьшается), на ее место опускается более холодная вода, которая нагревается при контакте с дном, тоже поднимается, на ее место опускается холодная вода и т.д. Получается аналог конвейера. Явление называется конвекция, благодаря конвекции вода в стакане нагревается более-менее равномерно. При достижении точки кипения воды кипение происходит тоже более-менее равномерно [2]. 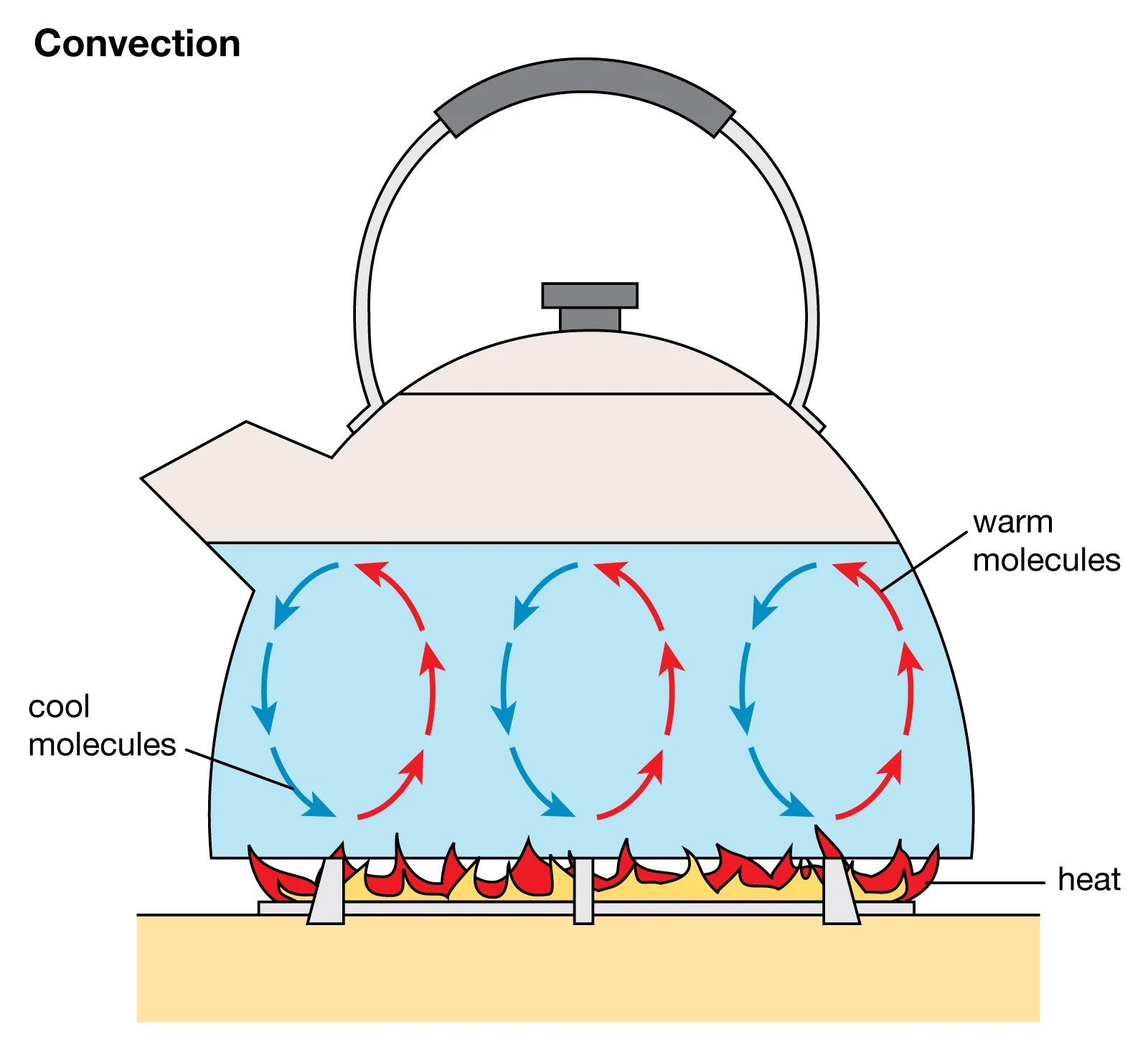
Convection / Конвекция (Encyclopaedia Britannica) Совсем другое дело, если на дне находится плотный слой осадка. Он мешает конвекции: не дает нижнему слою воды, нагретому от контакта со дном, подниматься вверх (а холодной воде сверху опускаться вниз), в результате вода возле дна перегревается и закипает, образуя большие пузыри пара, которые рано или поздно прорываются через осадок, поднимаются и... сталкиваются с холодной водой, от чего резко охлаждаются и схлопываются (моментально конденсируются). В результате происходит гидравлический удар - резкие толчки, которые сопровождаются звуком, действительно похожим на удар. Стакан "подпрыгивает", в результате он может слететь с плитки и разбиться. Или треснуть после очередного "приземления" на плиту [3], [4]. Запомнился случай, когда я растворил гидроксид циркония в муравьиной кислоте - с намерением получить раствор формиата циркония. Потом - упаривал раствор в 1.5 л стакане, чтобы его сконцентрировать. Наступил обед, я уменьшил нагрев и пошел в магазин - купить что-то перекусить. Прихожу... стакан "улетел": при приземлении он не успел выпустить шасси, а поэтому - разбился. Оказалась, что при нагревании раствора формиата циркония, равно, как и раствора ацетата циркония (промышленный продукт), образуется гель, который мешает конвекции так же, как и осадок на дне. Если осадок не растворяется в процессе нагрева - это особенно плохо. Наш осадок - обязан был раствориться. Т.е., была надежда, что осадок растворится ДО того, как снизу стакана начнется кипение, и проблем не будет. Плюс к тому, есть еще одно "смягчающее обстоятельство" - перемешивание стеклянной палочкой. В случае нерастворимых осадков это не всегда помогает, или помогает, но только временно, а в нашем случае - помогло. При перемешивании палочкой осадок разрыхлился и довольно быстро стал растворяться. Снизу раствор таки закипел, начались толчки, но небольшие и допустимые: помогло перемешивание (и тот факт, что осадок разрыхлится и стал проницаем для жидкости и пузырьков пара). Скоро весь нитрат калия растворился - наглядная демонстрация, что растворимость данного вещества резко увеличивается при нагревании. Снял стакан с плитки и стал ждать кристаллизации нитрата калия... Не дождался: раствор был уже слегка теплый (по ощущениям - 30-40°С: стакан не обжигал мочки ушей), а кристаллизации все не происходило. Тогда я взял кристаллик нитрата калия и добавил в стакан в качестве затравки, перемешал - ничего! Потом взял сразу много кристалликов для затравки, добавил, перемешал. Кристаллы... растворились (стала понятна судьба первой затравки, которая растворилась незаметно). Значит, теплый раствор - ненасыщенный, а при его охлаждении его до комнатной температуры должна выпасть большая масса осадка. Если учесть два факта: * растворимость нитрата калия резко увеличивается с увеличением температуры; * нитрат калия не дает кристаллогидратов и одно допущение: * нитрат калия не склонен к образованию пересыщенных растворов; то можно многое объяснить и спрогнозировать. Из первого факта следует, что с уменьшением температуры растворимость нитрата калия резко снижается: т.е. при охлаждении теплого раствора до комнатной температуры должен выпасть осадок, а повторный нагрев до 30-40°С вызовет его растворение (за какое время - другой вопрос). Однако, при постепенном охлаждении (нагреве) образование (растворение) твердой фазы будет постепенным, а не резким, как в случае переохлажденной воды или пересыщенного раствора ацетата натрия. Для резкого образования осадка при охлаждении нужно, чтобы вещество образовало пересыщенный раствор. А их того факта, что нитрат калия не дает кристаллогидратов, следует, что при его кристаллизации (в результате охлаждения) полного застывания раствора не будет - вода, которая содержится в растворе, никуда не денется. В случае пересыщенного раствора ацетата натрия или сульфата натрия полное застывание жидкости происходит, поскольку вода связывается в кристаллогидраты. Возможно оно и случае тиосульфата натрия (хотя с тиосульфатом у меня не получилось). А в нашем случае (нитрат калия) - "и не надейтесь". Разумеется, охлаждения раствора до комнатной температуры ждать не стал (поскольку, чем меньше разница температур между стаканом и окружающей средой, тем ниже скорость охлаждения) - нужно охладить раствор принудительно. Взял банку с холодной водой, опустил стакан. Вскоре на дне стакана появился осадок нитрата калия - сначала немного. Перемешал стеклянной палочкой. Потом снова охладил стакан в банке - объем осадка увеличился, но он был гораздо меньше, чем до нагревания раствора с осадком на плите (в самом начале эксперимента). Дальше сделал паузу - вернулся через несколько часов. Результатом стал сюрприз: теперь осадок теперь состоял из двух слоев. Вещество было одно и тоже - нитрат калия, но снизу были мелкие кристаллы, а сверху выкристаллизовались крупные иглы. В живую я такого никогда не наблюдал, но фотографии видел: при кристаллизации нитрата калия или нитрата аммония из раствора кристаллы в форме больших игл - не редкость (желательно, чтобы охлаждение раствора было медленным). Прелесть экспериментов, аналогичных нашему, в том, что процесс обратим: если мы хотим повторить опыт, систему легко вернуть в начальное состояние (без затраты реактивов и с минимальной затратой времени/сил). Взял стакан с кристаллами и раствором - нагрел до почти полного растворения (так, что на дне осталась только щепотка кристаллов), снял с плитки, накрыл чашкой Петри, оставил охлаждаться на воздухе. Через несколько часов в стакане опять выросли крупные иглы нитрата калия - более красивые, чем предыдущие. |

Crystallization of potassium nitrate from solution (after neutralization of potassium aluminate by nitric acid) Кристаллизация нитрата калия из раствора (после нейтрализации алюмината калия азотной кислотой) |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
На этом с успешными экспериментами - все. Сделал я, правда, еще несколько экспериментов - не совсем успешных, точнее, - не совсем достойных внимания, поэтому опишу их, но без картинок и видео.
В нашем случае образовался раствор нитрата калия, твердое вещество из которого выпадало только при охлаждении до температур, близких к комнатной. А это медленный процесс: например, в комнате с температурой 19°С раствор с температурой 30°С остынет до 20°С гораздо медленнее, чем раствор с температурой 105°С остынет до температуры 95°С (в этой же комнате). В обоих случаях температура раствора падает на 10°С, но в первом случае начальная разница температур раствора и комнаты составляет 11°С, а во втором - 94°С (не удивительно, что второй раствор отдает тепло гораздо быстрее). Значит, чтобы не ждать кристаллизации долго - пока раствор охладится почти до комнатной температуры, нужно приготовить раствор с более высокой концентрацией нитрата калия, чтобы такой раствор стал насыщенным еще в горячем виде. В идеале нужно сделать так, чтобы раствор при максимальном нагреве получился почти насыщенным, тогда при прекращении нагрева кристаллизация должна начаться почти сразу (твердая фаза образуется в результате минимального охлаждения). Для этого я даже новый раствор нитрата калия готовить не стал: взял стакан с осадком и раствором нитрата калия после прошлого опыта. С осадка слил примерно 130 мл жидкости - теперь суммарный объем осадка с раствором составил 75 мл. Поставил стакан на кипящую водяную баню, накрыл чашкой Петри. Соль с трудом растворилась (при перемешивании). Стоило снять стакан с плитки и убрать чашку Петри, - на поверхности жидкости быстро стала образовываться кристаллическая корка, что не удивительно, поскольку с поверхности раствора испаряется вода, что увеличивает концентрацию нитрата калия плюс к этому охлаждение раствора на поверхности самое интенсивное. При сотрясении кристаллическая корка опадала вниз в виде "снега". При перемешивании стеклянной палочкой количество кристаллов в растворе стремительно росло. Однако кристаллизация нитрата калия из горячего раствора выглядела это не особо эффектно. Картину портило и то, что жидкость стала мутной при нагревании, по-видимому, нитрат алюминия таки дал о себе знать (гидролиз при нагревании с частичным образованием твердой фазы). Частично помогло добавление азотной кислоты. Но, когда пришло в голову, что кристаллическая корка часто образуется на поверхности жидкости при простом упаривании самых разных растворов, - эксперименты прекратил. Мимо воли вспомнил о другом явлении, которое аналогично кристаллизации нитрата калия на поверхности горячего раствора. Хоть на первый взгляд схожести здесь нет. А именно - замерзание воды в океане возле Антарктиды. Как известно, морской лед пресный, как и речной. Когда замерзает морская вода, в твердую фазу переходит только вода, соль остается в растворе (т.е., в морской воде). В результате замерзания части воды концентрация соли в воде поверхностного слоя растет: такая вода становится тяжелее, чем менее соленная вода из нижних слоев, и она опускается на дно. На дне эта более холодная и соленная вода контактирует с менее соленной водой и... взывает ее замерзание (поскольку температура начала замерзания соленной воды тем выше, чем ниже ее соленость). В результате ледяные образования, похожие на сосульки, опускаются с поверхностных льдин и могут достигать дна океана, вызывая пагубные последствия для донных организмов. Океан замерзает возле дна, хотя над дном - вода, а лед легче воды. Немного необычно, правда? Так и в нашем случае нитрат калия стал кристаллизоваться на поверхности раздела раствор-воздух, а не возле дна или возле стенок стакана (хотя кристаллы нитрата калия тяжелее, чем раствор). __________________________________________________ 2 Если кто-то думает, что явление конвекции - "детские игрушки в стакане", имейте в виду, что именно конвекция отвечает за нагрев земной атмосферы от поверхности Земли. Хотя лучи Солнца попадают сначала в атмосферу, а потом уже - на поверхность Земли, атмосфера нагревается в основном от поверхности (которая эти лучи поглощает). Процесс аналогичен тому, который мы наблюдаем в стакане или чайнике, поставленном на горячую плитку. С океаном дело сложнее, поскольку он нагревается теплом Солнца не снизу, а сверху, что делает конвекцию невозможной. Но в Мировом океане существует явление, родственное конвекции, - "Большой океанический конвейер", благодаря которому тепло переносится от экватора к полюсам. 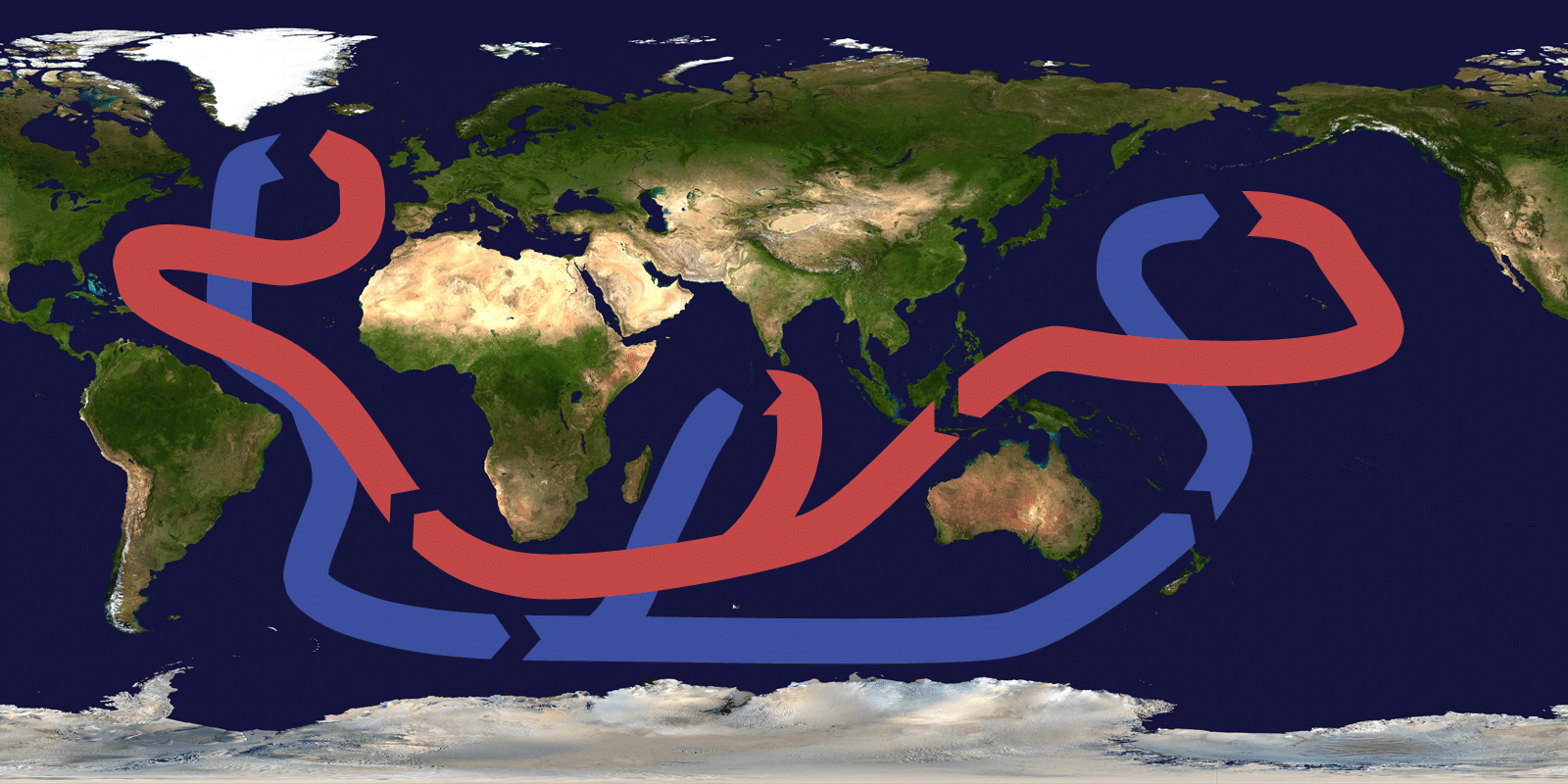
The ocean conveyor belt / Большой океанический конвейер Если интересуют подробности, задайте поиск и почитайте: что такое "Большой океанический конвейер" (The ocean conveyor belt, Thermohaline circulation), и что с нами случится, если (точнее - когда) он остановится. Явление океанического конвейера аналогично описанному явлению конвекции в стакане с водой, хотя оно и более сложное (здесь играет роль не только изменение температуры воды, но и ее солености: два эти фактора влияют на плотность морской воды). 3 Возможен и другой вариант этого неприятного явления: когда на дне стакана расположен не осадок, а более плотный раствор (или осадок с более плотным раствором), плотность которого даже в перегретом состоянии выше, чем более холодного раствора над ним. В этом случае тоже не будет конвекции между слоями, и возможен локальный перегрев снизу, - если эти слои принудительно не перемешать. 4 Кроме того, возможна ситуация, когда осадок нельзя перегревать - при нагревании под слоем раствора. У химиков такое встречается нечасто, зато у поваров - постоянно. Каша, гороховый суп и другие блюда часто подгорают снизу кастрюли именно из-за недостатка конвекции или перемешивания, которое ее заменяет (т.н. принудительная конвекция). Подгорание возле дна нередко происходит и во время варки некоторых микробиологических сред. |
|
Комментарии
К1
Ага, я тоже до сих пор помню этот график зависимости растворимости от температуры, с круто берущей вверх кривой для нитрата калия.Недавно тоже вспоминал, увидев в реакторе выпавшие за ночь длинные кристаллы после бромирования нафталина. С бромом сейчас напряженка, поэтому для бромирования использую пару бромид+хлорат, подкисляя ее азотной кислотой, как самой доступной сейчас. Бромиды использовались разные, в зависимости от того, что в данный момент доступнее, чаще это всякие неликвиды или технические реактивы. С бромидами кальция и натрия проблем никаких, их нитраты хорошо растворимы в воде, а вот бромид калия уже вызывает некоторые проблемы. Ладно, хлорат калия выпадает, но он на горячую кое-как растворим, а вот нитрат калия уже может закристаллизоваться, если его раствор на ночь оставить в реакторе. |