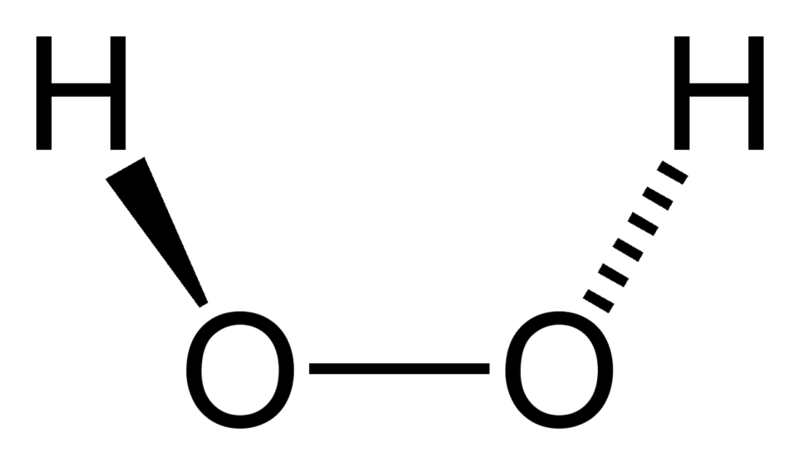
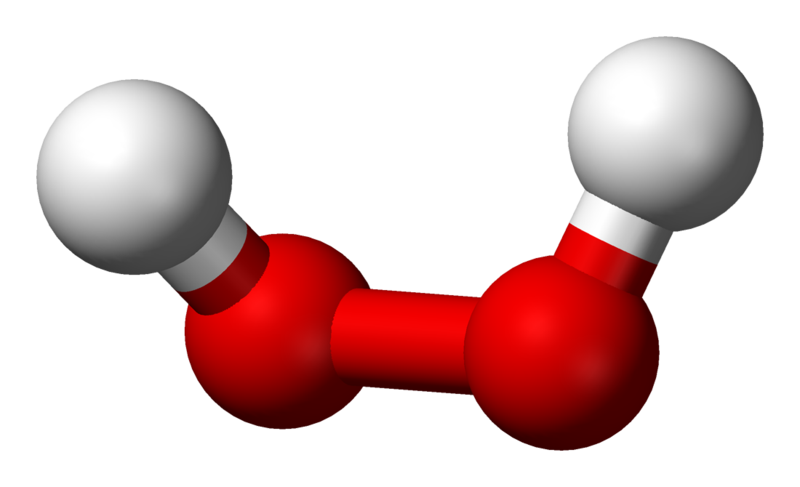
Строение молекулы перекиси водорода

Перекись водорода (3% раствор)

Цистерна с перекисью водорода
| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 3 2011 |
|
Перекись ацетона Ч. 1 В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Что такое перекись ацетона?
Перекиси (или пероксиды) - сложные вещества, содержащие в молекуле пероксидную группу -О-О-. Пероксидная группа может быть связана с водородом, атомами металлов или неметаллов, а также с органическими радикалами. Простейшим представителем пероксидов является перекись водорода H2O2 (или пероксид водорода).
|


Строение молекулы перекиси водорода 
Перекись водорода (3% раствор) 
Цистерна с перекисью водорода |
|
Перекись водорода - бесцветная жидкость, неограниченно растворимая в воде. В чистом виде она довольно неустойчива. Разложение перекиси водорода ускоряется под действием света, соединений переходных металлов, щелочей, крови (последняя содержит фермент каталазу). При разложении перекиси водорода в закрытой емкости возможен взрыв. Перекись водорода проявляет окислительные свойства. Некоторые горючие органические материалы (например, бумага, солома, метанол) при контакте с крепкой перекисью водорода могут воспламеняться. От действия 30% раствора перекиси водорода кожа и волосы человека становятся белыми. Разбавленные водные растворы перекиси водорода гораздо более стабильны. Трехпроцентная перекись водорода продается в аптеках как антисептик. Другие неорганические перекиси также проявляют окислительные свойства, многие из них довольно неустойчивы и легко отщепляют кислород. Однако, некоторые неорганические перекиси достаточно стабильны. Например, перекись натрия Na2O2 образуется при горении натрия на воздухе. Данное вещество плавится без разложения при 675°C. Более того: при нагревании оксида натрия Na2O на воздухе образуется пероксид Na2O2. Если в перекиси водорода Н-О-О-Н заместить один или оба атома водорода на органический радикал R, то мы получим органические гидроперекиси R-О-О-Н и перекиси R-О-О-R соответственно. |
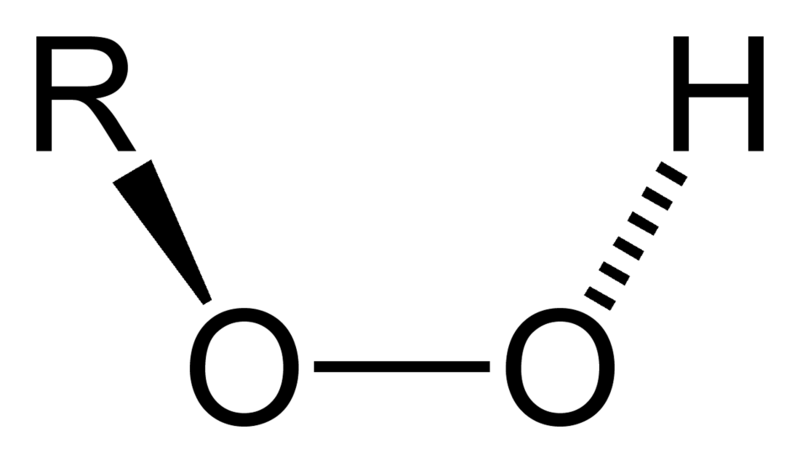
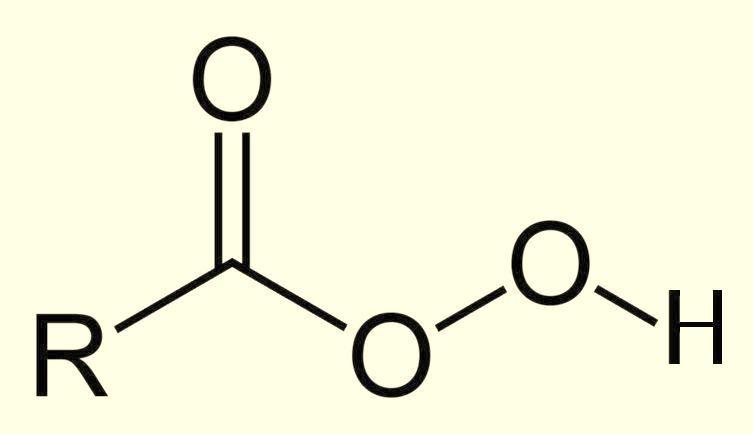
Органические гидроперекиси 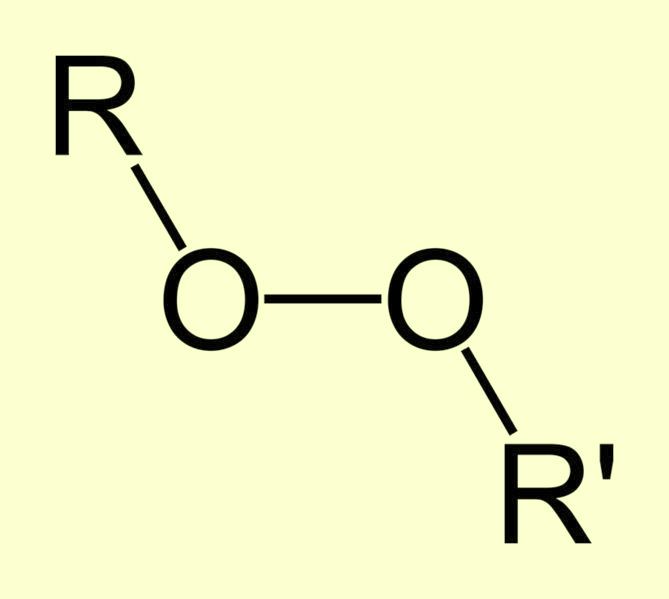
Органические перекиси |
|
Органические перекиси неустойчивы и легко разлагаются, иногда разложение происходит со взрывом. Например, перекись ацетона и перекись бензоила при нагревании взрываются. Молекулы органических перекисей способны распадаться, образуя свободные радикалы. Некоторые перекиси используют в промышленности как инициаторы радикальной полимеризации (перекись бензоила, перекись метилэтилкетона). |
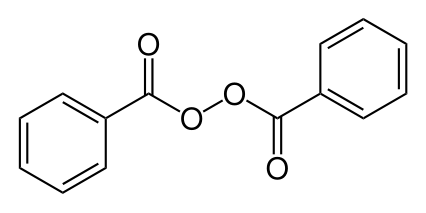
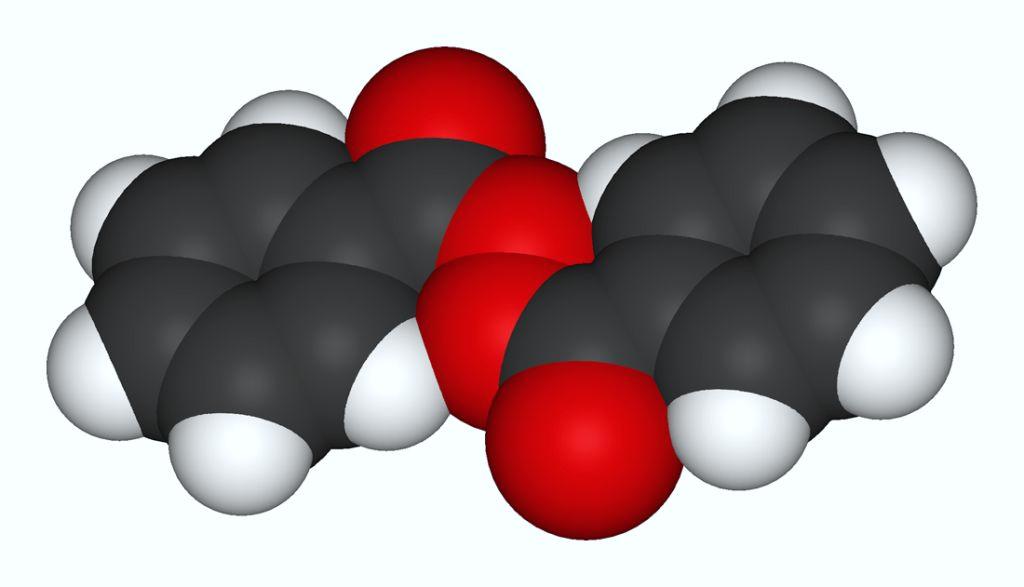
Перекись бензоила Перекись бензоила |
|
Органические пероксопроизводные очень разнообразны, в частности, существуют перекиси, которые являются производными карбоновых кислот RC(O)OOH (пероксокислоты или надкислоты), сложных эфиров RC(O)OOR, альдегидов. |
Пероксокислоты (надкислоты) 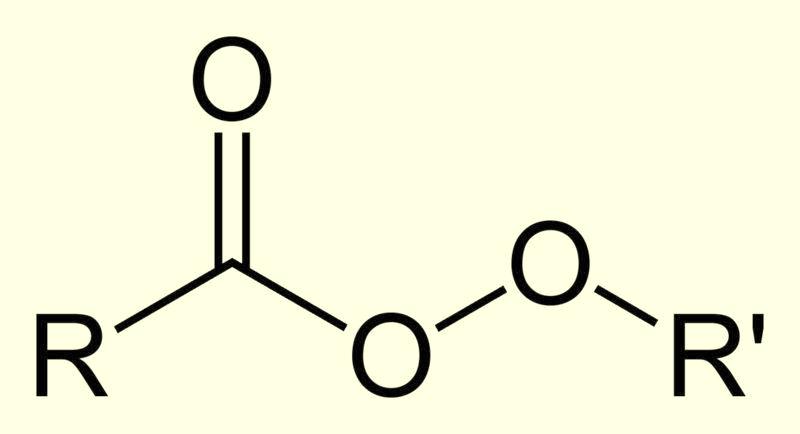
Пероксопроизводные сложных эфиров |
|
Кетоны также образуют пероксидные производные. В частности, простейший кетон - ацетон образует диперекись и триперекись. |
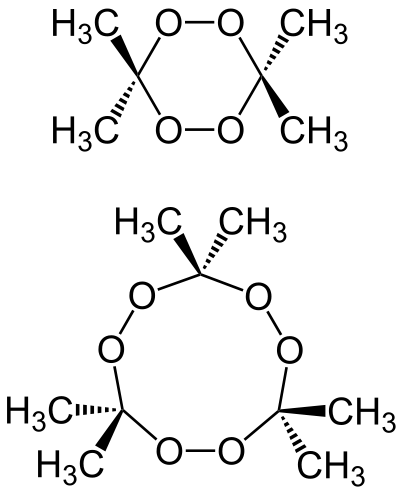
Диперекись и триперекись ацетона |
|
Как видно из формул, молекула диперекиси ацетона содержит две пероксидные группы -О-О- , а молекула триперекиси - сразу три (отсюда и название). В большинстве случаев при осаждении из водных растворов образуется триперекись ацетона, однако, нельзя исключить, что она не содержит примеси диперекиси. Диперекись ацетона получить гораздо сложнее, чем триперекись: для этого необходимо проводить синтез в строго определенных условиях (методика получения диперекиси изложена в приложении ко второй части статьи, однако она дается в основном для ознакомления). Есть также сообщение о получении тетраперекиси ацетона (ссылка), однако относиться к таким статьям следует с большой осторожностью: много подобных открытий было со временем опровергнуто. |
|
Схема образования тетраперекиси ацетона. Источник: Heng Jiang, Gang Chu, Hong Gong and Qingdong Qiao Tin Chloride Catalysed Oxidation of Acetone with Hydrogen Peroxide to Tetrameric Acetone Peroxide. J. Chem. Research (S), 1999, 288-289
|
|
Перекись ацетона представляет собой белое кристаллическое вещество. Практически нерастворима в воде, растворима в ацетоне, эфире. Температура плавления триперекиси 97 °C, диперекиси 132 °C. Даже при комнатной температуре перекись ацетона легко сублимируется. Перекись ацетона чувствительна к трению, удару, нагреванию. В результате этих воздействий может произойти взрыв или сильная вспышка. Перекись ацетона является мощным взрывчатым веществом: по бризантности она превосходит азид свинца, а по инициирующей способности - гремучую ртуть (но уступает азиду свинца). Однако данное вещество практически не применяется в военном деле. Причин несколько: перекись ацетона неустойчива, склонна к образованию крупных кристаллов, летуча и как результат - непредсказуема в поведении. Ни одной армии мира не нужны снаряды, которые будут взрываться на складе или гранаты, которые будут взрываться в руках у собственных солдат. С другой стороны, перекись ацетона окружена своеобразным ореолом таинственности, в результате находится немало молодых людей, которые хотят познакомиться с этим веществом поближе, не всегда осознавая опасности. В данной статье мы рассмотрим получение и разложение перекиси ацетона, а главное - подчеркнем, что и почему не следует делать при проведении подобных экспериментов. |