Химия и Химики № 4 2017
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 4 2017 Журнал Химиков-Энтузиастов |
Необычные гальванические элементы ч.1, 2, 3 Unusual galvanic cells В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Когда для демонстрационных целей нужно сделать гальванический элемент, обычно поступают просто: берут два электрода, сделанные из разных металлов, и опускают их в стакан (или другую емкость) с водным раствором электролита. Если соединить электроды проводником, между ними потечет электрический ток. Разницу потенциалов между электродами, а также - силу тока легко измерить с помощью дешевого мультиметра. В некоторых случаях от такого гальванического элемента может светиться светодиод или маленькая лампа накаливания.
Иногда делают более сложную, хотя и более наглядную модель гальванического элемента. Два стакана, в каждом - электрод из определенного металла (например, медь и цинк), электрод опущен в раствор соли этого же металла (например, сульфата меди и сульфата цинка). Стаканы соединены "солевым мостиком" - U-образной трубкой, заполненной гелем агара на насыщенном растворе хлорида калия. Такой гель хорошо проводит ионы, но не дает растворам смешиваться. Принцип работы данного элемента понятен из иллюстраций: 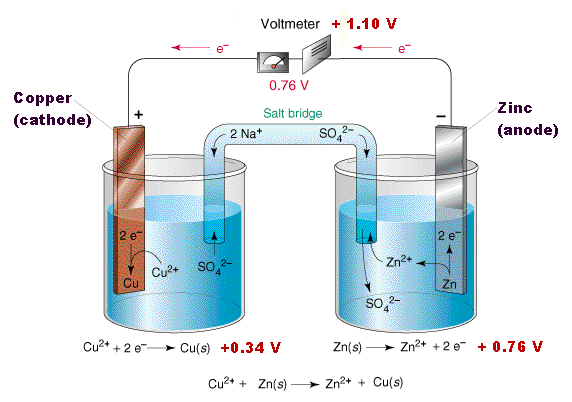
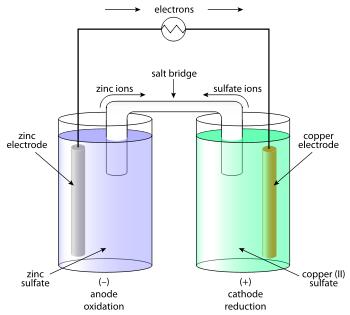
Разумеется, роль электролита совсем не обязательно должны играть водные растворы. Например, в литиевых батареях и литий-ионных аккумуляторах используют апротонные растворители, такие как: диметилкарбонат (ДМК), диэтилкарбонат (ДЭК) и этиленкарбонат (ЭК). В серно-натриевом аккумуляторе электролитом служит твердое вещество - алюминат натрия. Это один из тех случаев, когда используется не жидкий (или гелеобразный), а твердый электролит. В экзотических экспериментах электролитом для гальванических элементов могут быть расплавленные соли и даже расплавленное силикатное стекло [1]. Для многих случаев такой вариант непрактичен, но для демонстрационных целей он вполне подходит. Единственное, что плохо: стекло и хлорид натрия, которые были использованы мной в таких опытах, слишком тугоплавки. Вместо стакана (точнее - тигля) с расплавленным электролитом приходилось пользоваться более примитивным вариантом: два электрода, а между ними - кусочек стеклянной палочки (или кучка хлорида натрия) и пламя горелки, которое все это нагревает. В результате электроды контактируют не только и не столько с электролитом, сколько с воздухом: поверхность электродов активно окисляется кислородом (процесс происходит при сильном нагреве), а это приводит к тому, что потенциал элемента хаотически меняется (показания вольтметра скачут, словно заяц). Иногда знак разницы потенциалов меняется на обратный. Чтобы устранить это безобразие, решил попробовать в качестве электролита расплавленную буру. Она более легкоплавка и растворяет оксиды, которые образуются на поверхности металлов. Опыт проводился по той же принципиальной схеме, что и получение "перлов буры" [2]. Вместо петельки из платиновой проволоки взял две петельки: стальную (разогнутая скрепка с загнутым в петлю концом) и толстую медную проволоку (поскольку тонкая проволока из меди быстро разрушается в пламени). Петельки закрепил на расстоянии в несколько миллиметров друг от друга. Для этого воспользовался керамической "сломкой" (цилиндриком из фарфора, в котором проделаны отверстия для проволоки: такая соломка часто используется для термопар) и деревянной прищепкой. К сожалению, медная проволока не пролазила в отверстие "соломки" - пришлось пустить ее с внешней стороны, что создало много проблем с ее надежной фиксацией. Противоположные концы проволочек подсоединил к китайскому мультиметру, который был включен в режиме измерения милливольт. Замысел был простой: нагреваем две петельки в пламени и опускаем их в порошок буры, затем прокаливаем буру в пламени до образования перла. Перл должен одновременно касаться меди и железа. Все это время вольтметр (мультиметр) включен и фиксирует разницу потенциалов между электродами (медной и железной петелькой). Однако еще до того, как преступил к опытам с расплавом буры, я столкнулся с двумя интересными явлениями. Первое из них мы рассмотрим в данной части статьи, второе - во второй. Собственно опыты с бурой будут описаны в третьей части. Итак, мы имеем два электрода: железо и медь. Электроды подключены к мультиметру (режим измерения - милливольтметр). Все готово к опыту с бурой. Но стоило прикоснуться пальцем к двум электродам одновременно, и вольтметр показал разницу потенциалов. Сначала - несколько мВ (легкое прикосновение пальцев), затем - десятки и сотни мВ (когда я сжал электроды между пальцами). Причем по мере того, как я держал электроды, напряжение постепенно росло, пока не достигло порога около 260-270 мВ. А стоило разжать пальцы и отпустить электроды, как разница потенциалов тут же падала до нуля. С таким явлением уже приходилось сталкиваться при экспериментах с другими гальваническими элементами. Тем не менее, "пройти мимо" не смог. Кожа рук содержит воду с растворенными в ней солями - они и играют роль электролита в нашем гальваническом элементе. По мере увеличения времени контакта ионы металла (железа), по-видимому, переходят в этот раствор, увеличивая концентрацию электролита, а вместе с ней - напряжение гальванического элемента. Кстати, во время последующих экспериментов данное явление сильно мешало: держать электроды в руке, вносить их в пламя, а затем - погружать в буру было неудобно - учитывая, что одновременно велась видеосъемка. Нужно было постоянно заботиться о том, чтобы все попадало в кадр, чтобы рука экспериментатора не закрывала важные детали и т.д. Так вот, если во всей этой "экспериментальной суматохе" случайно коснуться пальцем двух электродов одновременно, вольтметр показывал разницу потенциалов - что искажало эксперимент. Приходилось переделывать видео. __________________________________________________ 1 См. статьи: Силикатное стекло в качестве электролита для гальванического элемента. Silicate glass is electrolyte for galvanic cell [ссылка] и Расплавленный хлорид натрия как электролит для гальванического элемента. Molten sodium chloride as electrolyte for galvanic cell [ссылка] 2 См. статьи из подборки: Качественные реакции. Количественный анализ. Qualitative and Quantitative Chemical Analysis [ссылка] |

Рука и два электрода (медь и железо) Hand and two electrodes (copper and iron) |

|

|

|

|

|

|

|

|

|

|
|
Пламя и два электрода (медь и железо). Flame and two electrodes (copper and iron)
Возникновение разницы потенциалов между медным и железным электродами, если к ним одновременно прикоснуться пальцем, было прогнозируемо, точнее - ожидаемо: подобное явление я уже видел и не раз. Но описанное ниже явление стало неожиданностью: о такой возможности я просто не задумывался.
Итак, я взял медную и железную проволоку с петельками на конце, и внес их в пламя: чтобы нагреть их до красного каления, а затем погрузить в буру, но до буры дело не дошло. Как только медь и железо попали в пламя, между ними возникла разница потенциалов: сначала она начала стремительно расти и достигла значения порядка 600 мВ (0.6 В), затем - падать, причем не равномерно, а скачками (в обе стороны). Потенциал перевалил через "0" и снова стал увеличиваться по модулю, но теперь уже со знаком "-" (т.е. ток стал течь в противоположном направлении). Стоило погасить горелку, и разница потенциалов быстро стала равной нулю. Снова зажег горелку, показания миливольтметра стали увеличиваться (на этот раз - со знаком "-") и достигли порядка -0.100 мВ. Погасил горелку - разница потенциалов через несколько секунд исчезла. Аналогично - и в третий раз. Причем во всех случаях наблюдался не монотонный рост или падение потенциала, а скачки в обе стороны. Попробовал измерить силу тока - не удалось: ток слишком низкий - меньше предела измерения мультиметра, что вполне ожидаемо (поскольку сопротивление зазора между электродами большое: пламя - это хоть и горячий, но газ). Как объяснить описанное явление, я не знаю. Версий несколько. 1. Эффект Зеебека (термоэлектрический эффект). Есть два разных проводника тока, которые контактируют между собой, образуя последовательно замкнутую электрическую цепь. Причем разные места контакта этих проводников находятся при разных температурах. В результате в цепи возникает электродвижущая сила (ЭДС) и течет ток. 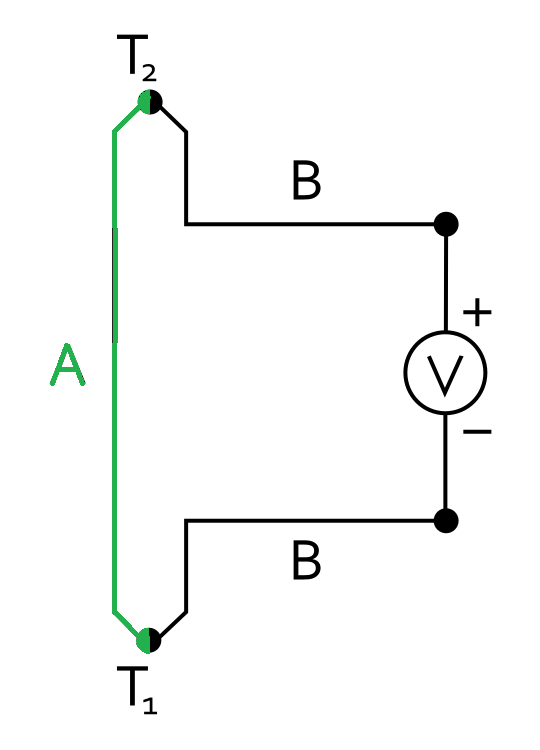
Эффект Зеебека (термоэлектрический эффект) Seebeck effect (thermoelectric effect) На описанном принципе основана работа термоэлектрического генератора - устройства, которое напрямую преобразует тепловую энергию в электричество. Также на этом принципе работает термопара - устройство, которое позволяет измерять температуру (точнее - разницу температур) по значению электрического потенциала на биметаллическом спае. 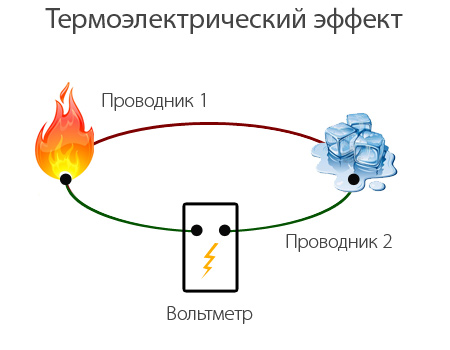 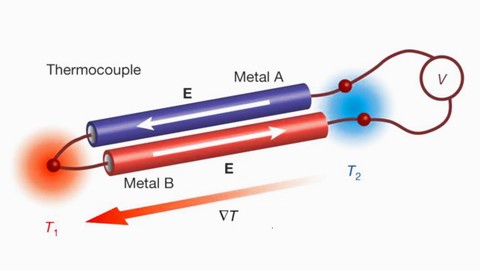
Принцип работы термопары Thermocouple Термоэлектрический эффект открыл в 1821 году Томас Зеебек на примере пары проводников медь - сурьма. 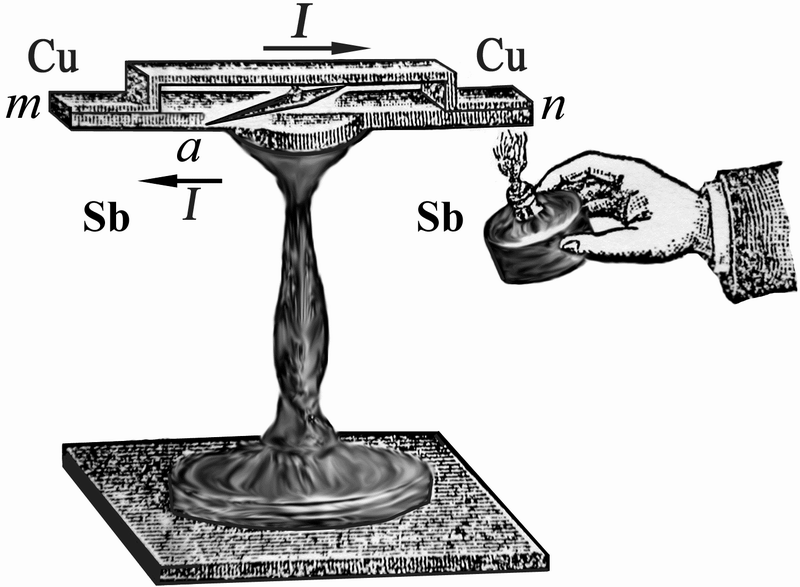
Эффект Зеебека (термоэлектрический эффект) Seebeck effect (thermoelectric effect) Итак, если места контакта двух разных проводников находятся при разной температуре, в цепи возникает электрический ток. Но можно сделать все наоборот: к цепи из двух разных проводников подключить внешний источник питания, в результате одно место их контакта будет охлаждаться, другое - нагреваться - в зависимости от направления тока и вида контактирующих проводников. Данное явление называется эффектом Пельтье: по сути, это тот же эффект Зеебека, только наоборот. На таком принципе работают элементы Пельтье (сокращенно - TEC от англ. Thermoelectric Cooler - термоэлектрический охладитель). 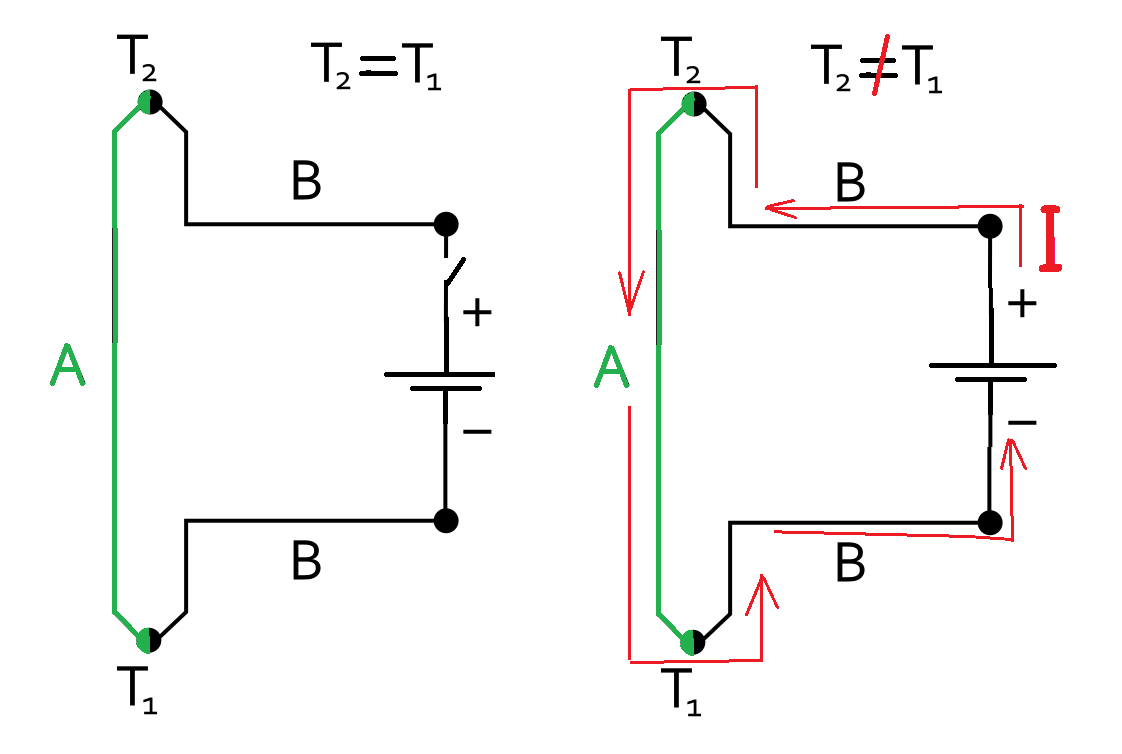
Эффект Пельтье (термоэлектрический охладитель) Peltier effect (thermoelectric cooler) Для того чтобы эффекты Зеебека и Пельтье проявлялись максимально, лучше использовать пару из двух полупроводников: p- и n-типа. 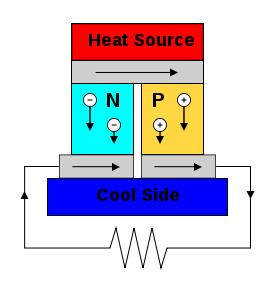
Термоэлектрический генератор, основанный на эффекте Зеебека. В комбинации с вольтметром (вместо нагрузки) может быть использован как термопара. A thermoelectric circuit composed of materials of different Seebeck coefficient (p-doped and n-doped semiconductors), configured as a thermoelectric generator. If the load resistor at the bottom is replaced with a voltmeter the circuit then functions as a temperature-sensing thermocouple 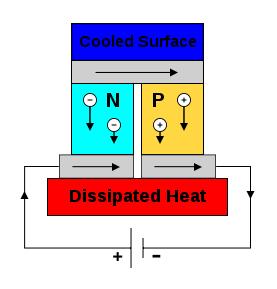
Термоэлектрический охладитель, основанный на эффекте Пельтье The Seebeck circuit configured as a thermoelectric cooler 
Термоэлектрический модуль Thermoelectric Seebeck module Отличие нашего устройства из железной и медной проволоки от термоэлектрического генератора (или термопары) в том, что два разных проводника не контактируют непосредственно. Электрическую цепь между ними замыкает пламя - в нем содержится плазма (ионизированный газ). - Примерно, как на рисунке ниже. 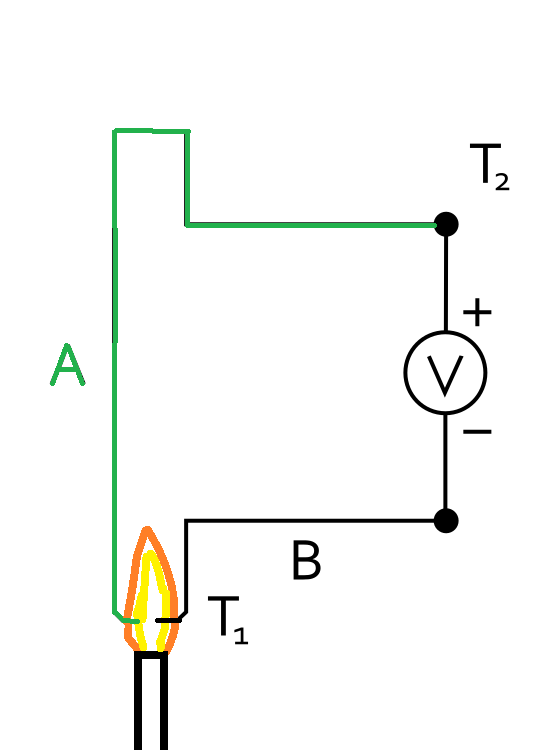
Думаю, что для проявления эффекта Зеебека можно и так, поэтому объяснение №1, пожалуй, самое правдоподобное. 2. Магнитогидродинамический генератор (МГД-генератор). Устройство для прямого преобразования кинетической энергии потока в электрическую энергию. Поток плазмы течет с большой скоростью между двумя электродами. Перпендикулярно направлению движения плазмы наложено магнитное поле. В результате электромагнитной индукции положительные заряды отклоняются к одному электроду, отрицательные - к другому. Возникает разница потенциалов. 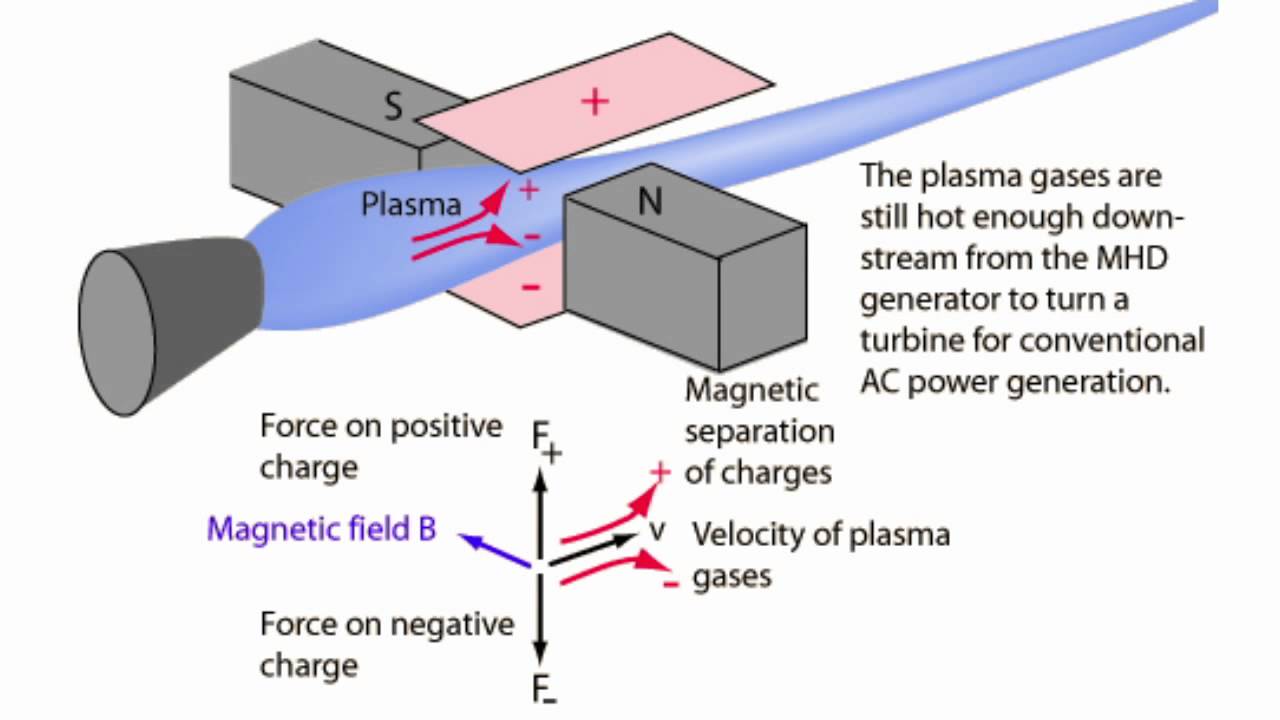
Магнитогидродинамический генератор (МГД-генератор) Magnetohydrodynamic generator Рабочим телом МГД-генератора могут служить любые жидкие и газообразные проводники, например, растворы электролитов или жидкие металлы, но в современных МГД-генераторах обычно используют плазму. Плазма хорошо проводит электрический ток при температуре порядка 10000 К и выше, при меньших температурах ниже степень ионизации газа, а, следовательно, его электропроводность слишком низкая. Чтобы снизить рабочую температуру генератора до 2200-2700 К в нагретый газ вводят соединения щелочных металлов. Мощность генератора пропорциональна квадрату напряженности магнитного поля, поэтому желательно использовать магниты, которые дают поле напряженностью в несколько Тл. В нашем эксперименте магнитов не было вообще. Остается магнитное поле Земли, но его средняя напряженность возле поверхности составляет около 5·10-5 Тл (0.5 Э). По-видимому, это слишком мало. Плюс поток плазмы (пламя) направлен не параллельно электродам, а перпендикулярно. Кроме того, направление силовых линий магнитного поля Земли вообще не учитывались. Таким образом, эффект МГД-генератора - маловероятный вариант объяснения наблюдаемых экспериментальных фактов. 3. Гальванический элемент. Что такое гальванический элемент мы уже рассмотрели в первой части статьи [ссылка]: два электрода из разных металлов (или других токопроводящих материалов), опущенные в электролит. В нашем случае два металлических электрода есть (медь и железо), но электролита нет: между электродами ионизированный газ - плазма. Может ли она играть роль электролита? Ионы железа и меди вряд ли будут перемещаться между электродами: при такой температуре летучесть данных металлов слишком низкая. Зато другие ионы, - которые уже есть в пламени, в принципе могут перемещаться между электродами и разряжаться на них (как и в обычном гальваническом элементе). Вспомните опыт, где ионы натрия проникали через стекло вакуумной лампочки из расплава натриевой селитры и разряжались внутри лампы - за счет эмиссии электронов спиралью (см. статью Натрий и электрическая лампочка [ссылка]). Изменение разницы потенциалов в ходе опыта (в частности - беспорядочные скачки потенциала) можно объяснить тем, что поверхность электродов не является инертной: и железо, и медь активно окисляется в пламени. Медь, кроме того, будучи окисленной, может восстановиться, если попадет в восстановительную зону пламени. Плавление металлической меди внутри оболочки из оксида также хорошо видно (подобным образом ведет себя алюминий). Такое объяснение изменения потенциала во времени одинаково хорошо подходит и к первому варианту (эффект Зеебека) и к третьему варианту (гальванический элемент). Как оно на самом деле - сказать затрудняюсь: наиболее правдоподобно первое объяснение (термоэлектрический эффект, но не в "классическом оформлении"). Тут нужно ставить новые эксперименты, причем без уверенности, что они помогут дать ответ на вопрос. А мы тем временем займемся гальваническим элементом с расплавленной бурой в качестве электролита. |

Пламя и два электрода (медь и железо) Flame and two electrodes (copper and iron) |

|

|

|

|

|

|

|

|

|

|

|

|

|

Сила тока, мА Electric current, mA |

|

|
|
Расплавленная бура в качестве электролита для гальванического элемента
Итак, модель гальванического элемента с расплавленной бурой в качестве электролита. Две петельки (медную и железную) снова нагрел в пламени при включенном милливольтметре - от контакта с пламенем между электродами возникла разница потенциалов. Опустил раскаленные петельки в порошок буры, затем снова внес их в пламя. Бура расплавилась, причем расплав касался одновременно к двум электродам, образуя электролитический контакт. Вольтметр показал разницу потенциалов примерно 300-400 мВ. Она изменялась во времени, но была гораздо более стабильна, чем в предыдущем опыте (пламя и два электрода): резких хаотических скачков уже не наблюдалось. Подержал электроды (с расплавом буры) в пламени горелки, затем - вынул из пламени. В результате напряжение сначала возросло более чем до 600 мВ, потом - медленно упало до 0 (для этого понадобилось несколько десятков секунд).
Molten borax as electrolyte for galvanic cell При повторном разогреве (после охлаждения): сначала потенциал был около 600 мВ, потом - спад до 400 мВ. Опять вынул гальванический элемент из пламени - напряжение подскочило, превысив 600 мВ (как и в предыдущем случае), дальше - постепенное падение до 0. Сила тока достигала 2-4 мА во время работы гальванического элемента, подскочила до 9 мА в момент вынесения из пламени, затем медленно упала до 0 во время охлаждения вне пламени (аналогично вело себя напряжение). После охлаждения было видно, что электроды покрыты застывшим расплавом буры, который изолировал их от прямого контакта с воздухом во время работы. - Этим, по-видимому, и объясняется отсутствие скачков напряжения (в отличие от аналогичных экспериментов с хлоридом натрия и расплавом стекла [1]). Расплав внутри железной петельки был почти черным (перлы буры с большим количеством железа). |

Расплавленная бура в качестве электролита для гальванического элемента Molten borax as electrolyte for galvanic cell |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

Сила тока, мА Electric current, mA |

|

|

|

|

|

|

|

|