|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Данная публикация посвящена бромированию органических соединений, а именно - аренов. Бромирование аренов может происходить в ядро или в боковую цепь. Ниже мы рассмотрим замещение водорода на бром в молекуле бензола (т.е. замещение в ароматическом ядре). В условиях домашней лаборатории реакцию бромирования (особенно в препаративных количествах) проводят крайне редко. Причин этому несколько, прежде всего, стоит учитывать свойства брома.
Во-первых, бром довольно опасен в обращении - он действует обжигающе на кожу, а его пары сильно раздражают слизистые оболочки. Во-вторых, бром весьма летуч, его температура кипения всего 58°С, данное обстоятельство увеличивает опасность действия его паров и сильно затрудняет хранение брома.
Менее летучи молекулярные комплексы брома (диоксандибромид), но они и менее активны - не бромируют бензол, к тому же нет ясности с возможностью их длительного хранения и регенерации из них без потерь свободного брома.
В-третьих, бром коррозионно активен: если вблизи места, где хранится бром в недостаточно герметичной укупорке, находятся железные детали, то они начинают быстро ржаветь. Во избежание этого бутыли с бромом следует помещать в контейнер вместе с материалом, способным сразу связывать улетучивающийся бром (медными или железными стружками). В-четвертых, скорость галогенирования ядра, имеющего заместитель, по сравнению с незамещенным ядром снижается незначительно (в отличие, например, от сульфирования или нитрования). В результате в ходе реакции образуется значительная доля ди- и полигалогензамещенных побочных продуктов. Иными словами, галогенирование не останавливается на определенной стадии, и ко всем неприятностям добавляется необходимость разделения продуктов бромирования.
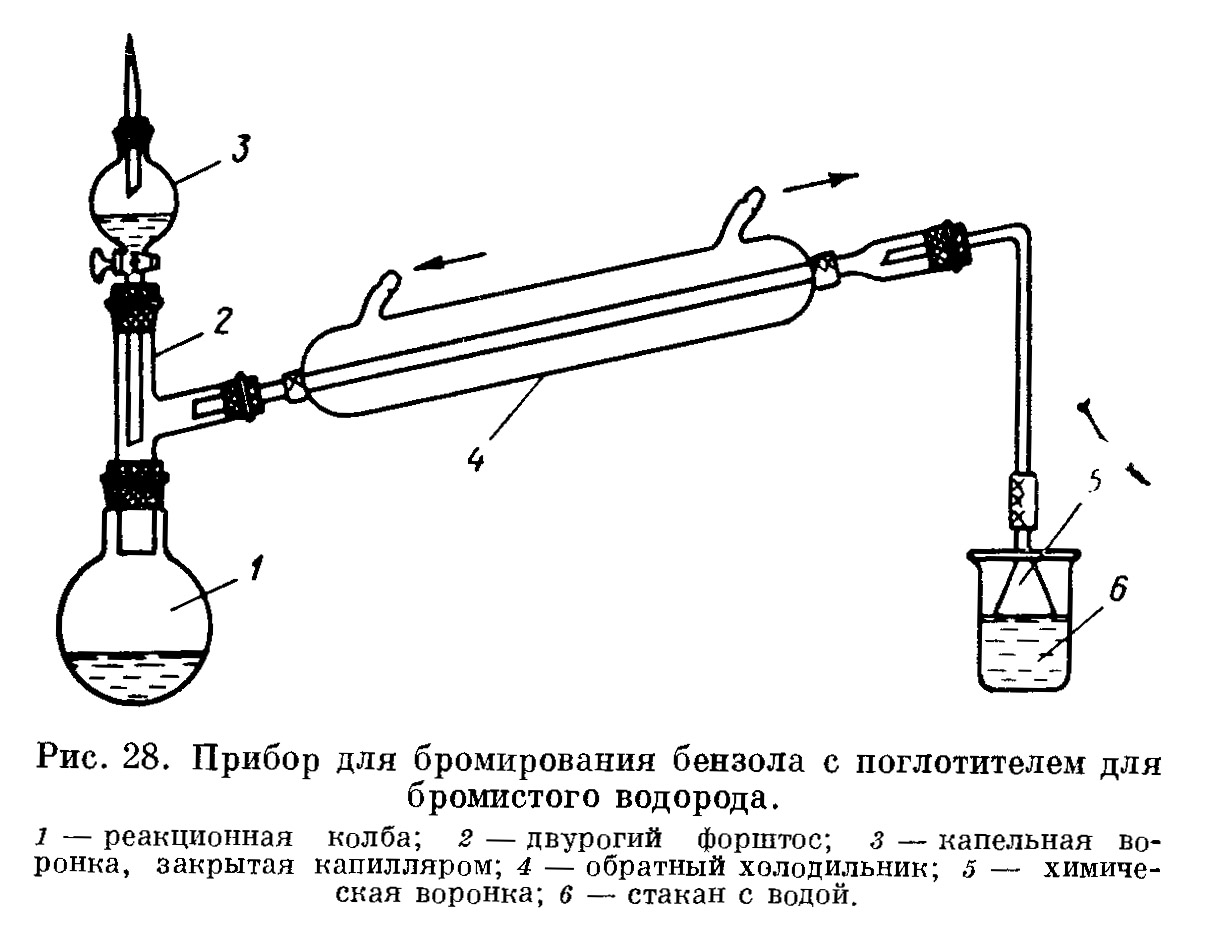
Наконец, в-пятых, есть одна неприятная особенность реакции бромирования - при бромировании один атом брома входит в ядро, а другой теряется с замещенным водородом, т.е. полезно используется лишь половина довольно дорогостоящего реактива. Другая половина, если не прибегать к ухищрениям, улетает в тягу. Ухищрения могут быть различными. При традиционном бромировании в присутствии катализатора (обычно это безводный бромид или хлорид трехвалентного железа) образующийся бромоводород улавливают в поглотительной склянке, устроенной так, чтобы со стороны поступающего бромоводорода не возникло разрежение.
|