
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 7 2014 Журнал Химиков-Энтузиастов |
Гальванический элемент ч.4 В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Батарейка из фруктов и овощей
Устройство гальванического элемента (и других химических источников тока) описано в первой части статьи [1]. Чтобы изготовить гальванический элемент, нужны: окислитель, восстановитель, электроды и электролит. Причем восстановителем может служить материал одного из электродов (цинк, железо или магний, например). Окислителем может быть один из ионов электролита (например, катионы меди или водорода) или растворенный в электролите кислород воздуха.
В простейшем случае гальванический элемент можно легко собрать из подручных средств. Роль электродов могут играть предметы из разных металлов: монеты, проволока, полоски оцинкованной жести и т.п. Электролитом может служить сок фруктов и овощей, который содержит растворенные кислоты и соли. А в качестве "сосуда" можно использовать сами фрукты и овощи. Процедура простая: в фрукт или овощ втыкают два электрода из разных металлов, например, медную проволоку и полоску оцинкованной жести. Если электроды соединить, между ними потечет электрический ток, который можно измерить тестером. Окисляется более активный металл (в данном случае - цинк), восстанавливаются ионы водорода (на поверхности меди). Процедура "конструирования" фруктовой батарейки описано в статье [2]. Ниже показаны результаты аналогичных экспериментов. Отмечу только одну неприятную деталь: в ходе экспериментов оказалось, что тестер, который первоначально использовался в опытах с фруктами и овощами, давал значение напряжения, завышенное примерно в полтора-два раза (по сравнению с показаниями другого тестера). После замены батарейки показания обоих тестеров стали совпадать. __________________________________________________ 1 Химические источники тока. Вступление ч.1 [ссылка]. 2 Фруктовая батарейка [ссылка]. |

|
|
Для начала приведем электрохимический ряд активности металлов (он же - ряд напряжений или ряд стандартных электродных потенциалов металлов).
Li > Rb > K > Ba > Sr > Ca > Na > Mg > Al > Mn > Zn > Cr > Fe > Cd > Co > Ni > Sn > Pb > H > Sb > Bi > Cu > Hg > Ag > Pd > Pt > Au Чем левее металл стоит в этом ряду - тем он активнее, а чем металл правее - тем он менее активен (в водных растворах). Возьмем гальванический элемент, в котором каждый из двух металлов погружен в раствор своей соли (с концентрацией 1 моль/л), вроде элемента с медными и цинковыми электродами, который мы рассматривали в первой части статьи. 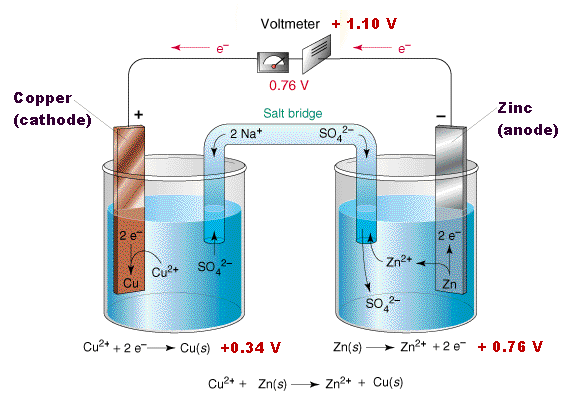 Гальванический элемент Zn | ZnSO4 || CuSO4 | Cu Более активный металл (цинк) в таком гальваническом элементе будет отрицательным электродом, менее активный (медь) - положительным. Поток электронов потечет от отрицательного электрода к положительному. Сопоставляя положение любых двух металлов в ряду активностей, можно предвидеть, какой из них будет отрицательным электродом, а какой положительным - если из этих двух металлов (и растворов их солей) сделать гальванический элемент. Более того, посмотрев в справочнике значение стандартных электродных потенциалов для металлов, можно вычислить ЭДС соответствующего элемента. Для гальванического элемента, приведенного на рисунке, расчет выглядит следующим образом: Е(Zn2+/Zn) = -0.76 В Е(Cu2+/Cu) = +0.34 В ЭДС = Е(Cu2+/Cu) - Е(Zn2+/Zn) = 0.34 -(-0.76) = 1.10 В. В нашем случае электроды из металлов погружены не в растворы собственных солей, а в фрукты и овощи. Сок фруктов и овощей содержит растворенные кислоты и соли, но практически не содержит катионы тех металлов, электроды из которых мы используем в опытах [3]. Например, если медный и цинковый электроды погрузить в фрукт, то на отрицательном электроде будет растворяться цинк (катионы цинка переходят в раствор), но на положительном электроде ионы меди не будут присоединять электроны и переходить из раствора в металлическую медь - т.к. ионов меди в растворе практически нет. Вместо ионов меди на медном электроде будут восстанавливаться ионы водорода, возможно - молекулы кислорода (растворенного в соке). Другими словами, фрукты и овощи выглядят более увлекательно, чем стаканчики с растворами солей, но в результате такой замены теряется наглядность. К приведенным ниже показаниям тестера не стоит относиться, как к чему-то абсолютному: в разных фруктах и овощах концентрация и качественный состав электролитов разный, значит, разными будут и потенциалы таких батареек - даже если взять одни и те же электроды. Имеет значение также и состояние поверхности металла. И, разумеется, в процессе работы напряжение фруктовых и овощных батареек меняется (причем не всегда в сторону падения). Приступим. Яблоко. Электроды - расплющенная медная трубка и железный гвоздь. Если электроды поменять местами, разница потенциалов останется практически той же, но изменит знак на противоположный (электрический ток потечет через тестер в обратном направлении). __________________________________________________ 3 Разумеется, в соке фруктов и овощей есть магний, железо, медь, цинк, но их концентрация мизерная (а кроме того, их катионы часто связаны в комплексы с органическими лигандами). |

Яблоко. Электроды - медь и железо |

|

Поменяем местами "крокодильчики" - ток потечет в противоположном направлении |

|

То же, но другой тестер |
|
В случае пары медь - алюминий (расплющенная проволока) напряжение было ниже, чем в случае пары медь - железо. Но ведь алюминий стоит в электрохимическом ряду напряжений гораздо левее железа (т.е. разница потенциалов должна быть не меньше, а больше!) Дело в том, что на воздухе алюминий покрыт защитной пленкой оксида, которая существенно понижает его реальный потенциал.
|

Медь - алюминий |

|

|

|

Другой тестер (то же) |

|

Поменяем полярность |
|
Медь - магний (сплав электрон - кусочек крылатой ракеты). Потенциал наивысший из достигнутых в данных опытах - 1.6 В. Если электроды поменять местами, ток течет в обратном направлении.
|

Медь - магний |

|

Поменяем полярность |

|

Другой тестер |

|

Поменяем полярность |
|
Медь и полоска оцинкованной жести. Потенциал почти 1 В. Это больше, чем в случае железа и меньше, чем в случае магния.
Обратите внимание: у батарейки с цинком потенциал больше, чем у батарейки с алюминием, хотя цинк - менее активный металл, чем алюминий (алюминий в ряду напряжений металлов расположен левее цинка). Причина уже указана: поверхность алюминия покрыта прочной оксидной пленкой, которая занижает его потенциал. |

Медь - цинк |

То же, другой тестер |

|

|

|

Поменяем полярность |

|

|
|
Помидор. Медь - оцинкованная жесть. Напряжение почти такое же (чуть меньше), как для этих же металлов и яблока.
|

Медь - цинк |

|

|

Поменяем полярность |

Другой тестер |

|

|

Поменяем полярность |
|
Луковица. Медь - оцинкованная жесть. Напряжение чуть ниже, чем с помидором и яблоком.
|

Медь - цинк |

|

|

Поменяем полярность |

Тот же опыт, но с другим тестером |

|

|

Поменяем полярность |
|
Яблоко. Железо - цинк.
Потенциал раза в два меньше, чем в случае пары электродов медь - цинк, причем роль положительного электрода вместо меди играет железо. На первый взгляд уменьшение потенциала логично, ведь железо стоит в ряду напряжений левее меди (разница стандартных электродных потенциалов меди и цинка больше, чем железа и цинка). Но мы забыли одно обстоятельство: на меди (или железе) восстанавливаются не ионы меди (или железа), а ионы водорода. Т.е. мы имеем дело не с медным или железным, а с "водородным" электродом. Другими словами, теоретически не имеет значения, на каком металле разряжаются ионы водорода. Zn | ZnSO4 || HX | H2 (где HX - органические кислоты, которые содержатся в соке). На практике, как видите, материал водородного электрода имеет значения. В частности, железо (да и медь) не являются в данном случае инертными электродами. - Иначе для стандартного водородного электрода никто бы не использовал платину. |

Железо - цинк |

|

|

|

Поменяем полярность |