
Самовоспламенение никеля Ренея experiment.edu.ru
Смотреть Видео
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 6 2010 Журнал Химиков-Энтузиастов |
|
Получение пирофорных металлов В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Самые активные металлы можно легко поджечь на воздухе. К их числу принадлежат: щелочные металлы, щелочноземельные металлы, скандий, иттрий, лантаноиды и их сплавы. Неплохо горит магниевая, титановая и циркониевая стружка, мелкий алюминиевый порошок (алюминиевая пудра, или "серебрянка"). В перечисленных случаях чтобы поджечь металлы достаточно спички или газовой горелки. Рубидий и цезий легко самовоспламеняются на воздухе [1-1].
Считается, что такие металлы как железо, никель, свинец, хром или марганец не горят на воздухе. Действительно, попытки поджечь на воздухе железную проволоку или стружку вряд ли окончатся успехом. С другой стороны активность веществ значительно возрастает при увеличении их дисперсности. Например, сахар и алюминий не горят, но сахарная или алюминиевая пыль, взвешенная в воздухе, вспыхивает или взрывается от легкого контакта с пламенем. Аналогично обстоит дело с железом и некоторыми другими металлами. Мелкодисперсный порошок железа способен самовоспламенятся на воздухе. Таким свойством обладают и мелкие порошки других металлов средней активности. Вещества, способные самовоспламеняться при контакте с воздухом, называются пирофорными. Например, пирофорными свойствами обладают силан, амид натрия и белый фосфор. Особое место среди пирофорных веществ занимают пирофорные металлы. Пирофорные порошки можно легко получить из железа, кобальта, никеля, свинца. Для этого существует несколько методов. Пирофорные металлы образуются при нагревании солей органических кислот (формиаты, оксалаты, цитраты, тартраты и др.). Обычно этот процесс проводят в пробирке, закрытой ватным тампоном. После разложения в пробирке остается металл в высокодисперсном активном состоянии. Пробирку открывают и высыпают содержимое на огнестойкую поверхность. От контакта частичек металла с воздухом вспыхивает дождь искр. Если проводить восстановление оксидов некоторых металлов водородом в мягких условиях (т.е. при возможно более низкой температуре) металлы образуются в мелкодисперсном состоянии и обладают пирофорными свойствами. Если реакция восстановления происходит при более высокой температуре, образуются более крупные частицы металла, которые более устойчивы к окислению и уже не обладают пирофорностью. Пирофорный никель образуется при растворении сплава никеля и алюминия в щелочи. Алюминий при этом растворяется, а никель выделяется в активном состоянии. Такой никель является хорошим катализатором для целого ряда реакций органического синтеза, например, при гидрировании ненасыщенных жиров. Он получил название никель Ренея. Кроме никеля Ренея существует также кобальт и железо Ренея, которые получают аналогичным методом. При конденсации паров металлов в вакууме иногда образуются мелкодисперсные порошки, которые также могут обладать пирофорными свойствами. Ниже описано получение пирофорного железа, кобальта и никеля. Пирофорному свинцу мы планируем посвятить отдельную статью [1]. __________________________________________________ 1-1 См. статью Воспламенение рубидия на воздухе [ссылка] 1 Данная статья уже вышла: Пирофорный свинец ч.1. Пирофорный свинец из тартрата свинца [ссылка]; Пирофорный свинец ч.2. Пирофорный свинец из ацетата свинца [ссылка] |

Самовоспламенение никеля Ренея experiment.edu.ru Смотреть Видео |
|
Пирофорное железо из оксалата
Насыпьте в пробирку оксалат железа слоем в 3-4 см. Закрепите пробирку в штативе наклонно, под углом примерно 70 градусов к горизонтали. Закройте отверстие пробирки неплотным ватным тампоном. Сначала нагрейте пробирку слабо и равномерно по всей длине, потом сильно нагрейте нижнюю часть пробирки. Оксалат железа начнет понемногу разлагаться, на его поверхности образуются черные участки. Для разложения оксалата важно обеспечить равномерный нагрев вещества по всему объему. Для этого по пробирке постукивают деревянной палочкой или металлической проволокой. Полезно также поворачивать пробирку. В противном случае на стенках пробирки образуется корка, внутри которой останется неразложившийся оксалат железа. Благодаря постукиванию эта корка разрушается, и оксалат железа контактирует с горячими стенками пробирки. Постукивание необходимо также чтобы не дать пылеподобным частичкам, унесенным газами, прилипнуть к холодной верхней части пробирки. Чтобы капельки воды не конденсировались внутри пробирки, пламя время от времени переносят в среднюю и верхнюю часть пробирки. FeC2O4·2H2O = Fe + 2CO2 + 2H2O
Когда весь желтоватый оксалат превратится в черное пирофорное железо, помещение затемняют. Пробирку снимают с пламени, вынимают вату, и содержимое быстро высыпают на металлический лист или керамическую плитку (с высоты около 30 см). Появится сноп желтых и красных искр. Упавшие частички будут некоторое время тлеть. Зажгите свет. Станет заметно, что значительная часть порошка железа окислилась до коричневого Fe2O3 и черного Fe3O4. Чтобы эксперимент получился более эффектно, важно высыпать содержимое пробирки быстро и резко, пока железо не успело остыть. В некоторых источниках рекомендуют предварительно охладить содержимое пробирки до комнатной температуры, но в этом случае опыт часто не получается (или получается плохо). Для разложения оксалата железа требуется более сильный нагрев, чем для разложения формиатов железа, кобальта или никеля. Эксперименты по получению пирофорного железа из формиата у нас получились плохо. Лишь малая часть железа обладала пирофорностью. Видимо, дело в низком качестве продажного реактива. Пирофорное железо (а также другие пирофорные металлы) не рекомендуется хранить по причине возможности самовоспламенения. |
Разложение оксалата железа |
Пирофорное железо |
|
Получение оксалата железа
Малорастворимый оксалат железа получают обменной реакцией между раствором соли железа (II) и оксалата натрия. Мы использовали сульфат железа (II) (FeSO4, железный купорос). К раствору железного купороса (примерно 10 гр) добавили раствор оксалата натрия. Желтый осадок оксалата железа промыли несколько раз декантацией [2], потом отфильтровали и высушили. Если у вас нет оксалата натрия, его можно приготовить, нейтрализуя щавелевую кислоту недостатком соды. Na2C2O4 + FeSO4 = FeC2O4 + Na2SO4
__________________________________________________2 Промывку декантацией делают следующим образом: ждут, пока осадок осядет на дно сосуда, потом аккуратно сливают раствор, чтобы не взмутить осадок. После этого в сосуд наливают чистую воду, перемешивают содержимое и снова ждут, пока осадок соберется на дне. Раствор над осадком сливают и добавляют чистую воду. Операцию повторяют несколько раз. |
Получение оксалата железа |
|
Получение пирофорного железа из цитрата железа
В книге Э. Гроссе, X. Вайсмантель Химия для любознательных. Основы химии и занимательные опыты [ссылка] описан немного другой рецепт получения пирофорного железа. Исходными реактивами служат лимонная кислота и порошок или опилки железа, а пирофорное железо образуется при разложении цитрата: "Получим железную пыль
В 10 мл воды растворим около 3 г лимонной кислоты и добавим половину чайной ложки тонкого порошка железа или очень мелких опилок. Будем нагревать содержимое пробирки до тех пор, пока железо не растворится. По мере надобности необходимо добавлять воду. Затем нагреем до полного испарения воды, закроем пробирку тампоном из стеклянной ваты и продолжим интенсивный нагрев до тех пор, пока пробирка не покроется темным налетом. Удалим ватный тампон, и проволокой выгребем образовавшиеся крошки тонкодисперсного железа на огнеупорную подложку. Часто они начинают сами раскаляться на воздухе. Железо, полученное термическим разложением лимоннокислого железа, способно к самовоспламенению (пирофорное железо), что может привести к пожару". В книге Г. Тиссандье Научные развлечения. Знакомство с законами природы путем игр, забав и опытов [ссылка] рекомендуется получать пирофорное железо из оксалата нагреванием его в токе водорода. 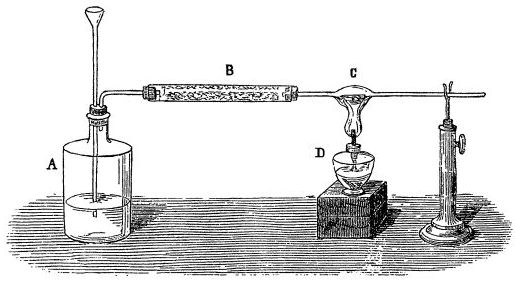 Горение пирофорного железа в кислороде выглядит более красиво, чем на воздухе". Получение пирофорного кобальта разложением формиата
Насыпьте в пробирку формиат кобальта Co(HCOO)2·2H2O, чтобы образовался слой высотой 4-5 см. Закрепите пробирку наклонно в штативе и закройте ее ватным тампоном. Начните аккуратно нагревать пробирку по всей длине, а когда ее стенки прогреются, сосредоточьте сильное пламя на нижней части. Формиат кобальта начнет разлагаться: соль вспучится, розовый порошок потемнеет, и в нем начнут образовываться черные зоны. Чтобы обеспечить равномерный нагрев постукивайте по пробирке металлической проволокой. Значительную часть порошка унесут газы в верхнюю часть пробирки, чтобы он не прилипал к стенкам периодически прогревайте средину и верх пробирки пламенем горелки. Co(HCOO)2·2H2O = Co + 3H2O + CO2 + CO
Когда все содержимое пробирки станет черным и выделение газов прекратится, процесс окончен. Заключительную часть опыта проводят в затемненном помещении. Снимите пробирку с огня, погасите в помещении свет и быстро высыпьте содержимое на металлический лист или керамическую плитку. Вспыхнет сноп желтых и красных искр. Упавшие частички продолжат некоторое время тлеть. Включите свет. Вы увидите черный порошок кобальта, который частично окислился, однако это не будет визуально заметно, поскольку оксиды кобальта CoO и Co3O4 также черного цвета. Данный эксперимент аналогичен опыту по получению пирофорного железа из оксалата, однако есть и существенные отличия. Во-первых, формиат кобальта разлагается при нагревании значительно легче, чем оксалат железа. Во-вторых, соли кобальта токсичны, поэтому не следует допускать их попадания на кожу. Особенно следует избегать попадания пыли формиата кобальта в дыхательные пути. Последнее более чем вероятно, если процесс разложения формиата проводить без вытяжки. |
Получение пирофорного кобальта разложением формиата |
Пирофорный кобальт |
|
|
|
Получение пирофорного никеля разложением формиата
Получение пирофорного никеля из формиата Ni(HCOO)2·2H2O в основном аналогично получению пирофорного кобальта. Зеленый формиат никеля легко разлагается до черного порошка пирофорного никеля, который при высыпании из пробирки дает желтые и красные искры. В одном из экспериментов искры получились довольно яркими. Не следует, однако, забывать, что соли никеля ядовиты. Избегайте их попадания на кожу. Особенно берегитесь попадания пыли соединений никеля в дыхательные пути. Последнее более чем вероятно, если процесс разложения формиата проводить без вытяжки. Методы получения формиата никеля описаны в упомянутой выше книге Э. Гроссе, X. Вайсмантель Химия для любознательных. Основы химии и занимательные опыты [ссылка]: "Никель по тому же рецепту
Никель также можно получить в виде тонкого порошка, разлагая соли органических кислот. Но так как никель плохо растворяется в органических кислотах, получим метанат (формиат) никеля, то есть никелевую соль метановой (муравьиной) кислоты, следующим образом.Из раствора сульфата никеля осадим, добавляя соду, карбонат никеля, который при взаимодействии с водой (гидролиз) частично переходит в гидроксид никеля [3] . Осадок быстро отфильтруем и растворим при нагревании в 30-50%-ной метановой кислоте. При этом удаляется угольная кислота, и образуется метанат никеля Ni(HCOO)2, который выкристаллизовывается при увеличении концентрации раствора. (Осторожно! Метановая кислота едкая, а летучие пары ядовиты. Опыт проводить под тягой или на открытом воздухе!) Кроме этого, можно приготовить соль с помощью реакции двойного обмена. Растворим 5 г сульфата никеля в воде и добавим раствор 4 г метаната (формиата) натрия. Соли взаимодействуют по схеме: NiSO4 + 2NaHCOO = Ni(HCOO)2 + Na2SO4
При увеличении концентрации раствора сначала выделяется метанат никеля; легкорастворимый сульфат натрия останется в маточном растворе.Прокаливая соль в пробирке, получим легкие крошки порошка никеля. Благодаря своей большой поверхности тонкодисперсные металлы химически очень активны. Например, порошок никеля является незаменимым катализатором при присоединении водорода (гидрирование) органическими молекулами. Эта реакция описана в книге применительно к отверждению жиров. Пероксид водорода (как мы можем легко проверить) каталитически разлагается тонкодисперсными металлами. В технике металлы часто получают в виде порошков (порошковая металлургия)". __________________________________________________ 3 В описанных условиях образуется основный карбонат никеля (- прим. ред.) |
Получение пирофорного никеля разложением формиата |
Пирофорный никель |
Кобальт обладает ферромагнитными свойствами Cobalt is a Ferromagnetic Metal |
|
Ниже представлены аналогичные фотографии и видео с порошком никеля
|
Никель обладает ферромагнитными свойствами Nickel is a Ferromagnetic Metal |

Магнетит - Fe3O4 |

|

|