
Эксикаторы: большой и маленький









| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 1 2011 Журнал Химиков-Энтузиастов |
Что такое эксикатор? В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Практически все вещества способны поглощать влагу из воздуха. Возьмем, например, стекло. Стекло сорбирует (поглощает) некоторое количество водяных паров из воздуха, а при нагревании снова их отдает. Не верите?
Сильно нагреем дно стеклянной пробирки в пламени газовой горелки. При этом в верхней (холодной) части пробирки соберется немного капелек воды. Такое наблюдается не всегда, но довольно часто: нагретое стекло выделяет адсорбированные пары воды, которые конденсируются на холодных поверхностях. Стекло адсорбирует воду слабо, но есть вещества, которые поглощают влагу из воздуха очень интенсивно, причем часто происходит не физическая адсорбция, а химическая реакция (которая может быть необратимой). Например, если оставить на воздухе фосфорный ангидрид, его масса будет быстро возрастать. Взвесьте закрытый бюкс с фосфорным ангидридом на аналитических весах, запишите его массу. Потом откройте крышку, положите ее рядом на чашке весов и снова включите весы. Масса бюкса будет увеличиваться буквально на глазах (например, со скоростью несколько десятков миллиграммов в секунду). Фосфорный ангидрид представляет собой белый порошок, похожий на муку, но на воздухе он буквально за минуты превращается в полужидкую кашу полифосфорных кислот. Если у вас нет фосфорного ангидрида, проведите аналогичный эксперимент с концентрированной серной кислотой, оксидом кальция, едким натром или безводным сульфатом меди. В последнем случае белая безводная соль CuSO4 постепенно перейдет в синий кристаллогидрат CuSO4•5H2O. Можно использовать и другие гигроскопичные вещества. Если у вас нет аналитических весов, подойдут и обыкновенные электронные весы, которые дают точность до 0.001 или 0.01 г. Правда, ждать видимых изменений придется дольше. Сульфат меди и серная кислота поглощают воду обратимо: при нагревании вода снова выделяется. Кусочки оксида кальция или едкого натра поглощают из воздуха не только влагу, но и углекислый газ. Натрий реагирует также с кислородом, а литий - еще и с азотом. Цеолиты поглощают воду довольно активно, но в этом случае происходит не химическая реакция, а просто адсорбция. В структуре цеолитов содержатся многочисленные каналы, которые могут сорбировать воду и другие небольшие молекулы (в зависимости от диаметра каналов). Итак, мы убедились, что некоторые вещества совсем не безразличны к водяным парам и другим компонентам воздуха. Возникает вопрос: как работать с такими веществами в лаборатории? Хранить их можно в плотно закрытых бутылках, а если это не помогает - в запаянных ампулах или колбах. Но хранить вещества - одно, а работать с ними - другое. Например, у нас есть медный купорос CuSO4•5H2O, поставлена задача: определить содержание в нем воды. Казалось бы, задача проста, необходимо: 1. Взвесить пустой тигель. 2. Насыпать в него пару граммов медного купороса и опять взвесить. По разности первого и второго взвешиваний мы узнаем массу навески медного купороса. 3. Теперь нагреем тигель до тех пор, пока медный купорос полностью не обезводится, и снова взвесим тигель. По разности масс тигля до и после прокаливания мы будем знать, сколько воды было в медном купоросе. Теперь поделим массу воды на массу исходной навески медного купороса, умножим результат на 100%, и мы получим содержание воды в исследуемом образце. Создается впечатление, что все элементарно, но мы допустили несколько грубых ошибок. а) Горячий тигель, который мы только что нагревали (п. 3), взвешивать нельзя. Он должен остыть до температуры весов. А пока тигель будет остывать, безводный сульфат меди будет преспокойно поглощать влагу из воздуха, что сильно исказит (занизит) результат анализа. Накрыть тигель крышкой? Не поможет. б) Пустой тигель, который мы взвесили (п. 1), сорбировал небольшое количество воды. При нагревании он отдаст эту воду, и его масса уменьшится. Потом будет невозможно определить, за счет чего уменьшилась масса при прокаливании: за счет потери воды медным купоросом, или потери воды самим тиглем. Что же делать? Существует прибор, назначение которого - предохранять от действия водяных паров (а если необходимо, и углекислого газа или кислорода). Называется этот прибор эксикатор. Эксикатор - стеклянный сосуд с крышкой, внутри которого содержится осушитель. В эксикаторе есть специальный фарфоровый вкладыш, на который ставят тигли, бюксы, выпарные чашки и другую посуду. Благодаря осушителю внутрь эксикатора можно поставить горячий тигель с обезвоженным сульфатом меди, и при этом не бояться, что он "наглотается" влаги. Когда тигель остынет, его вынимают и быстро взвешивают. (В случае особо гигроскопичных веществ тигель или бюкс после прокаливания накрывают крышкой). Перед анализом пустые тигли (в которые мы потом поместим кристаллогидрат сульфата меди - п.1) также прокаливают, охлаждают в эксикаторе и взвешивают. При нагревании тигель отдает всю сорбированую воду (и последняя уже не искажает результаты анализа). Убедиться, что тигель отдал всю воду (и другие летучие вещества) очень просто. Для этого тигель нагревают определенное время, охлаждают в эксикаторе и взвешивают, после этого снова нагревают, охлаждают и взвешивают. Если результаты первого и второго взвешиваний практически не отличаются - все в порядке. Если после второго нагревания масса тигля уменьшилась - необходимо увеличить время термической обработки (до тех пор, пока масса тигля не перестанет изменяться). Аналогично поступают, если необходимо установить, сколько следует греть тигель с исследуемым образцом для полного разложения последнего. В дальнейшем достаточно просто запомнить время, необходимое для нагревания тиглей (пустых или с исследуемым образцом) и не повторять эту процедуру дважды. Операция нагревания исследуемого образца до полного удаления летучих компонентов (или полного окисления образца кислородом) называется "нагревание (прокаливание) до постоянной массы". Теперь остановимся немного подробнее на конструкции самого эксикатора. Эксикатор - сосуд из толстого стекла диаметром примерно от 15 до 30 см. Снизу расположена чашка Петри или выпарная чашка с осушителем. Далее расположен фарфоровый вкладыш. Вкладыш держится благодаря тому, что нижняя часть эксикатора более узкая, чем верхняя. На вкладыш помещают тигли, бюксы, выпарные чашки и т.п. Фарфоровый вкладыш имеет отверстия, которые обеспечивают циркуляцию воздуха. Сверху эксикатор накрывается крышкой из толстого стекла. Чтобы обеспечить герметичность, шлиф эксикатора смазывают вязкой смазкой. |

Эксикаторы: большой и маленький |

|

|

|

|

|

|

|

|
 |
|
Когда в эксикатор кладут горячие тигли, воздух внутри нагревается и начинает частично выходить из эксикатора. При этом крышка слегка приподнимается, а смазка становится более жидкой. В результате крышка может соскользнуть и разбиться. Чтобы этого не случилось, крышку придерживают рукой. Можно также не полностью закрыть эксикатор, подождать пару минут, пока выйдет воздух и только после этого герметично закрыть крышку.
Если крышка хорошо смазана и притерта, после охлаждения теплого воздуха в эксикаторе возникнет разрежение, и крышку будет трудно открыть. В таком случае крышку аккуратно сдвигают в сторону. При этом необходимо придерживать и крышку, и сам эксикатор (в противном случае существует риск их разбить). Когда вы переносите эксикатор - обязательно придерживайте крышку (обеими руками). Было немало случаев, когда во время переноса эксикаторов крышка падала и разбивалась. Толстое стекло имеет низкую термостойкость, поэтому эксикаторы нельзя нагревать. Большие эксикаторы громоздки и неудобны в работе, маленькие могут иметь недостаточную вместительность. Существуют эксикаторы, внутри которых можно создать вакуум (вакуум-эксикаторы). Такие эксикаторы имеют в крышке специальную трубку с краном, которую присоединяют к вакуум-насосу. С помощью насоса в эксикаторе создается вакуум, после чего кран перекрывают. Применение эксикаторов совсем не ограничивается химическим анализом. Например, с помощью эксикаторов можно выпаривать растворы при комнатной или пониженной температуре. В эксикатор ставят стакан или выпарную чашку с раствором. Вода, которая испаряется, будет поглощаться осушителем, что обеспечит дальнейший процесс испарения. Теперь скажем несколько слов об осушителях. В качестве осушителей используются самые разнообразные вещества. Выбор конкретного осушителя зависит от его эффективности и доступности. Очень эффективный осушитель - фосфорный ангидрид. Он не только способен удалять адсорбированную воду, но также может отнимать молекулы воды, которые "входят" в состав других молекул (конституционная вода). Недостатки пятиокиси фосфора: дефицитность и невозможность регенерации. У химиков-органиков это довольно ходовой реактив, поэтому нерационально использовать его в эксикаторах. Хорошую степень осушки обеспечивают цеолиты. Цеолиты можно легко регенерировать нагреванием. Недостатком цеолитов является их дороговизна. Неплохой осушитель - концентрированная серная кислота. Кислоту можно затем регенерировать упариванием раствора, однако эта процедура далеко не безвредна. К сожалению, серную кислоту можно легко разлить или разбрызгать. Негашеная известь и едкий натр поглощают не только воду, но и углекислый газ (а также другие кислотные газы). Недостатки едкого натра - невозможность регенерации, разрушение стекла (и фарфора), невысокая осушающая способность. В качестве осушителя также с успехом используют силикагель. Он выпускается в виде круглых гранул. Подобно цеолитам силикагель поглощает воду за счет адсорбции и может быть регенерирован нагреванием. Иногда к силикагелю добавляют хлорид кобальта. Пока хлорид кобальта синий, силикагель пригоден к работе, но по мере поглощения воды хлорид кобальта становится розовым, это сигнализирует, что осушитель перестал действовать и нуждается в регенерации. Один из самых слабых осушителей - хлорид кальция. Однако это вещество нередко используют в лаборатории, если нет необходимости в глубоком осушении. Преимущества хлорида кальция: дешевизна и возможность регенерации. Характеристики некоторых осушителей приведены в таблице (согласно книге П.И. Воскресенский Техника лабораторных работ - ссылка). Характеристики некоторых осушителей
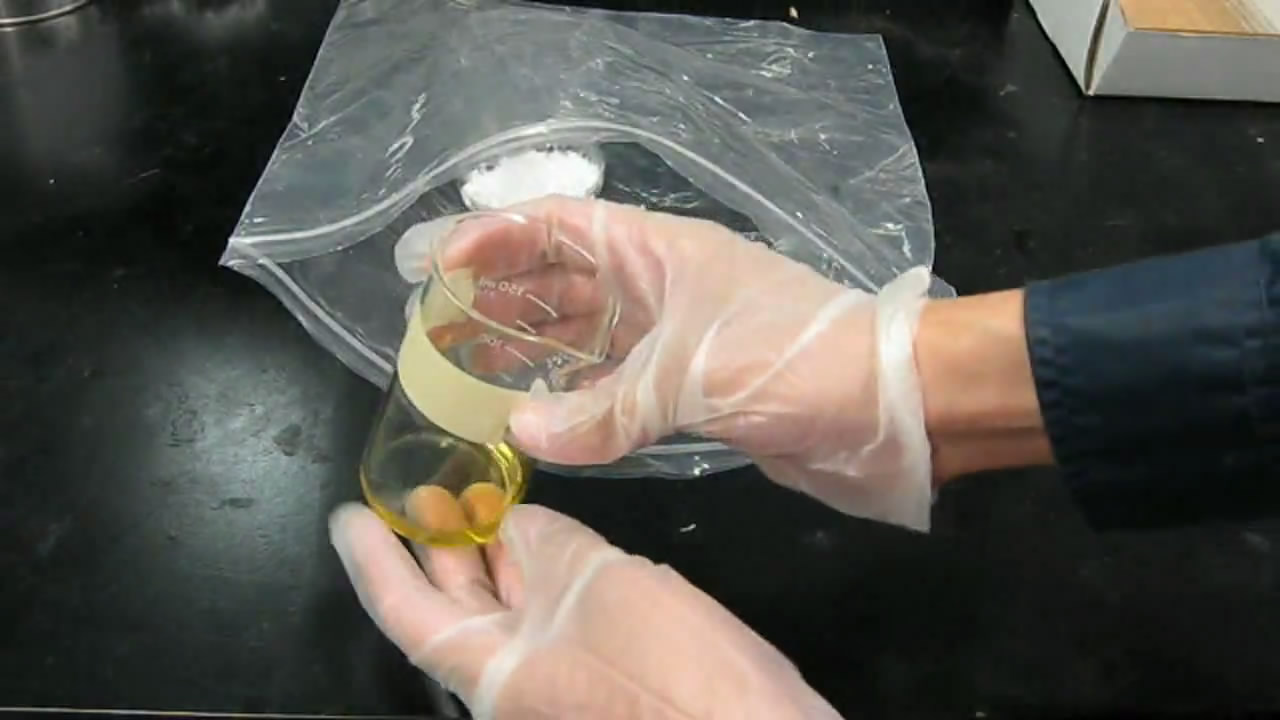
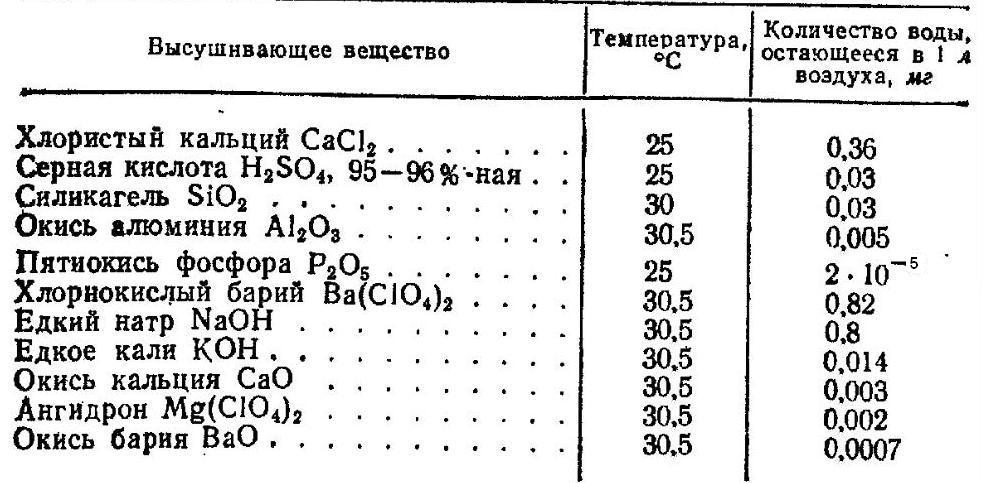 Обратите внимание, что в качестве осушителя раньше активно применяли перхлорат магния (ангидрон). В некоторых лабораториях ангидрон стоял буквально мешками. Вещество заслуживает внимания как сильный окислитель и источник перхлората, но перхлорат магния сейчас практически вышел из употребления. Главная причина - взрывоопасность перхлоратов при соприкосновении с органическими веществами. Эксикаторы есть в большинстве химических лабораторий, но мало какая из домашних лабораторий может похвастать настоящим эксикатором. Как быть юным химикам? Вместо эксикатора можно приспособить широкую банку, на дно которой положить осушитель и подставку для тиглей, стаканов и бюксов. Это не совсем удобно, однако, выбирать не приходится. Неплохим решением являются также пакеты со струнным замком (пакет-струна, ZIP-LOCK). В пакет помещают чашку или банку с осушителем и стаканы с веществом или раствором, который необходимо упарить. После этого пакет плотно закрывают (не забывая следить за тем, чтобы к осушителю и стаканам с осушаемым веществом был свободный доступ воздуха). Последовательность действий показана на приведенных ниже фотографиях. |

Самодельный эксикатор из полиэтиленового пакета |

|
|

Осушитель и стакан с раствором помещают в пакет и плотно закрывают |

|

|

Через некоторое время раствор испаряется |

|
|
|