
Пьер Луи Дюлонг
| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 3 2012 Предварительный вариант |
Хлористый азот ч.1 Козьма Прутков |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Литература. В чем опасность хлористого азота?
В литературе и интернете имеется более чем достаточно сведений по получению и свойствам различных взрывчатых веществ. Однако если мы захотим узнать, что такое хлористый азот (трихлорид азота, нитрид хлора), вскоре обнаружим, что сведений о данном веществе немного. Значительная часть этих сведений содержится в старых или сравнительно старых книгах. Авторы современных учебников (и тем более - практикумов) предпочитают обходить хлористый азот молчанием (а некоторые из них могут и не знать о существовании данного вещества). В интернете легко можно найти видео и фотографии взрыва нитроглицерина, иодистого азота и других распространенных или экзотических веществ. В наше время такими кадрами никого не удивишь. Но с хлористым азотом дело сложнее.
С чем же связано такое "особое положение" хлористого азота, ведь на первый взгляд он не должен особо отличаться от иодистого азота - вещества известного практически каждому химику? Чтобы ответить на этот вопрос, для начала посмотрим, что пишут о данном веществе в литературе. Начнем с книги Дмитрий Иванович Менделеев - Основы химии. |
|
При действии хлора на аммиак может произойти или полное разложение последнего или замещение водорода на хлор (как в метане). При избытке хлора и нагревании аммиак разрушается, выделяя азот [1]. Такая реакция, очевидно, сопровождается образованием нашатыря (хлорид аммония):
8NH3 + 3Cl2 = 6NH4Cl + N2 Но если в избытке будет соль аммония, то произойдет замещение водорода в аммиаке на хлор. Сущность этого процесса в следующем: NH3 + 3Cl2 = NCl3 + 3HCl [2] Образующийся при этом продукт замещения - хлористый азот NCl3, открытый Дюлонгом, представляет собой жидкость, которая очень легко разлагается не только при нагревании, но и от механических воздействий: удара или прикосновения некоторых твердых веществ. При взрыве хлористого азота образуются газы: азот и хлор [3]. Хлористый азот - желтая маслянистая жидкость, плотность - 1,65, кипящая при 71°С, а при 97°С разлагающаяся на 3Cl + N. Соприкосновение с фосфором, скипидаром, резиной приводит к такому сильному взрыву, что малая капля способна пробить толстые доски. Столь сильная способность к разложению хлористого азота связана с тем, что он образуется с поглощением тепла, и разлагаясь его выделяет, причем в количестве 38 тысяч единиц тепла [калорий] на моль NCl3. _______________________________ 1 Этим можно пользоваться для получения азота. Если в цилиндр налить хлорной воды и добавить небольшое количество раствора аммиака, то после взбалтывания выделится азот. Если через тонкое отверстие вводить аммиак в сосуд с хлором, то реакция образования азота будет сопровождаться выделением света и образованием дыма хлорида аммония. Во всех этих случаях имеет место избыток хлора. 2 Образующийся хлороводород соединяется с аммиаком, поэтому суммарное уравнение следующее: 4NH3 + 3Cl2 = NCl3 + 3NH4Cl Реакция замещения водорода на хлор идет только при избытке аммиака или его соли. Если через тонкую трубку пустить аммиак в сосуд с хлором, будут происходить небольшие взрывы. Однако если пропускать хлор через раствор аммиака, то будет сначала происходить образование азота, потому что хлористый азот действует на аммиак, как хлор. Когда в растворе останется только хлорид аммония, начнется образование хлористого азота. При действии хлора на раствор хлорида аммония всегда образуется хлористый азот, однако если в растворе есть аммиак, он реагирует с хлористым азотом по уравнению: NCl3 + 4NH3 = N2 + 3NH4Cl Поэтому, если жидкость имеет щелочную реакцию, образуется в основном азот. Реакция NH4Cl + 3Cl2 = NCl3 + 4HCl обратима: в разбавленном растворе она идет слева на право, а при действии крепкой соляной кислоты - в обратном направлении. Обратная реакция дала возможность Девиллю и Готфейлю установить состав хлористого азота. Медленно разлагаясь под действием воды, хлористый азот дает, как хлорангидрид, азотистую кислоту или ее ангидрид: 2NCl3 + 3H2O = N2O3 + 6HCl <...> 3 При получении хлористого азота следует принять все предосторожности - учитывая возможность взрыва. Необходимо следить, чтобы хлористый азот оставался под слоем водного раствора. Когда аммиак и его соли приходят в соприкосновение с хлором, всегда нужно быть очень осторожным, потому что могут быть случаи образования хлористого азота и опасные взрывы. Безопаснее всего получать хлористый азот в виде мелких капель, действуя электрическим током на слегка нагретый раствор хлорида аммония. Выделяющийся на аноде хлор действует на аммиак, образуя хлористый азот, который постепенно всплывает на поверхность (за счет того, что увлекается газом). Если сверху налить слой скипидара, то при контакте с ним эти маленькие капли дают слабые взрывы - полностью безопасные за счет небольшого количества вещества. Капли хлористого азота можно, хотя и с большой осторожностью, собрать для исследования, если поступить следующим образом. Горло воронки опускают в чашку со ртутью, в воронку наливают сперва насыщенный раствор поваренной соли, а поверх его раствор хлорида аммония в 9 ч. воды, после чего медленно пропускают хлор, и тогда в соленую воду падают капли хлористого азота. Hentschel для приготовления раствора хлористого азота в бензоле поступал так: раствор белильной [хлорной] извести осторожно смешивал с таким количеством соляной кислоты, чтобы раствор хлорида аммония не давал газов, после чего прибавлял раствор хлорида аммония и бензол при постоянном взбалтывании, причем хлористый азот, образуясь, растворялся в бензоле, а раствор всплывал наверх. Такой раствор можно сравнительно безопасно хранить в темноте. |
|
Довольно подробно свойства хлористого азота рассмотрены в статье энциклопедического словаря Брокгауза и Ефрона.
|
|
Хлористый азот
NCl3, представляет по своему составу аммиак NH3, в котором весь водород замещен хлором. Хлористый азот был открыт Дюлонгом в 1812 г. и вследствие своей необычайной взрывчатости возбудил к себе очень большой интерес в среде химиков. Исследованиями его состава и свойств вслед за Дюлонгом занимался целый ряд ученых, каковы Дэви и Фарадэй, Порре, Вильсон и Кирк, Серюлла, Милон, Маршан, Баляр, Бино, Кольбе, Бётгер, Гладстон, С. К. Девилль и Готфейль, а в последнее время В. Мейер, Гаттерман и Ф. Селиванов. Исследования эти, между прочим, сопряжены со значительной опасностью. Так, Дюлонг потерял при своих опытах глаз и несколько пальцев; сильно пострадали также Дэви и Фарадэй, а Гаттерман, произведший впервые определение состава хлористого азота весовым путем и подвергавшийся при этом особенно сильному риску, от постоянного напряжения при работе получил нервное расстройство и на время должен был вовсе прекратить научные занятия. Для получения хлористого азота (Dalong) действуют хлором на раствор серно-аммиачной соли или нашатыря, нагретого до 30 - 35°; реакция, в случае, напр., нашатыря, совершается согласно уравнению:
NH4Cl + 3Cl2 = NCl3 + HCl. Теплый раствор нашатыря наливают в чашку, и в нее опрокидывают сосуд (колбу или стеклянный цилиндр), наполненный хлором. По мере поглощения хлора жидкость поднимается в опрокинутом сосуде, и на ее поверхности мало-помалу образуются маслянистые капли хлористого азота, которые затем падают и собираются на дне чашки. Можно также получать хлористый азот действием на нашатырь крепкого раствора хлорноватистой кислоты (Balard): NH4Cl + 3HClO = NСl3 + 3Н2O + НСl. Удобнее всего при этом брать нашатырь куском и подвешивать его в жидкости; образующийся при этом хлористый азот падает на дно сосуда. Наконец, он образуется при электролизе (Kolbe u. Bötger) насыщенного раствора нашатыря, именно на положительном электроде, вследствие действия выделяющегося здесь хлора на нашатырь. Этот способ годится лишь для получения NCl3 в очень небольшом количестве (например, для демонстрирования на лекциях). Во всех этих случаях, однако, не получается чистого хлористого азота, а смесь его с низшими продуктами замещения водорода в аммиаке хлором NH2Cl и NHCl2. Чистый хлористый азот состава NCl3 Гаттерману впервые (1888) удалось получить, подвергая обычный продукт действия хлора на нашатырь дополнительной обработке газообразным хлором. Хлористый азот представляет желтого цвета маслянистую, довольно легколетучую жидкость уд. веса 1,653 (?); пары ее едки, по запаху напоминают хлор и вызывают слезы; при 71° она перегоняется, а выше 93° взрывается с необычайно сильным бризантным действием, разлагаясь на хлор и азот. При обыкновенной температуре взрыв хлористого азота вызывается действием прямого солнечного или магнезиального света (Gattermann), соприкосновением его с кусочком белого фосфора, с селеном, мышьяком, твердым йодом, фосфористым кальцием, фосфористым водородом, озоном, перекисью водорода, окисью азота, скипидаром, жирными маслами, каучуком, некоторыми смолами, крепкими растворами щелочей и аммиака. Крайне малая стойкость и чрезвычайно сильная взрывчатость хлористого азота находит себе объяснение в очень большой отрицательной теплоте образования его из элементов, равной - 38000 cal. (St. Cl. Deville et Hautefeuille). Вода при обыкновенной температуре медленно разлагает хлористый азот на хлор и азот [В кислой среде, по Селиванову, разложение NCl3 водой не сопровождается выделением азота и происходит по уравнению: NCl3 + 3H2O + НСl = NH4Cl + 3HClO, т. е. образуется хлорноватистая кислота; это обстоятельство, а также образование хлористого азота по способу Валара (см. выше) при действии на нашатырь хлорноватистой кислоты дает ему повод рассматривать NHCl2, NCl3, как амиды этой последней кислоты: он их называет "хлориламидами".]; с крепкой соляной кислотой он дает обратно хлор и нашатырь: NCl3 + 4HCl = NH4Cl + 3Cl2, следовательно, образование NCl3 из хлора и нашатыря представляет обратимый процесс; с разбавленным водным аммиаком NCl3 выделяет азот, а образующийся при этом хлористый водород дает с избытком аммиака нашатырь: NCl3 + 4NH3 = N2 + 3NH4Cl, почему хлористый азот и не может образоваться при действии хлора на аммиак; сернистый водород, сернистая, мышьяковистая и иодноватистая кислоты окисляются им также с выделением свободного азота: металлы, их сернистые соединения, водные растворы щелочей отнимают от него хлор, освобождая азот; сернистый углерод растворяет хлористый азот без изменения. П.П. Рубцов. |
|
Как видите, в старой литературе хлористый азот освещен довольно основательно: не меньше, чем привычные для нас вещества. Обращает на себя небольшое, но принципиальное отличие фрагмента "Основ химии" и статьи в энциклопедическом словаре Брокгауза-Ефрона.
Менделеев рассматривает хлористый азот как хлорангидрид азотистой кислоты и проводит его аналогию с треххлористым фосфором. Из этого следует, что азот в NCl3 должен быть заряжен положительно, а хлор - отрицательно. В "энциклопедическом словаре" хлористый азот рассматривается как амид хлорноватистой кислоты, а это означает противоположное: азот должен быть заряжен отрицательно, а хлор - положительно. Такое разногласие не удивительно, ведь хлор и азот имеют довольно близкие значения относительной электроотрицательности (согласно шкале Полинга: азот - 3,04, хлор - 3,16). |

Пьер Луи Дюлонг |
|
Теперь приведем фрагмент из книги Б. Могилевский - Живи в опасности. Повесть о великом химике Гемфри Дэви (1970) с. 183-184.
|
|
В химической лаборатории Королевского института Дэви начал серию экспериментов по синтезу хлористого азота, только что открытого одним французским химиком. Дэви получил об этом сообщение из Парижа от знаменитого математика и физика Доминико Араго, который писал, что его шурин Дюлонг получил жидкое вещество маслянистого вида, содержащее хлор и азот. Это открытие, далее сообщал Араго, стоило Дюлонгу глаза и трёх пальцев. Хлористый азот оказался одним из самых взрывчатых веществ, с которыми до тех пор имели дело химики.
Верный своему жизненному правилу учёного, прокладывающего путь в неизведанное, на котором могут оказаться любые неожиданности, положивший себе за правило жить в опасности, Дэви немедленно принялся за исследования. Предупреждение Араго о скверном нраве хлористого азота не было принято во внимание, никаких мер предосторожности Дэви, по своему обыкновению, не предпринял. В одном из первых же опытов Дэви убедился в том, что Араго не бросал слов на ветер. Осколки стекла от разорвавшейся колбы впились в лицо, Дэви получил серьёзное поражение глаза. Настолько серьёзное, что не мог писать и читать. Тогда-то Дэви и вспомнил о молодом переплётчике. За Фарадеем был послан служитель Королевского института. Дэви попросил Фарадея выполнить ряд поручений. Он записал в тетрадь результаты наблюдений, которые Дэви из-за буйного характера хлористого азота и ранения не смог сделать. Затем Дэви продиктовал Фарадею несколько писем. Одно из них было адресовано брату, вот его содержание: Из письма Г. Дэви брату
"Дорогой Джон! Я открыл способ соединения азота и хлора. Следует подвергать действию хлора очень слабый раствор аммиака, или раствор нитрата аммония, или оксалата аммония. Следует быть очень осторожным. Количество вещества не должно превышать размеры булавочной головки. Я взял чуть-чуть больше, и взрыв привёл к серьёзному повреждению глаза. Но как мне сказали, зрение моё не пострадает. Сейчас я вижу очень плохо".
Гемфри Дэви, зная, как огорчит его письмо всех родных в Пензансе, умолчал о всей серьёзности ранения лица и глаза. Джон Дэви в своих мемуарах о брате, описывая опыты с хлористым азотом и результаты взрыва, указывал, что поражение глаза было настолько тяжёлым, что Гемфри долго ничего не видел и был оторван от лабораторной работы. Прошло два месяца после взрыва хлористого азота, и в очередном письме Гемфри сообщал Джону. "Глаз мой снова находится в таком воспалённом состоянии, что пришлось прибегнуть к проколу слизистой и роговой оболочки. Мне пришлось отложить все свои опыты". |

Гемфри Дэви |
|
Как видите, уже первые исследователи хлористого азота получили наглядное представление про опасность данного вещества. Работа с хлористым азотом без серьезных предосторожностей означала практически гарантированные увечья. Теперь посмотрим, что пишут о хлористом азоте в более поздних книгах.
В учебнике Г. Реми Курс неорганической химии о хлористом азоте сказано совсем немного (по сути это сжатый пересказ приведенных выше источников): |
|
Хлористый азот, трихлорид азота, NCl3 представляет собой темно-желтое летучее масло с удельным весом 1,65, с резким запахом. Хлористый азот сильно действует на слизистую оболочку глаз и носа. Это соединение чрезвычайно бурно взрывается при нагревании до 93°С или при соприкосновении с веществами, способными хлорироваться, например, со скипидаром, каучуком. Хлористый азот можно хранить в сероуглероде, бензоле, эфире, хлороформе или четыреххлористом углероде без доступа воздуха. С аммиаком реакция идет по уравнению:
NCl3 + 4NH3 = N2 + 3NH4Cl.
Водой хлористый азот медленно гидролизуется: NCl3 + 3HOH = NH3 + 3ClOH
Хлористый азот получают либо используя обратимость этой реакции при действии гипохлорита на водные растворы аммиака или аммонийных солей, либо (для демонстрационных целей) производя электролиз насыщенного раствора хлорида аммония под слоем скипидара, чтобы капли взрывчатого хлористого азота, поднимаясь на поверхность, тотчас же взрывались и не могли накапливаться в значительном количестве. |
|
Учитывая большую взрывную силу хлористого азота, можно было бы предположить, что данное вещество найдет применение во взрывном деле. Нестабильность и летучесть хлористого азота являются здесь очень неблагоприятными факторами, но вспомните, что Альфред Нобель смог "обуздать" нитроглицерин. Нобель разработал сравнительно безопасные способы получения нитроглицерина и работы с ним - до этого данное вещество пользовалось весьма дурной славой. Возможно, что-то аналогичное удалось сделать и с хлористым азотом? Оказывается - да, однако это не помогло NCl3 найти практическое применение.
В книге Л. Веннен, Э. Бюрло, А. Лекорше Пороха и взрывчатые вещества (1936 г), С. 260-261 есть упоминание о попытке практического использования хлористого азота в качестве взрывчатого вещества. |
|
Очень нестойкое эндотермическое соединение, чрезвычайно сильно детонирующее при ударе, трении или нагревании до 100°C, представляет собой жидкость, для которой очень трудно найти какое-либо практическое применение.
Было предложено использовать способность хлористого аммония разлагаться под действием электрического тока, снаряжая им специальные электрические патроны (Tomasi,1899). Образующаяся при этом смесь NCI3 и сжатых газообразных продуктов реакции представляет собою взрывчатое вещество, способное дать практически полезный эффект. Несмотря однако на большую силу детонации потенциальная энергия хлористого азота настолько мала, что с помощью его нельзя получить более или менее значительной работы. Поэтому патроны Томаси (Tomasi), помимо затруднений в пользовании ими, не могли найти себе никакого практического применения. |
|
В книге Бубнов П.Ф. Инициирующие взрывчатые вещества и средства инициирования (1940) С. 319 есть краткое описание свойств хлористого азота, которое практически дублирует источники, цитируемые выше.
|
|
Хлористый азот был открыт в 1812 г. Дюлонгом. Приготовляется он действием хлора на концентрированный водный раствор хлористого аммония.
Хлористый азот представляет собой маслянистую жидкость тёмно-жёлтого цвета с сильным запахом хлора, уд. веса 1,653. Хлористый азот растворяется в бензоле и других органических растворителях. Это эндотермическое соединение, взрывающееся не только под влиянием удара, но и от действия различных веществ: фосфора, мышьяка, селена, различных смол, жиров и других органических веществ, вернее всех веществ, на которые он может оказать хлорирующее действие. При температуре 93° пары хлористого азота легко взрывают. Дюлонг при открытии хлористого азота из-за взрыва этого вещества потерял глаз и три пальца. Дэви и Фарадей были серьёзно ранены при исследовании NCI3. Наряду с этим NCI3 является ядовитым веществом. |
|
Интересный эксперимент с хлористым азотом описан в книге
Андреев К.К. Термическое разложение и горение взрывчатых веществ (1966).
|
|
Очень своеобразно, не при нагревании, а при охлаждении, возникает в результате самовоспламенения паров вспышка жидкого хлористого азота. Верхний конец запаянной трубочки с хлористым азотом находился при комнатной температуре, нижний был погружен в охлаждающую смесь. Когда температура жидкости снижалась до минус 25°С, происходил взрыв. Механизм возникновения этого взрыва, согласно Апину, следующий. Для паров хлористого азота, вследствие цепного механизма его разложения, существует верхний предел давления, ниже которого даже при комнатной температуре происходит их самовоспламенение. При охлаждении жидкого хлористого азота давление паров над ним понижается, и когда достигается верхний предел, пары воспламеняются, вызывая воспламенение и обычно взрыв жидкости.
|
|
Какие можно сделать выводы?
Хлористый азот относится веществам, которые просто получить, но с которыми очень трудно работать.
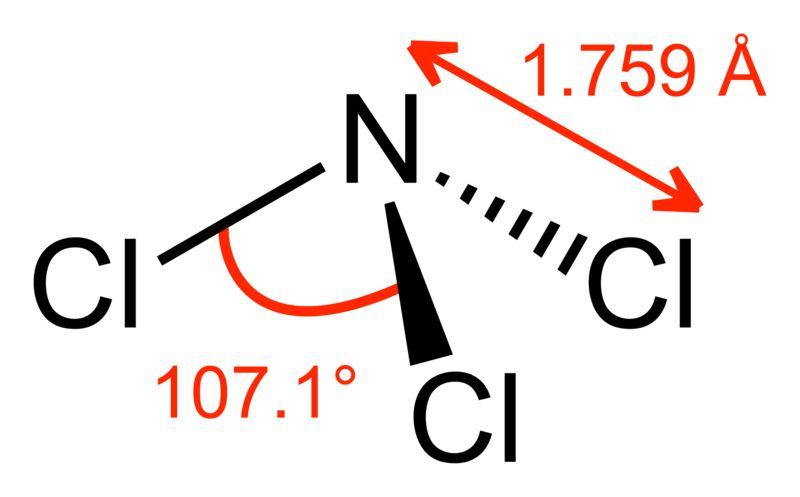
Во-первых, вещество очень легко взрывается: для этого достаточно удара, сотрясения, контакта с целым рядом других веществ (не только восстановителей) или яркого света. От взрыва хлористого азота стеклянная посуда разлетается, осколки могут серьезно ранить экспериментатора и зрителей (особая опасность для глаз!). Логично было бы использовать посуду из прозрачного пластика, но забегая наперед, скажем, что по поверхности такой посуды капли хлористого азота растекаются, что сильно усложняет работу. Если иодистый азот и многие азиды практически безопасны во влажном состоянии, то присутствие воды совсем не убережет от взрыва хлористого азота (более того, если капли взорвутся в колбе под водой, такой взрыв будет гораздо опаснее, чем просто в пустой колбе). Хлористый азот не только взрывчат, но еще летуч, ядовит, обладает неприятным запахом и слезоточивым действием. К чему может привести летучесть взрывчатого вещества можно проиллюстрировать на примере перекиси ацетона. Данное вещество легко испаряется и способно конденсироваться, образуя кристаллы на витках резьбы пробки, неплотностях шлифа и т.п. При попытке открыть бутылочку эти кристаллы разрушаются, и вся масса перекиси ацетона детонирует у вас в руках. В отличие от перекиси ацетона хлористый азот не образует кристаллов при комнатной температуре, но его пары способны легко взрываться. Таким образом, "крутой нрав" и отсутствие явной возможности получить из данного вещества практическую пользу привели к тому, что и в наши дни хлористый азот сравнительно мало изучен. Разумеется, наука не стоит на месте. Например, установлено, что подобно молекуле аммиака, молекула NCl3 имеет пирамидальное строение. Расстояние N-Cl составляет 1.76 A, валентный угол Cl-N-Cl равен 107°. Однако, многие сведения о хлористом азоте берутся из довольно старых источников и перекочевывают из книги в книгу [4]. ___________________________________________________ 4 Несмотря на то, что по совокупности свойств хлористый азот выглядит неким "химическим курьезом", существует область, в которой к этому веществу относятся вполне серьезно - хлорное производство. Образование и последующее растворение хлористого азота в сжиженном хлоре возможно, например, при загрязнении рассола хлорида натрия аммиаком (солями аммония) или при попадании таких загрязнителей в хлорную аппаратуру. Известны случаи взрывов, происходивших при накоплении хлористого азота в хлорных трубопроводах и резервуарах. На хлорном производстве выполняют контроль сырья на возможное загрязнение аммиаком (солями аммония). Также принимают меры, исключающие накопление в аппаратуре высококипящей фракции, которая может содержать хлористый азот. О возможности образования хлористого азота следует помнить и при работе в лаборатории, в случаях, когда возможен контакт хлора, гипохлоритов и других подобных веществ с солями аммония ( - прим. чит.). |
Структура молекулы хлористого азота |