Chemistry and Chemists № 1 2024
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 1 2024 Journal of Chemists-Enthusiasts |
Lake water, potassium permanganate and sulfuric acid V.M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Lake water, potassium permanganate and sulfuric acid
Potassium permanganate, KMnO4 is an important chemical compound with a wide range of industrial, medical and scientific applications. I would not use the term "the blood of chemistry" as the authors of one famous German book for young chemists did when they wrote about sulfuric acid; however, potassium permanganate has many significant applications in laboratory practice, medicine and industry. First of all, it is used as an oxidizing agent. For example, toluene is oxidized by permanganate in an acidic medium to form benzoic acid. Now, this reaction has no practical value, but similar reactions are widely used in organic synthesis. Moreover, potassium permanganate, being an ionic compound, dissolves in water but does not dissolve in non-polar (weakly polar) organic solvents. This difficulty was overcome by using the crown ether (18-Crown-6), which forms a complex with the potassium ion, making it possible to dissolve potassium permanganate in such non-polar solvents as benzene. As a result, "purple benzene" was obtained - a new oxidizing agent for organic synthesis. Similar to permanganate, other inorganic potassium salts also can be dissolved in non-polar organic solvents.
Озерная вода, перманганат калия и серная кислота 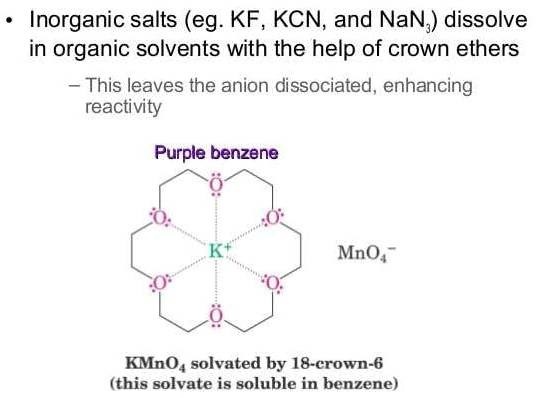

Purple benzene: a - KMnO4 does not dissolve in benzene; b - 18-Crown-6 was added The oxidizing properties of permanganate are due to Mn(VII). Depending on conditions, Mn(VII) can be reduced to Mn(II), Mn(III), Mn(VI), Mn(V) and Mn(VI). A significant area of application of potassium permanganate is medicine. The substance is an effective, low-toxic and cheap antiseptic. Diluted solutions of potassium permanganate are widely used for skin conditions, gargling, washing wounds, and treating burns. During my childhood, potassium permanganate was freely sold in pharmacies and was one of the common substances used in experiments by young chemists. There are many interesting chemical experiments you can do with potassium permanganate. First of all, potassium permanganate is a very strong oxidizing agent; it may also serve as a source of gaseous oxygen and be used as a starting compound for the preparation of other manganese compounds. Almost black crystals were inside the pharmacy bottles labelled "Potassium Permanganate". When dissolved in water, these crystals formed a pink, purple or black solution (depending on the concentration). Most organic compounds undergo oxidation when a permanganate solution is added to a solution containing organic compounds (such as glycerol, glucose, and acetic acid). Meanwhile, the permanganate itself is reduced to form hydrated manganese dioxide, MnO2·nH2O. Consequently, the initially pink or purple solution transitions into a brown suspension. In addition to organic compounds, potassium permanganate oxidizes some inorganic compounds, such as hydrogen peroxide, sodium sulfite, and ferrous iron (Fe2+) salts etc. For example, when hydrogen peroxide is added to a solution of potassium permanganate, the brown suspension of manganese dioxide forms; at the same time, oxygen releases rapidly. By the way, manganese dioxide, produced in the reaction, catalyzes the decomposition of hydrogen peroxide. I will describe the first chemical experiment in my life (at that time, I was ten years old). I added ethyl alcohol and a "bluing" ("laundry blue") [1] to solid potassium permanganate. As a result, the mixture suddenly became hot, a fountain of white steam rose, and the smell of apples appeared. At the same time, a loud knock was heard! When I tried to repeat the experiment, everything repeated except for the knocking. It turned out that this sound had nothing to do with my experiment. The reason for this "acoustic effect" was entirely different: a woodpecker was nearby knocking (I experimented in a forest). But the heating, the flow of steam and the smell of apples repeated stably. Now I know that potassium permanganate oxidized ethyl alcohol to acetaldehyde (partially to acetic acid, partially to carbon dioxide and water). The apple smell was caused by acetaldehyde. Among the three components mentioned above (potassium permanganate, alcohol and bluing), bluing was superfluous. I understood this even then (being a child, not burdened with knowledge). Once, I left the reaction mixture in the bottle because I was too lazy to wash it. The mixture dried, and I saw that the particles of bluing did not change during the experiment (in any way). In other words, it is enough to mix ethyl alcohol and solid potassium permanganate to observe the described transformation. A little later, I read about another similar experiment, we call it "Scheele's Volcano" [2], [3]. Much later, I carried out this experiment. At that point, I was no longer ten but thirty-seven years old. I will describe the experiment. Begin by placing a heap of potassium permanganate on a fire-resistant surface. Create a depression resembling a "volcanic crater" at the top of the "mountain". Carefully drop a few drops of pure glycerol (NOT diluted with water) into the crater. After about a minute has passed, the "volcano" begins to "erupt": the glycerol "boils", and a fountain of white smoke is emitted, then the mixture ignites. The spectacle strikingly resembles the eruption of a real volcano.
Unfortunately, potassium permanganate does not just oxidize organic compounds in solution; it can also oxidize compounds on the surfaces of your skin, furniture, clothes, shoes, sink, floor, and other objects. During experiments, the solution or solid particles of permanganate can inadvertently fall onto surrounding items, leaving persistent brown stains that are challenging to remove. Neither soap nor prolonged rubbing proved effective in removing these stains. While stained hands might not have been a significant issue, I faced problems with adults due to the brown marks on my clothes, the sink, and the furniture. In chemistry experiment books, manganese is rightly called the "chemical chameleon". Potassium permanganate has a pink or purple colour in solution. When permanganate reacts with reducing agents, the solution colour can change like the skin of a chameleon. In a neutral solution, potassium permanganate reacts with reducing agents, turning into a brown suspension of manganese dioxide MnO2·nH2O. In a strongly acidic medium, permanganate reduces to the divalent manganese cation Mn2+, which has a faint pink colour (dilute solutions are almost colourless). In a strongly alkaline solution, the permanganate reduces to the manganate anion MnO42-, which is coloured green (it is advisable to add a lack of reducing agent; otherwise, MnO2·nH2O is also formed). Manganese is not the only element that claims to be a "chemical chameleon"; vanadium and chromium have similar properties (of course, the colours and formulas of the compounds are different). During my school days, potassium permanganate was the most readily available compound for obtaining oxygen gas, enabling everyone to conduct experiments with oxygen. A simple method involved heating potassium permanganate in a test tube with a gas outlet tube to collect oxygen in a vessel by air displacement (as oxygen is slightly denser than air). Of course, potassium permanganate releases oxygen not only when heated in a test tube but also during the combustion of pyrotechnic mixtures. For instance, a mixture of permanganate and aluminium powder flares brightly, and when ignited in a closed vessel, this mixture explodes. However, I will abstain from discussing pyrotechnics and mention a single experiment only. Drop a few drops of flammable liquid onto a pile of potassium permanganate and set it on fire. As a result, the potassium permanganate begins to decompose, and this process is accompanied by burning (despite the absence of any reducing agents). When I was studying at the university, I first heard how to wash stains left by potassium permanganate. The lecture was on organic chemistry. When the teacher talked about safety precautions in the laboratory, he mentioned the treatment method for thermal skin burns. Immediately after you burn your hand, the burned area should be immersed in a black solution of potassium permanganate. This will not save the skin, but blisters will not form. The issue is that after permanganate, the skin turns brown. The teacher said that this is not a problem. Sulfite or thiosulfate effectively removes the brown stain without a trace. What is happening? I understood immediately. The science behind it is straightforward. Under acidic conditions, these compounds reduce brown manganese dioxide to divalent manganese salts (which are almost colourless, soluble and easily washed off with water). On my own, I will add that citric or oxalic acid or an acidic solution of hydrogen peroxide must also help. It is not surprising that potassium permanganate has been practically banned in our country. This is a compound of great importance. Our government constantly "takes care" of honest people and does everything possible to prevent their lives from seeming too good. This is especially true for chemists. The formal reason for the ban was the fight against illegal drug production, which is a lie. In our country, potassium permanganate was not used for this purpose - unlike sunny Colombia and other regions with endless coca bush (Erythroxylum coca / Amazonian coca) plantations. During a discussion of the article, a colleague told me that potassium permanganate is not universally banned. Its ban does not occur in many countries. And it pleases. 
Coca leaf cultivation in Colombia I used most of my supply of potassium permanganate, which was left over from the old days, for experiments with chlorine gas. Chlorine is released when hydrochloric acid reacts with potassium permanganate. But there was still some permanganate. The compound was in medicine bottles that I kept from childhood. Several years have passed since my last experiment with potassium permanganate. It would be nice to continue these experiments... A few months ago, I experimented with lake water [4]. When I left the water at room temperature, flakes formed in the bottle. I thought it was a "water bloom" (an algae bloom) - the rapid proliferation of microscopic algae and other microorganisms. If the assumption had been correct, I could have observed this process I placed a 5-litre jar with water from the lake near the window. At first, the water was greenish-yellow and cloudy. A day later, flakes formed in the vessel and precipitated to the bottom. After two days, it became noticeable that the precipitate turned green (algae growth was observed), but that was where the changes ended. More than a month passed, and the water remained unchanged. The jar contained a yellow solution (without turbidity). There was originally a green sediment at the bottom, which has now turned brown. In other words, the microorganisms "changed their mind" about growing. So, I drained the yellow water from the precipitate to conduct another experiment with lake water. In past experiments, I have treated water with salts of iron, aluminium and copper (coagulating agents), alkalis and acids. To complete the picture, I can add an oxidizing agent to the lake water, for example, sodium hypochlorite. However, hypochlorite is colourless, so it is better to use potassium permanganate for this goal. After all, we are not just conducting a chemical experiment - it must be visual. I dissolved 0.1 g of potassium permanganate in 11 ml of distilled water. A black solution formed (later, it turned out that not all the permanganate dissolved - the crystals remained at the bottom, but this does not matter). I poured 4 litres of the lake water from the jar into another one (so that no precipitate got into the vessel). Let me remind you that this water stood in the room for more than a month. The water was yellow, and there was no turbidity observed. I added a permanganate solution to the water. The purple (pink-violet) solution sank to the bottom, forming beautiful patterns. I stirred the liquid. The colour of the solution gradually began to change. Initially, the reaction mixture was purple and then a red tint became noticeable. The red shade intensified over time, resulting in the solution becoming red. After this, the colour changes continued. The solution began to acquire a yellow tint. I left the reaction mixture overnight. By morning, the solution turned brown and brown flakes of manganese dioxide formed. After 24 hours (from the start of the experiment), the solution was yellow, and there was a brown precipitate of manganese dioxide at the bottom. Potassium permanganate oxidizes organic compounds that are dissolved in water. Under neutral conditions, the permanganate anion is reduced to form manganese dioxide. I vividly recall the difficulties of cleaning laboratory glassware after experiments with potassium permanganate in a neutral solution. What a nightmare! Therefore, I decided to carry out this process chemically. So, I should use an acid and a reducing agent to turn the manganese dioxide into a divalent manganese salt. I added 2 ml of concentrated sulfuric acid to the yellow liquid with a brown precipitate. The heavier acid sank to the bottom, and some of the brown flakes rose from the bottom. I stirred the mixture. The flakes floated (formed a suspension), but visible chemical changes were not observed. I added a reducing agent, about 1 ml of 30% hydrogen peroxide solution, and then stirred the reaction mixture. I expected oxygen to be released but did not notice any gas formation. On the other hand, the brown flakes dissolved, and the solution became transparent and colourless. The manganese dioxide particles, which stuck to the bottom and walls of the jar, were the last to dissolve. Manganese dioxide reacted with hydrogen peroxide and sulfuric acid to form divalent manganese sulfate, which is almost colourless in a dilute solution. As a result, the walls of the jar became clean. The jar contained a clear and colourless solution. Outwardly, it resembled clean water. In conclusion, a few words about the potassium permanganate application in analytical chemistry. Potassium permanganate solution is used to determine a number of compounds by titration. For example, I titrated ferrous iron with potassium permanganate when analyzing synthesized phosphates (they were substitutional solid solutions in which iron atoms replaced some zinc atoms). Unfortunately, permanganate gradually decomposes in solution during storage (the concentration of permanganate decreases, which affects the analysis result). To slow down the permanganate decomposition, the flask with the solution should be wrapped with black paper. Now, let us touch on the topic of water quality. There is an indicator that characterizes the contamination of water with organic compounds. This applies to surface natural waters, groundwater, and wastewater. The value is called "chemical oxygen demand", COD, which characterizes the amount of oxygen (mg/L) required to oxidize all organic substances in water to carbon dioxide and water. How is COD determined? There are several ways. The main is the bichromate method. Excess potassium dichromate and sulfuric acid are added to water, and the mixture is heated. Potassium dichromate oxidizes organic compounds, after which the excess of dichromate is titrated with Mohr's salt. There is an alternative method for determining COD - the permanganate method. In this method, organic compounds are oxidized with potassium permanganate. This method is more accurate (than the dichromate method), but it is applicable if the organic content is not too high. The oxidation of organic compounds dissolved in water with potassium permanganate is also used for determining water isotope compositions, namely the content of deuterium and tritium. Potassium permanganate is added to the water sample, after which the water is distilled. Permanganate oxidizes dissolved organic compounds to water and carbon dioxide. Therefore, all hydrogen atoms of the organic molecules are converted into water. As you can see, our simple experiment with potassium permanganate and natural water simulates essential practical processes. I have witnessed and performed chemical transformations thousands of times. Despite thirty-seven years having passed since my first chemical experiment, the feeling of observing something magical has never left me. __________________________________________________ 1 "Bluing" ("laundry blue") is a product that was added during the washing of textiles (in particular, white fabrics) in the past. It has an intense blue colour. The blue colour makes yellow stains on white fabric invisible (blue and yellow are complementary colours). As a result, the cloth appears to be a perfect white colour. Bluing was actively used when I was a child. Mostly, it was ultramarine powder (as in the described case) or a solution of methylene blue. Before I was born, Prussian blue was also used. Now, substances that give a similar effect (optical brighteners) are added to laundry detergents. 2 See the photos and the videos of the "volcano" in the articles Вулкан Шееле [link]; Вулкан Шееле ч.2 [link]; Вулкан Шееле (воспламенение глицерина при контакте с перманганатом калия) [link]. 3 Carl Wilhelm Scheele was an outstanding Swedish and German chemist of the 18th century. For the first time, he obtained glycerol and mixed it with permanganate. The mixture ignited. I have not seen the name "Scheele's Volcano" in English-language literature (but this name is used in my native language). The scientist made many important discoveries. In particular, Karl Scheele obtained oxygen for the first time; however, he was late publishing his work due to the publisher's fault (the English chemist Joseph Priestley published similar results first). In turn, Priestley's priority was challenged by the French chemist Antoine Lavoisier, who learned about Priestley's work from the author himself and repeated his experiments. Lavoisier repeated Priestley's experiments and then moved on. Lavoisier established that Priestley and Scheele obtained not a "new type of air" but a new chemical element, oxygen. As a result, Lavoisier took credit for the discovery of oxygen. The dispute about the priority of the discovery of oxygen dragged on for years. Unfortunately, the relationship between different scientists is often like the interaction between a cat and a dog (a typical antagonistic relationship). Sometimes, conflicts arise between various laboratories, universities, and research institutes. Science is a quarrelsome world (not a peaceful one).  For example, a scientist did his research honestly for many years; he worked hard and got universal recognition. Then, another researcher proved that all the work of the first scientist was wrong. The described situation often leads to personal offensives and conflicts. The person who made the scientific discovery is not significant to science. The way that led to the discovery is insignificant to science. But all these do matter to people of science. Unfortunately. 4 See the article Natural water and chemical reagents (demonstration model of water treatment process) [link]. 5 Regrettably, numerous restrictions on important compounds seem extreme and nonsensical in our country. While I acknowledge that this is my viewpoint, it is one shared by many of my colleagues. |

The Lake water |

|

|

|

|

|

|

|

The dissolving of potassium permanganate |

|

|

|

|

|

|

|

The lake water and potassium permanganate |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

Concentrated sulfuric acid is being added |

|

|

|

|

|

Hydrogen peroxide is being added |

|

|

|

|

|

|

|
|
Озерная вода, перманганат калия и серная кислота
Перманганат калия, KMnO4 - исключительно важное и полезное вещество. Я бы не стал употреблять термин "кровь химии", как это сделали авторы одного известного немецкого практикума для юных химиков, когда речь шла о серной кислоте, тем не менее, перманганат калия имеет много важных применений в лабораторной практике и промышленности. Прежде всего, он используется в качестве окислителя. Например, толуол окисляется перманганатом в кислой среде до бензойной кислоты. Данная реакция не имеет сейчас практической ценности, зато аналогичные реакции широко используются в органическом синтезе. Более того, перманганат калия, будучи ионным соединением, растворяется в воде, но не растворяется в неполярных (слабо полярных) органических растворителях. Эту трудность можно обойти с помощью краун-эфира (18-Crown-6), который образует комплекс с ионом калия, благодаря чему удалось растворить перманганат калия в таких неполярных растворителях как бензол. В результате появился "малиновый бензол" - новый окислительный реагент для органического синтеза. Аналогично перманганату можно растворить в неполярных органических растворителях и другие неорганические соли калия. Перманганат калия широко используется в аналитической химии (о чем будет сказано ниже). Окислительные свойства перманганата обусловлены наличием Mn(VII). В зависимости от условий, Mn(VII) может восстанавливаться до Mn(II), Mn(III), Mn(VI), Mn(V) и Mn(VI). Важнейшая область применения перманганата калия - медицина. Вещество применяется как эффективный, малотоксичный и дешевый антисептик. В частности, используется разбавленные растворы перманганат калия при кожных заболеваниях, для полоскания горла, промывки ран, при лечении ожогов. Во времена моего детства перманганат калия свободно продавался в аптеках и был одним из основных веществ, которые использовали в экспериментах юные химики. "Неофициальное" название данного вещества - "марганцовка". С перманганатом калия можно проделать много интересных химических экспериментов. Прежде всего, перманганат калия - хороший окислитель, также он может служить источником газообразного кислорода и исходным веществом для получения других соединений марганца. Внутри аптечных бутылочек с надписью "Перманганат калия" были почти черные кристаллы, которые, растворяясь в воде, образовывали розовый, пурпурный или черный раствор (это зависит от концентрации). Если добавить раствор перманганата к раствору, который содержит органические вещества (например, глицерин, глюкоза, уксусная кислота), многие органические вещества окисляются, а сам перманганат при этом восстанавливается до гидратированного диоксида марганца MnO2·nH2O. В результате розовый или фиолетовый раствор переходит в бурую суспензию. Кроме органических веществ перманганат калия окисляет также некоторые неорганические вещества, в частности, перекись водорода, сульфит натрия, соли двухвалентного железа. Например, если к раствору перманганата калия добавить перекись водорода, образуется упомянутая выше коричневая суспензия диоксида марганца, одновременно будет наблюдаться бурное выделение кислорода. Кстати, диоксид марганца, который образовался в реакции, служит катализатором разложения перекиси водорода. Опишу мой первый в жизни химический эксперимент (тогда мне было лет 10). К твердому перманганату калия я добавил этиловый спирт и "синьку" [1]. В результате смесь неожиданно стала горячей, образовался фонтан белого пара, стал ощутим запах яблок. Одновременно послышался сильный стук! Когда я попробовал воспроизвести эксперимент - все повторилось, за исключением стука. Оказалось, что этот звук не имел отношения к опыту. Причина "акустических эффектов" была совершенно другая - поблизости стучал дятел (эксперимент я делал в лесу). Зато разогрев, поток пара и запах яблок повторялись стабильно. Сейчас я знаю, что перманганат калия окислял этиловый спирт до уксусного альдегида (частично - до уксусной кислоты, частично - до углекислого газа и воды). Яблочный запах вызван образованием уксусного альдегида. Среди приведенных трех компонентов (перманганат калия, спирт и синька) синька была лишней. Это я понял еще тогда (будучи ребенком, не отягощенным знаниями). Один раз я оставил реакционную смесь в бутылке, поленившись ее мыть. Смесь высохла, и я увидел, что частички синьки никак не изменились в ходе эксперимента. Другими словами, чтобы наблюдать описанное превращение, достаточно добавить этиловый спирт к твердому перманганату калия и перемешать вещества. Немного позже я прочитал про другой аналогичный эксперимент, который у нас называли "вулкан Шееле" [2], [3]. Намного позже я этот эксперимент осуществил. К тому времени мне было уже не 10, а 37 лет. Приведу описание эксперимента. На огнестойкую поверхность насыпаем горку перманганата калия. В вершине "горы" делаем углубление - "кратер вулкана". Капаем в кратер несколько капель чистого глицерина (НЕ разведенного водой). Проходит около минуты времени и... И вулкан начинает "извергаться": глицерин вскипает, появляется фонтан белого дыма, после чего смесь воспламеняется. Это действительно напоминает извержение настоящего вулкана. К сожалению, перманганат калия окисляет органические вещества не только в растворе, но и на поверхности вашей кожи, мебели, одежды, обуви, раковины и т.д. Во время экспериментов на окружающие предметы попадают капли раствора или твердые частички перманганата. В результате появляются коричневые пятна, которые трудно отмыть. Ни мыло, ни длительное потирание не помогали. Приходилось ходить с грязными руками - это было не страшно, зато из-за испачканной одежды и мебели возникали проблемы со взрослыми. В практикумах по химии марганец по праву называют "химический хамелеон". Перманганат калия имеет розовую или фиолетовую окраску в растворе. Когда перманганат реагирует с веществами-восстановителями, окраска раствора может меняться подобно коже хамелеона. В нейтральной среде перманганат калия реагирует с восстановителями, переходя в коричневую суспензию диоксида марганца MnO2·nH2O. В сильнокислой среде перманганат восстанавливается до катиона двухвалентного марганца Mn2+, который имеет слабо-розовую окраску (разбавленные растворы практически бесцветны). А в сильнощелочной среде перманганат восстанавливается до аниона манганата MnO42-, окрашенного в зеленый цвет (желательно добавлять недостаток восстановителя, иначе тоже образуется MnO2·nH2O). Марганец не единственный элемент, который претендует на титул "химического хамелеона", ванадий и хром обладают аналогичными свойствами (цвета и формулы соединений, разумеется, другие). Когда я учился в школе, перманганат калия был самым доступным веществом, из которого можно получить газообразный кислород, а затем провести с ним эксперименты. Достаточно было нагреть перманганат калия в пробирке с газоотводной трубкой и собрать кислород в сосуде методом вытеснения воздуха (плотность газообразного кислорода немного больше, чем плотность воздуха). Разумеется, перманганат калия выделяет кислород не только при нагревании в пробирке, но и в процессе горения пиротехнических смесей. Например, смесь перманганата с алюминиевой пудрой ярко вспыхивает, а в закрытых сосудах - взрывается. Но пиротехники я сейчас касаться не буду. Упомяну только, что если на кучку перманганата калия капнуть несколько капель горючей жидкости и поджечь, то сам перманганат калия начинает разлагаться со вспышкой (даже при отсутствии восстановителей). Уже когда учился в университете, я впервые услышал, как отмыть пятна, которые оставляет перманганат калия. Лекция была по органической химии. Когда преподаватель рассказывал о технике безопасности в лаборатории, он упомянул способ борьбы с термическими ожогами кожи. Точнее - с их последствиями. Сразу же после того, как вы обожгли руку, обожженное место следует опустить в черный раствор перманганата калия. Кожу это не спасет, зато волдыри не образуются. Проблема в том, что после перманганата кожа приобретает коричневый цвет. Преподаватель сказал, что это - не проблема. Помогает сульфит или тиосульфат - коричневое загрязнение исчезает без следа. В чем дело - я понял сразу. Указанные вещества в кислой среде восстанавливают коричневый диоксид марганца до солей двухвалентного марганца (которые почти бесцветны, растворимы и легко смываются водой). От себя добавлю, что должны также помочь лимонная или щавелевая кислота или подкисленный раствор перекиси водорода. Не удивительно, что такое замечательное вещество как перманганат калия запретили в нашей стране. "Родное" правительство неустанно заботится, чтобы жизнь честных людей не казалась слишком хорошей, в частности, это касается химиков. Поводом для запрета стала борьба с нелегальным изготовлением наркотиков, что является ложью. Именно в нашей стране перманганат калия с этой целью не использовали - в отличие от солнечной Колумбии с ее бескрайними плантациями куста коки (Erythroxylum coca / Amazonian coca). Во время обсуждения статьи коллега подсказал, что печальная ситуация с запретом перманганата калия имеет место далеко не во всех странах. И это радует. Со времен моего детства много необходимых химикам веществ успели запретить, например, соляную и серную кислоты. По сути, их приравняли к сильнодействующим наркотикам. С точки зрения местных законов килограмм серной кислоты и килограмм героина - одно и тоже. Я, конечно, утрирую, но проблема стоит остро: работа химических лабораторий и химической промышленности саботируется "родным" правительством. Когда-то серная и соляная кислоты свободно продавались в магазинах товаров для дома. Перманганат калия беспрепятственно продавался в аптеках. Большую часть своих запасов перманганата калия, которая осталась от старых времен, я использовал для экспериментов с газообразным хлором. Хлор выделяется при реакции соляной кислоты с перманганатом калия. Но немного перманганата еще было. Он находился в аптечных бутылочках, которые я сохранил с детских времен. Прошло уже несколько лет после моего последнего эксперимента с перманганатом калия. Неплохо бы эти эксперименты продолжить... Несколько месяцев назад я делал эксперименты с озерной водой [4]. Один раз, когда я оставил воду стоять при комнатной температуре, в ней образовались хлопья. Я решил, что причиной является "цветение воды" - быстрое размножение микроскопических водорослей и других микроорганизмов. Раз так, то почему бы не проследить за этим процессом Набрал 5-л банку воды из озера, поставил возле окна. Вначале вода была зеленовато-желтой, мутной. Через день в ней образовались хлопья, которые осели на дно. Через два дня стало заметно, что осадок стал зеленым (наблюдался рост водорослей), но на этом изменения и закончились. Прошло больше месяца, а вода была без изменений. В банке был желтый раствор (без мути). На дне первоначально находился зеленый осадок, который теперь стал коричневым. Другими словами, микроорганизмы "передумали" расти. Раз так, я слил желтую воду с осадка и решил провести с водой еще один эксперимент. В прошлых экспериментах я действовал на воду солями железа, алюминия и меди (коагулирующие агенты), а также щелочами и кислотами. Для полноты картины можно добавить к озерной воде окислительный реагент, например, гипохлорит натрия. Но гипохлорит бесцветный, поэтому для этой цели лучше использовать перманганат калия. Ведь мы не просто проводим химический эксперимент, а демонстрационный химический эксперимент - он должен быть наглядным. Взял 0.1 г перманганата калия, растворил в 11 мл дистиллированной воды. Образовался черный раствор (потом выяснилось, что не весь перманганат растворился - на дне остались кристаллы, но это не имеет значения). Перелил 4 л озерной воды из этой банки в другую (так, чтобы осадок не попал в банку). Напомню, эта вода простояла в комнате больше месяца. Вода имела желтый цвет, мути не наблюдалось. Добавил к воде раствор перманганата. Пурпурный (розово-фиолетовый) раствор опускался на дно, образовывая красивые узоры. Перемешал жидкость. Цвет раствор начал постепенно меняться. Первоначально раствор был пурпурный, но потом стал заметен красный оттенок. Красный оттенок усиливался со временем, в результате раствор стал красным. После этого изменение цвета продолжились. Раствор стал приобретать желтый оттенок. Оставил реакционную смесь на ночь. К утру раствор стал коричневым, образовались бурые хлопья диоксида марганца. Через 24 часа (после начала эксперимента) раствор был желтым, на дне был коричневый осадок диоксида марганца. Перманганат калия окислил органические вещества, растворенные в воде. При этом анион перманганата перешел в диоксид марганца. Я хорошо помнил, как трудно отмыть лабораторную посуду после экспериментов с перманганатом калия в нейтральной среде. Какой кошмар! Поэтому решил провести этот процесс химическим способом. А именно: использовать кислоту и восстановитель, чтобы диоксид марганца перешел в соль двухвалентного марганца. К желтой жидкости с бурым осадком добавил 2 мл концентрированной серной кислоты. Более тяжелая кислота опустилась на дно, часть бурых хлопьев поднялось со дна. Перемешал раствор. Хлопья всплыли (образовали суспензию), но химических изменений заметно не было. Добавил восстановитель, а именно: около 1 мл 30% пергидроля (раствор перекиси водорода). Перемешал реакционную смесь. Я ожидал, что выделится кислород, но выделения газа не заметил. Зато... бурые хлопья растворились, раствор стал прозрачным и бесцветным. Последними растворились частицы диоксида марганца, которые пристали к дну и стенкам банки. Диоксид марганца прореагировал с перекисью водорода и серной кислотой с образованием сульфата двухвалентного марганца, который в разбавленном растворе практически бесцветный. В результате стенки банки стали чистыми. В банке был прозрачный и бесцветный раствор. Внешне он напоминал чистую воду. В заключение несколько слов о применении перманганата калия в аналитической химии. Раствор перманганата калия используется для определения ряда веществ методом титрования. Например, я титровал двухвалентное железо перманганатом калия, когда анализировал синтезированные фосфаты (твердые растворы, в которых атомы железа замещали часть атомов цинка). Недостатком перманганата является тот факт, что данное вещество постепенно разлагается в растворе при его хранении (концентрация перманганата уменьшается, что влияет на результат анализа). Чтобы замедлить разложение, колбу с раствором перманганата рекомендуют заворачивать в черную бумагу. Теперь коснемся темы качества воды. Существует показатель, который характеризует загрязненность воды органическими веществами. Это касается поверхностных природных вод, подземных вод, сточных вод. Показатель называется "химическое потребление кислорода", ХПК (chemical oxygen demand, COD), он характеризует количество кислорода (мг/л; mg/L), необходимое для окисления всех органических веществ в воде до углекислого газа и воды. Как определяют ХПК? Существует несколько способов. Основной метод - бихроматный. К воде добавляют избыток бихромата калия и серную кислоту, смесь нагревают. Бихромат калия окисляет органические вещества, после чего избыток бихромата титруют с помощью соли Мора. Существует и альтернативный метод определение ХПК - перманганатный метод. В этом методе органические вещества окисляют с помощью перманганата калия. Данный метод более точный (чем бихроматный метод), но он применим, если содержание органики является не слишком высоким. Окисление органических веществ, растворенных в воде, с помощью перманганата калия используют и в процессе определения изотопного анализа воды, а именно - содержания дейтерия и трития. К пробе воды добавляют перманганат калия, после чего воду перегоняют. Перманганат окисляет органические вещества и переводит изотопы водорода, которые в них содержатся, в воду. Как видите, наш простой эксперимент с перманганатом калия и природной водой моделирует важные для практики процессы. Я тысячи раз видел подобные химические превращения, причем не только видел - я их проводил. С момента моего первого химического эксперимента прошло уже 37 лет, но ощущение, что я наблюдаю что-то волшебное, не покидает меня до сих пор. __________________________________________________ 1 "Синька" - разговорное название продукта, который в прошлом добавляли при стирке текстиля. Имеет насыщенный синий цвет. Синий цвет делает незаметными желтые пятна на белой ткани (синий и желтый - дополнительные цвета). В результате ткань выглядит идеально белой. Синька активно использовалось для стирки, когда я был ребенком. В основном это был порошок ультрамарина (как в описанном случае) или раствор метиленового синего. До моего рождения также использовали берлинскую лазурь. Сейчас в стиральные порошки добавляют вещества, дающие аналогичный эффект (оптические отбеливатели). 2 See the photos and the videos of the "volcano" in the articles Вулкан Шееле [link]; Вулкан Шееле ч.2 [link]; Вулкан Шееле (воспламенение глицерина при контакте с перманганатом калия) [link]. 3 Карл Вильгельм Шееле / Carl Wilhelm Scheele выдающийся шведский и немецкий химик 18 века. Впервые получил глицерин и смешал его с перманганатом. Смесь воспламенилась. В англоязычной литературе названия "вулкан Шееле" я не встречал. Ученый совершил много важных открытий. В частности, Карл Шееле впервые получил кислород, хотя по вине издателя запоздал с публикацией работ (его опередил английский химик Джозеф Пристли). В свою очередь, приоритет Пристли оспаривал французский химик Антуан Лавуазье, который узнал о работах Пристли от самого автора и повторил его эксперименты. Повторил, а затем пошел дальше. Лавуазье установил, что Пристли и Шееле получили не "новый вид воздуха", а новый химический элемент - кислород. В результате Лавуазье приписал себе открытие кислорода. Спор относительно приоритета открытия кислорода затянулся на годы. К сожалению, отношения между разными учеными нередко напоминают отношения между кошкой и собакой (в их классической форме). Иногда конфликты на личной почве возникают между разными лабораториями, университетами, исследовательскими институтами. Наука - сварливый мир. Например, если ученый А доказал, что многолетние работы ученого В - ошибка, то дело редко обходится без личных обид и конфликтов. Особенно, если ученый В делал исследования честно и скрупулезно, он успел получить всеобщее признанные, а потом... А потом оказалось, что с таким же успехом исследователь В мог ничего не делать. Человек, сделавший научное открытие, не имеет значения для науки. Путь, который привел к открытию, не имеет значения для науки. Но все это имеет значение для людей науки. К сожалению. 4 See the article Natural water and chemical reagents (demonstration model of water treatment process) [link]. |