Chemistry and Chemists № 1 2024
Journal of Chemists-Enthusiasts
| Content | Chemistry experiments - video | Physics experiments - video | Home Page - Chemistry and Chemists |
|
Chemistry and Chemists № 1 2024 Journal of Chemists-Enthusiasts |
Vegetable oil, ethanol and water (formation of emulsion) - part 1, 2 V.M. Viter |
|
Having noticed a mistake in the text, allocate it and press Ctrl-Enter
Sunflower oil, ethanol and water (formation of emulsion) - part 1
The idea for this experiment arose from childhood memories. The events were many years ago. I often used cheap cologne as fuel to heat test tubes during chemistry experiments. The cologne served as a substitute for pure ethanol. Then, I noticed when I was mixing the cologne with water, a white emulsion was formed. Cologne contained substances soluble in alcohol but insoluble in water, so when the two liquids were mixed, an emulsion was formed (perhaps it was a suspension) [1].Подсолнечное масло, этанол и вода (образование эмульсии) - ч.1 A similar phenomenon occurred during the burning of cologne poured into a vessel. The alcohol burned away, but the water that was in the cologne remained. As a result, the alcohol concentration dropped, and an emulsion also formed. In the previous experiment, I accidentally discovered that the ethanol extract of horse chestnut seeds, when mixed with water, also produces an emulsion. I believe that ethanol dissolves some of the lipids (possibly other hydrophobic compounds) that are contained in the seeds. Then, when the alcohol solution is mixed with water, an emulsion is formed. Instead of using seeds for the experiment, you can use vegetable oil. For example, you can apply commonly available sunflower oil. First, add vegetable oil to the ethanol and shake the liquids. After separating the liquids, pipette a little of the alcohol layer and add this liquid to the water. If some sunflower oil has dissolved in alcohol, a cloudy emulsion will form; otherwise, a clear and colourless solution of alcohol in water occurs. I poured ethyl alcohol into a large test tube and began adding sunflower oil (unrefined) drop by drop. Drops of oil sank to the bottom, forming individual balls, which gradually merged into a continuous layer of liquid. I stirred the contents of the test tube with a glass rod. A white emulsion was formed: the oil dispersed into small droplets distributed throughout the volume of alcohol. This emulsion was unstable. After the mixing stopped, the oil droplets began to unite into larger ones and settle to the bottom. At the bottom, larger drops of sunflower oil gradually merged, forming a continuous layer of oil. The alcohol layer was no longer cloudy. To prevent the emulsion from breaking, it is necessary to add a special substance (emulsion stabilizer, also known as emulsifying agent), which forms a "shell" on the surface of small droplets, preventing the droplets from coalescence (merging). For example, surfactants can be used for this purpose. The tiny drops will stay in suspension due to the Brownian motion of liquid molecules (a continuous phase). However, the purpose of our experiment is different, so we will not stabilize the emulsion. On the contrary, the liquids must separate so that part of the upper layer (ethanol) can be pipetted. I repeated the mixing-separation operation several times, and then I proceeded to the main experiment. I poured 200 ml of distilled water into a beaker. Using a pipette, I took a few millilitres of the alcohol from the test tube (careful not to touch the oil layer). I added the alcohol to the water. A white emulsion formed. I stirred the liquid. The liquid became white and cloudy in the glass, although it remained partially transparent. Thus, a small part of the sunflower oil dissolved in ethyl alcohol. When this alcohol was poured into the water, the oil formed a fine emulsion. I passed a green laser beam through the obtained emulsion. A clear Tyndall effect was observed. This time, I tried to direct the beam not only perpendicular to the beaker-camera direction but also in the direction from the camera to the beaker. I also pointed the laser at the liquid at different angles. It turned out to be a small light show. Unlike the emulsion of sunflower oil in alcohol, this emulsion (oil in water) was quite stable and did not separate during the experiment. Fats and water can form difficult-to-break emulsions even with simple shaking. This does not always happen, but quite often. The fact is that the density of water is close to the density of various fats of plant and animal origin. For example, if you shake sunflower oil with water, most of the two liquids will quickly separate as soon as you stop the shaking. Water will be at the bottom, and the oil will float to the top. However, the water layer will become cloudy because tiny sunflower oil droplets will remain in this layer. The main experiment is over. I decided to conduct another experiment with these three liquids (sunflower oil, alcohol and water). The fact is that the density of sunflower oil is higher than the density of ethyl alcohol but less than the density of water. In this case, ethyl alcohol and water are mixed in any ratio. You can choose a ratio of ethyl alcohol and water in the solution to achieve the same density of the alcohol solution as the one of sunflower oil. In such a solution, the oil neither rises to the surface nor sinks to the bottom. The densities of the liquids are equal; therefore, the buoyancy is zero (according to Archimedes' principle). The oil will form droplets that can be at any point in the alcohol solution in equilibrium. In past experiments, I used three liquids for this purpose: carbon tetrachloride, water and cyclohexane; a colleague conducted experiments with ethyl alcohol, water and sunflower oil [2]. The last three liquids are identical to the ones I used in this experiment. On the one hand, there was no point in repeating the experiment with sunflower oil, which does not sink or rise to the surface in an alcohol solution. This experiment had already been done by a colleague. On the other hand, I ALREADY poured ethyl alcohol and sunflower oil into the test tube. All that remains is to add water in small portions and mix until the densities of the two liquids are equal (sunflower oil and an aqueous solution of alcohol). I did so. I started to add water to the test tube with ethyl alcohol and sunflower oil. A surprise occurred immediately: when one drop of water was added, the alcohol layer became cloudy! A white emulsion formed. I added more water and stirred the mixture. When standing, the liquids separated. There was a layer of sunflower oil at the bottom and an emulsion of oil in an aqueous solution of alcohol at the top. The emulsion was white and opaque; while the layer of oil did not change. This is explained by the fact that the alcohol in the test tube was not pure. As a result of mixing with sunflower oil, some components of sunflower oil dissolved in ethanol. One drop of water was enough for hydrophobic substances to leave the alcohol and form a distinct phase. In other words, the same phenomenon occurred as in the first part of the experiment (when alcohol was shaken with sunflower oil and then added to water). On the one hand, this is good: we obtained the oil emulsion in two different ways: add a solution of sunflower oil in alcohol to water; add water to a solution of sunflower oil in alcohol. Unfortunately, after adding water, the alcohol phase became cloudy, which interfered with the next experiment. The current task is to add enough water to the alcohol until the oil droplets neither sink nor rise in the solution. However, the alcohol solution became cloudy, making it difficult to observe the oil droplets in this solution. I continued adding water and stirring. For a long time, the density of the alcohol solution was lower than the density of sunflower oil, so the oil drops sank to the bottom. I realized my mistake: the density of sunflower oil is closer to the density of water than to the density of ethyl alcohol. Consequently, the solution must contain more water than alcohol. Therefore, I pipetted part of the alcohol solution from the test tube and continued to add water into the test tube. Finally, I reached a point where the drops of sunflower oil were distributed throughout the entire volume of the solution (they did not sink or rise). As I mentioned, the yellowish drops of oil were difficult to discern in the milky-white solution of alcohol in water. Therefore, I should not show such photos and videos as they lack visual clarity. This means I need to colour the sunflower oil. But what substance can I use? I did not want to use iodine, so I decided to use rhodamine for this purpose. Initially, a colleague told me that rhodamine is highly soluble in fats. However, this statement turned out to be incorrect. Nevertheless, it led to new and beautiful experiments, which will be discussed below. Once again, I tried to do one thing but got something completely different. __________________________________________________ 1 The mixing of water and cologne led to the formation of a new liquid phase, and this phase formed an emulsion. If the new phase is solid (not liquid), a suspension forms. Смешение воды и одеколона привело к формированию новой жидкой фазы, и эта фаза образовала эмульсию. Если новая фаза твердая (не жидкая), образуется суспензия. 2 See the article Solar system in jar (creation of world in seven minutes) / Солнечная система в банке (сотворение мира за семь минут) [link]. |

Sunflower oil, ethanol and water (formation of emulsion) |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
|
Растительное масло, этанол и вода (образование эмульсии)
Идея данного эксперимента возникла из детских воспоминаний. События имели место много лет назад. В качестве топлива для нагрева пробирок во время химических экспериментов я часто использовал дешевый одеколон. Одеколон служил заменителем чистого этанола. Тогда я заметил, что при смешивании одеколона с водой образуется белая эмульсия. Одеколон содержал вещества растворимые в спирте, но нерастворимые в воде, поэтому при смешивании двух жидкостей и образовывалась эмульсия (возможно, это была суспензия) [1]. Подсолнечное масло, этанол и вода (образование эмульсии) - ч.1 Аналогичное явление происходило и во время горения одеколона, налитого в какой-то сосуд. Спирт сгорал, а вода, которая была в одеколоне, оставалась. В результате концентрация спирта падала и также образовывалась эмульсия. В прошлом эксперименте я случайно обнаружил, что экстракт семян конского каштана в этаноле при смешивании с водой дает аналогичную эмульсию. Я считаю, что этанол растворяет часть липидов (возможно, и других гидрофобных веществ), которые содержатся в семенах. Потом при смешивании спиртового раствора с водой образуется эмульсия. Вместо того, чтобы использовать для эксперимента семена, можно взять растительное масло. Например, можно применить общедоступное подсолнечное масло. Сначала добавить в этанол растительное масло и встряхнуть жидкости. После разделения жидкостей отобрать немного спиртового слоя и добавить эту жидкость в воду. Если часть подсолнечного масла растворилась в спирте, возникнет мутная эмульсия; в противном случае образуется прозрачный и бесцветный раствор спирта в воде. В большую пробирку я налил этиловый спирт и стал по каплям добавлять подсолнечное масло (нерафинированное). Капли масла опустились на дно, образуя отдельные шарики, которые постепенно объединялись в сплошной слой жидкости. Перемешал содержимое пробирки стеклянной палочкой. Образовалась белая эмульсия: масло диспергировались на мелкие капельки, которые распределились по объему спирта. Данная эмульсия нестабильна. После прекращения перемешивания капельки масла стали объединяться в большие и оседать на дно. На дне более крупные капли подсолнечного масла постепенно слились, образовался сплошной слой масла. Слой спирта перестал быть мутным. Чтобы эмульсия не разрушалась, необходимо добавить специальные вещества (стабилизаторы эмульсии, эмульгаторы), которые образуют "оболочку" на поверхности мелких капелек, не давая капелькам обедняться между собой. Например, для этой цели можно использовать поверхностно-активные вещества. Достаточно маленькие капли будут поддерживаться во взвешенном состоянии за счет броуновского движения молекул жидкости (дисперсионной среды). Но цель нашего эксперимента другая, поэтому мы не будем стабилизировать эмульсию. Наоборот, необходимо, чтобы жидкости разделились и можно было отобрать пипеткой часть верхнего слоя (этанол). Повторил несколько раз операцию перемешивания - расслоения, затем приступил к основному эксперименту. Налил в стакан 200 мл дистиллированной воды. Пипеткой отобрал несколько миллилитров спирта из пробирки (осторожно, чтобы не задеть слой масла). Добавил спирт в воду. Образовалась белая эмульсия. Перемешал. Жидкость в стакане стала белой и мутной, хотя частично сохранила прозрачность. Таким образом, небольшая часть подсолнечного масла растворилась в этиловом спирте, а потом образовало мелкую эмульсию, когда спирт вылили в воду. Пропустил сквозь полученную эмульсию зеленый луч лазера. Наблюдался четкий эффект Тиндаля. В этот раз я попробовал направить луч не только перпендикулярно направлению стакан - камера, но и в направлении от камеры к стакану. Еще я направил лазер в жидкость под разными углами. Получилось небольшое световое шоу. В отличие от эмульсии подсолнечное масло в спирте, данная эмульсия (масло в воде) была достаточно стабильна и не расслоилась за время эксперимента. Жиры и вода могут образовывать трудноразделимые эмульсии даже при простом встряхивании. Это происходит не всегда, но достаточно часто. Дело в том, что плотность воды близка к плотности различных жиров растительного и животного происхождения. Например, если встряхнуть подсолнечное масло с водой, большая часть двух жидкостей быстро разделится, как только вы прекратите перемешивание. Вода будет снизу, масло всплывет вверх. Но слой воды в результате станет мутным: в нем останутся мелкие капельки масла. Основной эксперимент окончен. Я решил провести еще один эксперимент с этими тремя жидкостями (подсолнечное масло, спирт и вода). Дело в том, что плотность подсолнечного масла больше, чем плотность этилового спирта, но меньше, чем плотность воды. При этом этиловый спирт и вода смешиваются в любых соотношениях. Можно подобрать такое соотношение этилового спирта и воды, что плотность раствора спирта будет равна плотности подсолнечного масла. В таком растворе масло не будет ни всплывать, ни тонуть (плотности жидкостей равны, следовательно сила Архимеда равна нулю). Масло соберется в капли, которые будут свободно плавать (находиться в равновесии) в любой точке раствора спирта. В прошлых экспериментах использовал для этой цели три жидкости: тетрахлорид углерода, вода и циклогексан; коллега провел опыты с этиловым спиртом, водой и подсолнечным маслом [2]. Последние три жидкости идентичны тем, что я использовал в данном эксперименте. С одной стороны, не было смысла повторять опыт с подсолнечным маслом, которое не тонет и не всплывает в растворе спирта, поскольку этот эксперимент уже сделал коллега. С другой стороны, спирт и масло я УЖЕ налил в пробирку. Осталось только добавлять небольшими порциями воду и перемешивать до тех пор, пока плотности двух жидкостей не сравняются (подсолнечного масла и водного раствора спирта). Так я и сделал. В пробирку с этиловым спиртом и подсолнечным маслом начал добавлять воду. Сразу произошла неожиданность: от одной капли воды слой спирта стал мутным! Образовалась белая эмульсия. Добавил еще воды и перемешал. При стоянии жидкости разделились. Снизу был слой подсолнечного масла, сверху - эмульсия масла в водном растворе спирта. Эмульсия была белой и непрозрачной, зато слой масла не изменился. Объясняется это тем, что спирт в пробирке был не чистым. В результате перемешивания с подсолнечным маслом в этаноле растворилось немого компонентов подсолнечного масла. Достаточно было одной капли воды, чтобы гидрофобные вещества покинули спирт и образовали отдельную фазу. Другими словами, произошло то же явление, что и в первой части эксперимента (когда спирт взбалтывали с подсолнечным маслом, а затем добавляли в воду). С одной стороны, это хорошо: мы получили эмульсию масла двумя разными способами: добавить раствор подсолнечного масла в спирте в воду; добавить воду в раствор подсолнечного масла в спирте. К сожалению, после добавления воды спиртовая фаза стала мутной, что мешало проведению следующего эксперимента. Текущая задача - добавить в спирт сколько воды, чтобы капли масла ни тонули, ни всплывали в полученном растворе спирта. Однако, из-за того, что раствор спирта стал мутным, трудно было наблюдать за каплями масла, которые плавали в водном растворе спирта. Продолжил добавлять воду и перемешивать. Долгое время плотность раствора спирта была ниже, чем плотность подсолнечного масла, поэтому капли масла опускались на дно. Понял свою ошибку: плотность подсолнечного масла ближе к плотности воды, чем к плотности этилового спирта. Следовательно, в растворе должно быть больше воды, чем спирта. Поэтому отобрал часть раствора спирта из пробирки и продолжил добавлять воду в эту пробирку. Наконец я достиг точки, когда капли подсолнечного масла распределились по всему объему раствора (они не тонули и не всплывали). К сожалению, желтоватые капли масла было плохо заметно в молочно-белом растворе спирта в воде. Показывать такие фото и видео не стоит: они ненаглядны. Значит, надо окрасить подсолнечное масло. Но с помощью какого вещества? Йод использовать не хотелось. Решил взять для этой цели родамин. Коллега мне сказал, что родамин хорошо растворим в жирах. Утверждение оказалось неверным, зато попытка его проверить привела к новым красивым экспериментам, речь о которых пойдет ниже. В очередной раз я пытался сделать одно, а получил - совсем другое. |
|
Sunflower oil, alcohol, rhodamine and dichroism - part 2
As I noted, this experiment became an unexpected continuation of the previous one. After the last experiment, I still had two vessels with liquids. First, a test tube contained two different liquids with equal densities.
Подсолнечное масло, спирт, родамин и дихроизм - ч.2 The first liquid, sunflower oil, was distributed throughout the volume of the second liquid in the form of large drops. The second liquid was a solution of ethyl alcohol in water. The solution was white and cloudy. Because it contained microscopic dispersed oil particles, this solution was an emulsion. The second vessel was a beaker containing another solution of alcohol in water with a higher concentration of alcohol. Consequently, its density was lower than the density of the alcohol solution in a test tube, as well as the density of the vegetable oil. My task was to tint the large drops of oil so that they were clearly visible in the milky white liquid. As I already mentioned, a colleague recommended using rhodamine for this purpose. Fortunately, I had rhodamine: it was sent by another colleague several years ago; he lives hundreds of kilometres from my city. I poured a small amount of sunflower oil into a small glass and intended to add some rhodamine. The difficulty was that the rhodamine was contained in a small bottle with a narrow neck. The best I could do was to cut a strip of hard paper or cardboard and use it to extract a small amount of rhodamine from the bottle. The fact is that rhodamine, as far as I know, has an intense colour and can easily stain your hands and surrounding things. Moreover, the first mentioned colleague told me a fascinating story related to rhodamine. There is such an interesting thing that we call ''chemical traps'' in Ukrainian. In English, the meaning of the phrase ''chemical traps'' is quite different (special analytic reagents). Probably, I should use the term "powder for theft detection", "theft detection powder", or "anti-theft powder". The design of these traps may be various, but the goal is to catch the thief. In its simplest case, money, jewellery, important documents, and other items susceptible to theft are coated with a special dye powder. This powder is practically invisible. When a thief touches a surface coated with the dye, bright, well-visible stains appear on the skin that are difficult to wash off. In another variant, the dye that gets on the skin and the clothes does not show itself in any way - until it is illuminated with ultraviolet light. As a result, fluorescent spots appear on the skin and clothes. So, a classmate of my colleague went to work in the police immediately after graduating from university. There were vacancies in the forensic department of the police at that time; however, far from the best chemists agreed to this work, and even they did not stay there for long. The mentioned gentleman had many official duties; one of his duties was setting "chemical traps" to catch thieves. Most likely, he sprinkled money or some documents with dye that day. As a result, he got his hands dirty but forgot to wash them after work. He went home in civilian clothes (without a police uniform). In other words, there was outwardly nothing to indicate that the person belonged to the police. At the metro station, local police unexpectedly grabbed him and began beating him without further delay. - Tell us what you stole!!! - Uh... guys! What are you doing? I'm a cop! [3] - You say that you are a cop... Make up something more believable! The police officers did not believe him, so they escalated the violence. However, as soon as our hero managed to show a police ID, even amidst the blows, the officers stopped, apologized, and let him go. My colleague who told this story did not remember exactly what dye his classmate used as "powder for theft detection", but he was sure the dye was rhodamine. I searched the internet and found rhodamine is indeed used for this purpose. By the way, this is precisely why my colleague decided that rhodamine is highly soluble in fats. Oil-soluble dye stains are the most difficult to remove from the skin because the dye penetrates the lipid layer. Of course, a thief may be wearing gloves, which is what happens in many cases. By removing gloves after theft, the criminal will most likely be left with clean hands. For such a case, other types of "chemical traps for thieves" are used. For instance, the trap is designed as a device resembling a fire alarm and installed in rooms where illegal entry is a possibility. The device contains a small amount of explosive, a coiled incandescent filament, and the dye. When the device is triggered, current is supplied to the incandescent filament, which sets off the explosive. The dye is sprayed with the explosion, getting onto the thief's skin and clothing. What will happen next - I think you understand... Furthermore, money or other valuables are marked in this manner to prevent thieves from using them, even if they manage to evade capture. After searching, I found that this method is called the "Intelligent banknote neutralization system" (IBNS), and the device itself that sprays the dye is called a "dye pack". Instead of dye, glue can be used to protect against theft. If many banknotes stick together, it is hard to buy anything with them. To mark a thief, in addition to dyes, substances with a specific strong odour are also used. God spared me from work in the police, but once, I took part in the making of these "dye packs" ("chemical traps"). I made a special varnish and applied it over the incandescent filament. This varnish acquired explosive properties after the solvent dried. The dye was applied without me. I assume that the dye was fluorescent. So, after the explosion, the thief did not even suspect that he had already been marked (since this dye is visible only when illuminated with ultraviolet light). The reader may wonder, ''What do these stories have to do with our experiment?'' The answer is that the described facts are directly related to our experiment. So, I needed to sprinkle some rhodamine from the bottle with a narrow neck into the glass with sunflower oil [4]. I was too lazy to cut out a strip of paper and use it to pick up the dye. Instead of using the strip, I sprinkled some rhodamine inside the lid, then poured the dye into the glass with the oil. After that, I poured the remaining rhodamine from the cap into the bottle, but not carefully enough. A small amount of dye got on the skin of my palm, resulting in the formation of pink spots (I did not wear rubber gloves). I was not afraid of a repeat of the story described above since the police were rare on the way to my work. If I met the police, I would not show them the pink palm. But I was curious... How would my skin look like under an ultraviolet lamp? Rhodamine is known not only for its intense colour but for its ability to glow brightly under ultraviolet rays also. Imagine my disappointment when it turned out that rhodamine stains on the skin gave a dull pink glow. I do not think it is fluorescence. The UV lamp produces some visible light also; as a result, the rhodamine stains look pink. However, this result could have been predicted. For example, fluorescein glows brightly in a solution but not as a solid when irradiated with ultraviolet light. On the skin of the other palm, I found brighter spots that glowed orange. Rhodamine did not reach this palm, but the skin glowed. I did not immediately understand what was going on. Not long before, I was peeling an orange. And the essential oil from the peel got onto the skin. Of course, I did not wash my hands. Citrus essential oils glow yellow/orange under ultraviolet light [5]. The demonstration is very beautiful if you squeeze out splashes of essential oil by bending the peel of citrus fruits near a switched-on ultraviolet lamp. Fountains of luminous aerosol are formed. |
|
Подсолнечное масло, спирт, родамин и дихроизм - ч.2
Как я уже отмечал, данный эксперимент стал неожиданным продолжением предыдущего. После прошлого эксперимента у меня осталось два сосуда с жидкостями. Во-первых, пробирка; в ней находилось две разных жидкости с равной плотностью.
Первая жидкость - подсолнечное масло, которое было распределено по объему второй жидкости в виде крупных капель. Второй жидкостью был раствор этилового спирта в воде. Раствор был белым и мутным. Данный раствор также содержал микроскопические диспергированные частицы масла, следовательно, он представлял собой эмульсию. Вторым сосудом был стакан, в котором содержался другой раствор спирта в воде с более высокой концентрацией спирта. Следовательно, его плотность была ниже, чем плотность раствора спирта в пробирке, а также чем плотность растительного масла. Моей задачей было подкрасить крупные капли масла, чтобы они были хорошо видны в молочно-белой жидкости. Как я уже упоминал, коллега посоветовал использовать для этой цели родамин. К счастью, родамин у меня был: его прислал несколько лет назад другой коллега, который живет за сотни километров от моего города. Я налил небольшую порцию подсолнечного масла в небольшой стакан и намеревался всыпать в него немного родамина. Трудность была в том, что родамин находился в маленькой бутылочке с узким горлышком. Лучшее, что я мог сделать, это вырезать полоску твердой бумаги или картона и набрать родамин из бутылочки с ее помощью. Дело в том, что родамин, насколько я знаю, имеет интенсивную окраску и легко может вымазать руки и окружающие вещи. Более того, первый упомянутый коллега рассказал мне интересную историю, связанную с родамином. Есть такая интересная вещь - "химические ловушки". Устройство "химических ловушек" может быть разным, но цель - поймать вора. Интересно, что в английском языке словосочетание "химические ловушки" (''chemical traps'') имеет совсем иное значение (специальные аналитические реагенты). Наверное, там следует использовать термин "порошок для обнаружения краж". В самом простом варианте деньги, ювелирные украшения, важные документы и другие вещи, на которые может позариться преступник, посыпают порошком специального красителя. Этот порошок практически невидим. В момент кражи вор прикасается к посыпанной красителем поверхности, в результате на коже остаются яркие, хорошо заметные пятна, которые трудно смыть. В другом варианте попавший на кожу и одежду краситель никак себя не проявляет - до тех пор, пока его не осветить ультрафиолетовым светом. В результате на коже и одежде появляются флуоресцентные пятна. Так вот, однокурсник моего коллеги сразу же после окончания университета пошел работать в полицию [3]. Вакантные места в экспертно-криминалистическом отделе полиции тогда были, тем не менее, на эту работу соглашались далеко не лучшие химики, и даже они долго там не задерживались. Одной из служебных обязанностей упомянутого господина была установка химических ловушек с целью поймать воров. Скорее всего он в этот день посыпал красителем деньги или какие-то документы. В результате он вымазал руки, но забыл их помыть после работы. Домой он ехал в гражданской одежде (без полицейской формы). Другими словами, внешне ничего не выдавало принадлежность человека к полиции. На станции метро его неожиданно схватили местные полицейские и без лишних промедлений стали бить. - Рассказывай, что украл!!! - Эээ..., ребята! Вы шо? Я - мент! [3] - Говоришь, что ты - мент... Придумай что-то посерьезнее! Полицейские не поверили, потому стали быть его еще сильнее. И только тогда, когда (в перерывах между ударами) наш герой успел достать "ксиву" (полицейское удостоверение), его перестали бить, извинились и отпустили. Мой коллега, который рассказал эту историю, точно не помнил, какой краситель использовал его однокурсник для постановки химических ловушек, но он был уверен, что это родамин. Я задал поиск в интернете - родамин действительно используется для этой цели. Кстати, именно потому коллега и решил, что родамин хорошо растворяется в жирах. Пятна от жирорастворимых красителей труднее всего смыть с кожи, поскольку краситель проникает в липидный слой. Разумеется, вор может быть в перчатках, что во многих случаях и происходит. Сняв перчатки после кражи, преступник скорее всего останется с чистыми руками. Для такого случая предусмотрен другой тип химических ловушек. Например, ловушка представляет собой устройство, которое напоминает датчик пожарной сигнализации. Устройство устанавливают в помещении, где может быть незаконное проникновение. Ловушка содержит небольшое количество взрывчатого вещества, спираль накаливания, а также - краситель. При срабатывании устройства ток подается на спираль накаливания, которая приводит в действие взрывчатое вещество. Краситель распыляется при взрыве, попадая на кожу и одежду вора. Что будет дальше - думаю, вы поняли... Кроме того, указанным способом помечаются украденные деньги или другие ценности, чтобы вор не смог ими воспользоваться, даже, если его не поймают. После поисков обнаружил, что этот метод называется "Intelligent banknote neutralisation system" (IBNS), а само устройство, распыляющее краситель, - "dye pack" ("пакетик с красителем"). Вместо красителя для защиты от кражи могут использовать клей. Если банкноты склеятся между собой, купить что-то за них будет проблематично. Для того, чтобы пометить вора, кроме красителей используют также вещества с сильным специфическим запахом. От работы в полиции меня бог миловал, но как-то пришлось принимать участие в изготовлении таких химических ловушек. Я изготавливал специальный лак и наносил его поверх спирали накаливания. Данный лак после высыхания растворителя приобретал взрывчатые свойства. Краситель наносили уже без меня. Предполагаю, что краситель был флуоресцентным; т.е., после самого взрыва вор даже не подозревал, что его уже пометили (поскольку краситель этот виден только при освещении ультрафиолетовым светом). Читатель может задаться вопросом: "Какое отношение приведенные истории имеют к нашему эксперименту?" Ответ таков: описанные факты самым непосредственным образом связаны с нашим экспериментом. Итак, мне нужно было насыпать немного родамина из бутылочки с узким горлом в стакан с подсолнечным маслом [4]. Я поленился вырезать полоску бумаги, чтобы набрать краситель с ее помощью, а просто отсыпал немного родамина внутрь крышечки, а затем высыпал его в стакан с маслом. Остатки родамина я аккуратно пересыпал из крышки в бутылку. Точнее, недостаточно аккуратно. Немного красителя попало на кожу ладони (надеть резиновые перчатки я тоже поленился). Образовались розовые пятна. Повторения описанной выше истории я не боялся, поскольку полиция по пути на мою работу встречается редко. Если бы и я встретил полицейских, то не стал бы им демонстрировать розовую ладонь. Зато стало любопытно, как выглядит моя кожа под ультрафиолетовой лампой? Родамин известен не только своим интенсивным цветом, но и способностью ярко светиться в ультрафиолетовых лучах. Представьте мое разочарование, когда выяснилось, что пятна родамина на коже дают тусклое розовое свечение. Я думаю, что это не флуоресценция. Ультрафиолетовая лампа также изучает немного видимого света, поэтому пятна родамина и выглядели розовыми. Впрочем, такой результат можно было предвидеть. Например, флуоресцеин, если его облучить ультрафиолетом, ярко светится в растворе, но не в твердом виде. На коже другой ладони я обнаружил более яркие пятна, которые светились оранжевым. Родамин на эту ладонь не попал, но кожа светилась. В чем дело, я понял не сразу. Незадолго до этого я чистил апельсин. И эфирное масло из кожуры попало на кожу. Руки, естественно, я не помыл. Эфирные масла цитрусовых светятся желтым/оранжевым цветом в ультрафиолетовых лучах [5]. Особенно красивой получается демонстрация, если выдавить брызги эфирного масла, сгибая кожуру цитрусовых возле включенной ультрафиолетовой лампы. Образуются фонтаны светящегося аэрозоля. |
|
When I washed my hands, it turned out that all the rhodamine was easily washed off the skin with water. The water turned red. The red colour remained only in the depression near the nail. Out of curiosity, I did not wash off this last stain. The red colour lasted for several days. I photographed the spot against the background of a bowl of borscht (the national dish made with red beetroots as one of the main ingredients) - the colours of rhodamine and borscht were similar.
The most surprising thing happened a couple of weeks later. By this time, the rhodamine stain on the finger was no longer visible. Yesterday, I did another experiment using ultraviolet light, namely, squeezing essential oil from the peel of an orange onto the skin of my hands. There were glowing spots on the palm, but only a few. Most of the liquid squeezed from the peel did not glow this time. However, the place where the rhodamine stain had previously been showed bright yellow fluorescence under ultraviolet light. |
|
Когда помыл руки, то оказалось, что весь родамин легко смылся с кожи водой. Вода при этом окрасилась в красный цвет. Красная окраска осталась только в углублении возле ногтя. Ради любопытства не стал смывать это последнее пятно. Красный цвет продержался несколько дней. Сфотографировал пятно на фоне тарелки с борщом (национальное блюдо, в котором в качестве одного из основных ингредиентов используется красная свекла) - цвета родамина и борща оказались похожи.
Самое удивительное произошло через пару недель. К этому времени пятно от родамина на пальце перестало быть видимым. Вчера я проводил другой эксперимент с использованием ультрафиолетового света, а именно: выдавливал на кожу рук эфирное масло из кожуры апельсина. Светящиеся пятна на ладони получились, но их было мало. В этот раз большая часть жидкости, выдавленной из кожуры, не светилась. Зато место, где раньше было пятно от родамина, теперь давало яркую желтую флуоресценцию в ультрафиолетовом свете. |
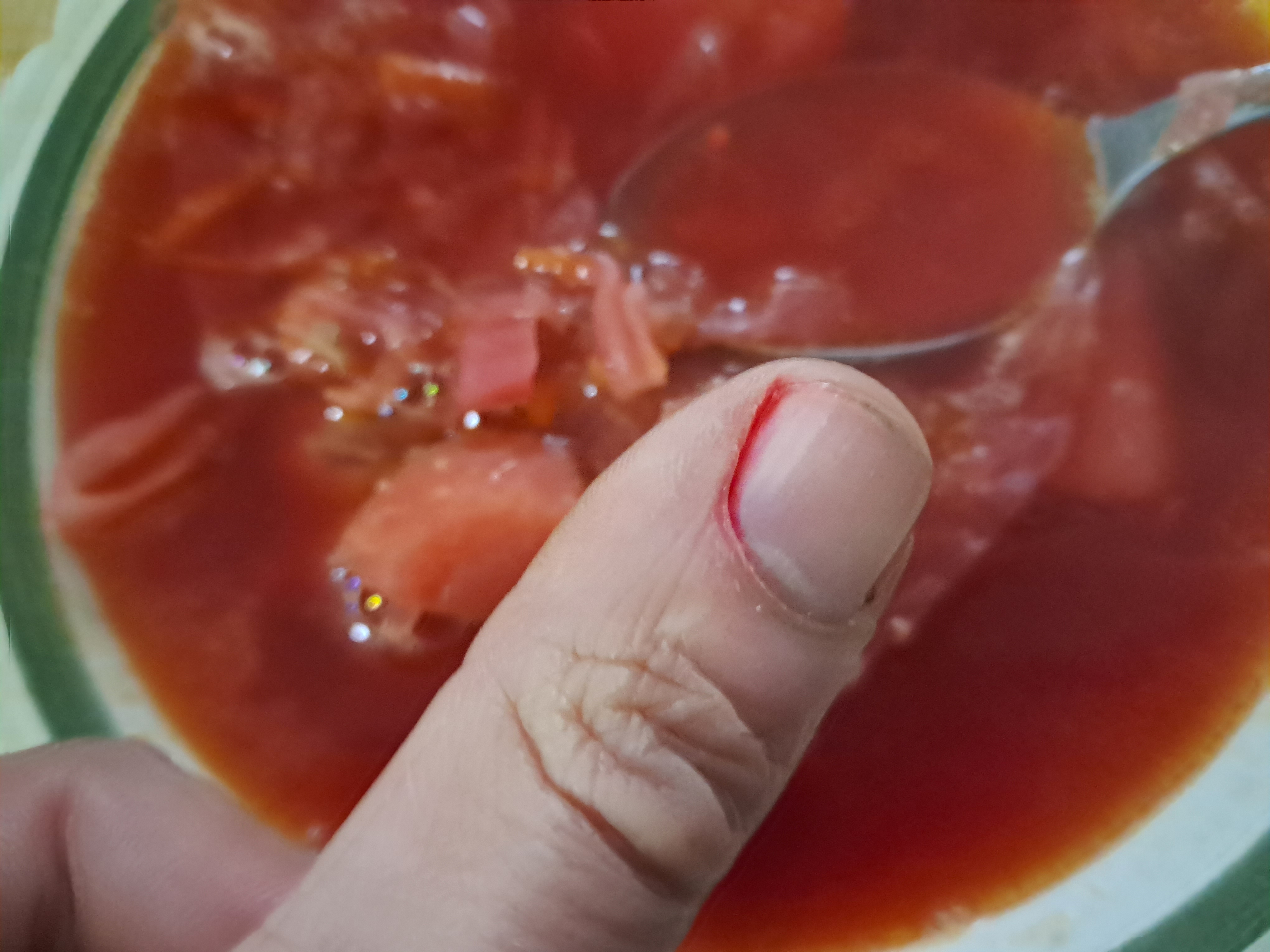
The rhodamine stain (along the perimeter of the nail) and borscht Пятно родамина (по периметру ногтя) и борщ |
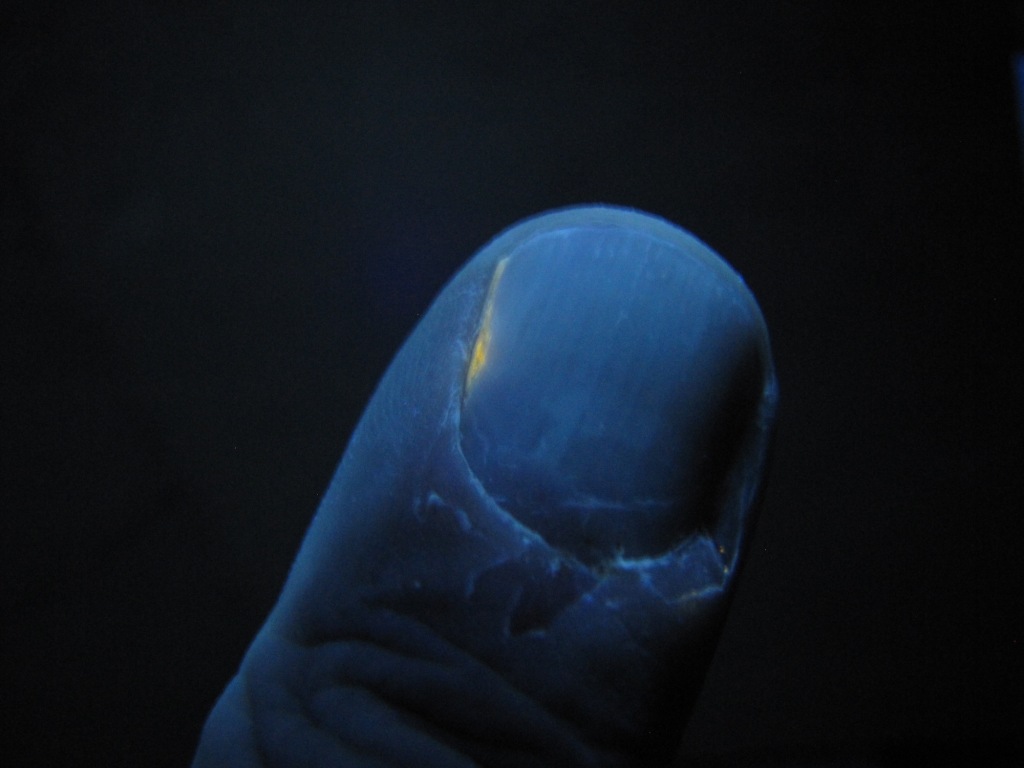
The same spot under ultraviolet light in 2 weeks Это же пятно в ультрафиолетовом свете через 2 недели |
|
But, if the dye is easily soluble in water, it is unlikely to dissolve in sunflower oil!
This is true. The sunflower oil to which I added rhodamine did not colour. Stirring did not help. Despite this, I added some oil with rhodamine powder to the test tube. Let me remind you. In the test tube, there is the aqueous solution of alcohol; large drops of oil are suspended in this liquid. They did not rise or sink in the solution. This ethanol solution also contained microscopic particles (oil droplets) dispersed throughout the solution. The tiny droplets gave the solution a white colour. In other words, the liquid was an emulsion of tiny oil droplets, in which large oil drops were additionally present. Of course, large drops of sunflower oil were not stained with rhodamine. The experiment was not a success. It is time to wash the chemical glassware. Out of frustration, I poured another alcohol solution from the glass into our test tube, intending to wash the beaker. The solution that was in the glass contained more alcohol; consequently, it had less density than the alcohol solution that was in the test tube. As a result, large drops of sunflower oil sank to the bottom, and the smallest ones remained as an emulsion. While I was washing the beaker, I suddenly discovered that the white emulsion in the test tube had turned yellow! Solid rhodamine, which entered with the oil into the test tube, dissolved in alcohol. It turned out that rhodamine is soluble not only in water but also in alcohol. I poured all the oil with rhodamine into this test tube and mixed the content. Then, I waited for the rhodamine to dissolve. Initially, the rhodamine solution in the test tube appeared yellow to me. However, I then discovered that the solution was not yellow but pink. More precisely, one part of the solution looked yellow, but another appeared pink. I soon realized that the rhodamine solution colour depended on the direction of the light. In reflected light, the solution appears yellow. In transmitted light (when light has passed through the solution), it appears pink. If you look at the test tube at an angle of approximately 90 degrees concerning the incident light, the light scattered in that direction also appears pink. Some crystals have similar properties. Their colour depends on the direction of light passing through the crystal. In the simplest case, the crystal has two colours. For example, copper acetate crystals may appear green or blue. This phenomenon is called dichroism. In turn, dichroism is a special case of pleochroism. The fact is that the absorption of light by such crystals depends on the orientation of the light beam relative to the optical axes of the crystal. |
|
Но, если краситель легко растворяется в воде, он вряд ли будет растворяться в подсолнечном масле!
Так и есть. Подсолнечное масло, в которое я добавил родамин, не окрасилось. Перемешивание не помогло. Несмотря на это, я добавил немного масла с порошком родамина в пробирку. Напомню, в пробирке были крупные капли масла, которые плавали в водном растворе спирта. Этот раствор также содержал микроскопические частицы (капельки масла), которые были диспергированы по объему раствора предавали ему белый цвет. Другими словами, жидкость представляла собой эмульсию мельчайших капелек масла, в которой дополнительно плавали крупные капли масла. Разумеется, крупные капли подсолнечного масла не окрасились родамином. Опыт не удался. Время мыть химическую посуду. С досады я вылил другой раствор спирта из стакана в нашу пробирку, намереваясь вымыть стакан. Раствор, который был в стакане, содержал больше спирта, следовательно он имел меньшую плотность, чем раствор спирта, который был в пробирке. В результате крупные капли подсолнечного масла опустились на дно, а мельчайшие - остались в виде эмульсии. Пока я мыл стакан, неожиданно обнаружил, что белая эмульсия в пробирке стала желтой! Твердый родамин, который попал в пробирку вместе с маслом, растворился в спирте. Оказалось, что родамин растворим не только в воде, но и в спирте. Я вылил все масло с родамином в эту пробирку, перемешал. Подождал, пока родамин растворится. Сначала пробирка с раствором родамина мне показалось желтой, потом я обнаружил, что раствор не желтый, а розовый. Точнее, в одних местах раствор выглядел желтым, в других - розовым. Скоро я понял, что окраска раствора родамина зависит от направления прохождения света. В отраженном свете раствор выглядит желтым. В пропущенном свете (когда свет прошел через раствор) он выглядит розовым. Если смотреть на пробирку под углом примерно 90 градусов по отношению к падающему свету, то рассеянный в этом направлении свет также выглядит розовым. Аналогичными свойствами обладают некоторые кристаллы. Их окраска зависит от направления прохождения света через кристалл. В простейшем случае кристалл имеет два цвета. Например, кристаллы ацетата меди могут выглядеть зелеными или голубыми. Данное явление называется дихроизм, оно является частным случаем плеохроизма. Дело в том, что поглощение света такими кристаллами зависит от ориентации светового луча относительно оптических осей кристалла. |
|
So, at first glance, everything is simple. The rhodamine solution appears yellow in reflected light, turns pink in light transmitted through the liquid, and also appears pink in light scattered at a 90-degree angle to the direction of the incident beam.
Trying to film the effect described above, I encountered an unexpected difficulty. The actual colours of rhodamine differed from the idealized picture described above. For example, our solution looked predominantly yellow in reflected light, but some areas were pink; or in light scattered at an angle of 90 degrees, most of the solution was pink, but some was yellow. I understood the reason after some time. Two different light sources illuminated the solution. Firstly, an incandescent lamp illuminated the entire room from the ceiling. Secondly, there was a diode lamp (LED), with which I locally lit the objects of the experiment, in this case, the test tube with rhodamine. I was changing the position of the second lamp so that the light fell on the rhodamine solution at different angles. The light from the first lamp, of course, fell on the test tube at a constant angle. In other words, I could adjust the angle of light from the second lamp but not from the first. So I turned off the first lamp. When one light source was left, the results became unequivocal [6]. The solution looked either yellow or pink. Sometimes, the liquid was yellow in one place and pink in another. The colour depended on the position of the single lamp. Dichroism is interesting and beautiful. I did not even know that rhodamine exhibited such properties. Moreover, I am still unsure whether the term ''dichroism'' can be applied to a rhodamine solution. Usually, this term is used to describe the optical properties of crystals. But I knew well that rhodamine gives bright fluorescence in ultraviolet rays. Moreover, the colleague sent me this reagent for experiments with fluorescence and for obtaining phosphors. It is time to see rhodamine fluorescence. __________________________________________________ 3 In the original conversation, the word "мент" ("ment") was used, which means a "police officer." A rough English equivalent of this word is the word a "cop" or even a "pig". In most cases, the word "мент" has an offensive meaning, but it was used by police officers themselves when communicating with each other. Полиция в те времена называлась "милиция". Официальное название сотрудников милиции - "милиционер", неофициальное - "мент". В большинстве случаев слово "мент" носило уничижительно-ругательный оттенок, однако нередко использовалось самими сотрудниками милиции при общении между собой. 4"Rhodamine" is the name of a whole family of dyes of a similar structure. In these experiments, I used Rhodamine G. "Родамин" - название целого семейства красителей схожего строения. В данных экспериментах я использовал Rhodamine G (Родамин Ж). 5 See the articles Oranges and ultraviolet light / Апельсины и ультрафиолетовый свет [link] Lemons, mandarins and ultraviolet light / Лимоны, мандарины и ультрафиолетовый свет [link] Grapefruit and ultraviolet light / Грейпфруты и ультрафиолетовый свет [link] 6 Strictly speaking, the LED lamp did not correspond to the model of a point light source (under these conditions, we cannot neglect the lamp's dimensions and shape). Light from different points of the lamp fell on the rhodamine solution at slightly different angles. This also influenced the observed colour of the rhodamine solution, but this fact does not change the essence of what was stated. Строго говоря, диодная лампа не соответствовала модели точечного источника света (в данных условиях мы не можем пренебречь собственными размерами и формой лампы). Свет от разных точек лампы падал на раствор родамина под немного разными углами. Это также влияло на наблюдаемый цвет раствора родамина, но данный факт не меняет сути изложенного. |
|
Итак, на первый взгляд все просто. Раствор родамина кажется желтым в отраженном свете, становится розовым в свете, проходящем через жидкость, а также кажется розовым в свете, рассеянном под углом 90 градусов к направлению падающего луча.
Когда я попытался снять на видео описанный выше эффект, то столкнулся с неожиданной сложностью. Фактические цвета родамина отличались от описанной выше идеализированной картины. Например, наш раствор в отраженном свете выглядел преимущественно желтым, но некоторые зоны были розовыми; или в рассеянном под углом 90 градусов свете большая часть раствора была розовой, но некоторая часть - желтой. В чем причина, я понял через некоторое время. Было два разных источника света, которые освещали раствор. Во-первых, это лампа накаливания, которая висела под потолком и освещала всю комнату. Во-вторых, была диодная лампа (LED), с помощью которой я локально освещаю объекты эксперимента, в данном случае - пробирку с родамином. Положение второй лампы я менял, чтобы свет падал на раствор родамина под разными углами. Свет от первой лампы, разумеется, падал на пробирку под одним и тем же углом. Другими словами, я мог регулировать угол падения света от второй лампы, но не от первой. Поэтому первую лампу выключил. Когда остался только один источник света, результаты стали однозначными [6]. Раствор выглядел, либо желтым, либо розовым, либо местами желтым, а местами розовым. Цвет зависел от положения единственной лампы. Дихроизм - это любопытно и красиво. Я даже не знал, что родамин проявляет такие свойства. Более того, я до сих пор не уверен, можно ли применить термин "дихроизм" к раствору родамина. Обычно этот термин используют для описания оптических свойств кристаллов. Зато я хорошо знал, что родамин дает яркую флуоресценцию в ультрафиолетовых лучах. Именно для экспериментов с флуоресценцией и для получения люминофоров коллега прислал мне данный реактив. Пора увидеть флуоресценцию родамина. |
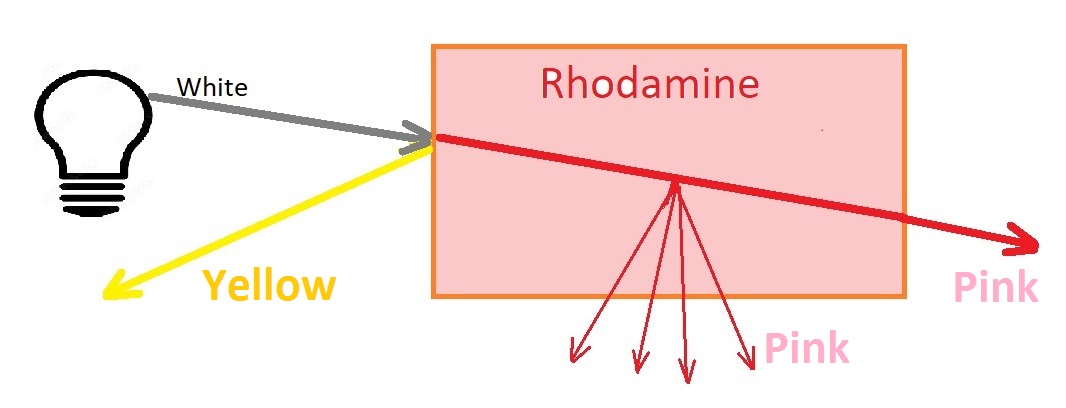
The colour of the rhodamine solution depends on the direction of the light rays Цвет раствора родамина зависит от направления световых лучей |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|