
Тихий океан из космоса

Багамские острова из космоса
| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 6 2011 |
Химия для любознательных. Основы химии и занимательные опыты Гроссе Э., Вайсмантель X. |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Вода встречается на Земле почти повсеместно, 70 % земной поверхности занимает мировой океан; более 1,5 триллионов тонн воды содержатся в этом гигантском резервуаре. Под влиянием солнечного тепла часть морской воды постоянно испаряется, а образующийся водяной пар поднимается в воздух. Если воздух, содержащий водяной пар, охладится, то выделятся мельчайшие водяные капельки. Из таких капелек состоят облака, которые переносятся потоками ветра с моря на континент. При определенных условиях мелкие капельки сливаются в более крупные, и на Землю выпадает дождь, снег или град. Почва впитывает эти осадки и собирает их в грунтовые воды. Избыток воды пробивается из почвы в виде родников, из них вытекают ручьи, сливающиеся в малые и большие реки. А реки несут воду опять в море, и так завершается этот круговорот воды в природе.
Без круговорота воды Земля имела бы совсем другой вид. Современное строение гор и долин, морских побережий и местностей, удаленных от моря, - все это возникло под влиянием механического и химического воздействия воды. Без воды не было бы жизни на Земле. Все живое нуждается в воде, которая является одновременно и важнейшей составной частью растений и животных. Наше тело примерно на 65 % состоит из воды; у некоторых медуз ее содержание доходит даже до 99 %. Если бы вода внезапно исчезла с поверхности Земли, то она превратилась бы в мертвую пустыню. |

Тихий океан из космоса |

Багамские острова из космоса |
|
Тот, кто когда-нибудь занимался хотя бы несколько часов химией, знает, что вода - это химическое соединение. А ее химическая формула - Н2О - всем хорошо известна. Вода состоит из двух элементов - водорода и кислорода. Но мы все же хотим поэкспериментировать! Попытаемся-ка разложить соединение "вода" на составные части и затем опять создать его. Предупреждаем: задачу эту решить нелегко, вода - очень устойчивое соединение. Чтобы отделить атом водорода от атома кислорода, нужны очень сильные вспомогательные средства, и напротив, соединяется водород с кислородом легко и чрезвычайно бурно. В данном случае оправдывается изречение (обычно неверное): химия там, где что-то сверкает и грохочет.
В пробирку из тугоплавкого стекла насыплем порошок железа (в продаже имеется металлический порошок, можно взять и очень тонкие металлические опилки) слоем в 2-3 см. Затем добавим по капле 0,5 мл воды. Железный порошок впитывает воду. На влажную смесь насыплем еще примерно трехсантиметровый слой сухого порошка железа. Пробирку закроем резиновой пробкой, через которую пропустим стеклянную изогнутую трубку с внутренним сечением 3-6 мм. Внутреннюю сторону пробки защитим от сильного нагрева куском листового асбеста, асбестовой или стеклянной ватой. Затем под углом закрепим пробирку на штативе или в держателе для пробирок, как указано на рисунке. Газоотводную трубку погрузим в воду и над ее концом укрепим перевернутую пробирку, наполненную водой. Такое приспособление для улавливания газов называется пневматическая ванна. Горелку установим под пробиркой таким образом, чтобы наиболее горячая внешняя кромка несветящегося пламени обтекала пробирку. Сначала будем нагревать участок, находящийся несколько выше сухого столбика железного порошка, пока пробирка заметно не накалится. Затем медленно подведем пламя под зону сухого железного порошка. Влажный слой нагревается, вода испаряется, и водяной пар взаимодействует с горячим порошком железа. При этом железо захватывает кислород воды, а водород освобождается. Он проходит через стеклянную трубку, а в улавливающем устройстве образуются пузырьки, которые собираются в наполненной водой пробирке. Это происходит так быстро, что мы успеем наполнить и вторую пробирку. Каждую наполняющуюся пробирку прямо под водой нужно закрыть пробкой и только после этого извлечь из пневматической ванны. Если пузырьки газа перестанут образовываться, прекратим нагревание и подожжем образовавшийся водород. Для этого перевернем пробирку отверстием вниз, откроем и внесем пламя снизу в отверстие. Газ быстро сгорит. Мы увидим голубое пламя и услышим свистящий звук, а может быть, и сильный хлопок. Если хлопнуло, значит, в пробирке не чистый водород, а смешанный с воздухом. Воздух может попасть при его вытеснении из аппаратуры в начале опыта или при использовании некачественных пробирок. На всякий случай, чтобы не пораниться осколками при возможном взрыве, прежде чем поджигать газ, обмотаем пробирку влажным платком. Железо легко соединяется с кислородом, поэтому оно может вытеснять водород из воды. При комнатной температуре этот процесс протекает очень медленно, напротив, при температуре красного каления - бурно. Водород при воспламенении сгорает. Он соединяется при этом с кислородом воздуха, и опять образуется вода. Если водород не смешан с самого начала с кислородом или воздухом, сгорание протекает спокойно. Смесь же водорода с воздухом или чистым кислородом взрывается. Такую смесь называют гремучим газом, а описанную выше пробу в пробирке - пробой на гремучий газ. Если мы работаем с водородом, то перед опытом необходимо с помощью этой пробы убедиться, что водород не содержит воздуха. Исходя из нашего первого опыта, мы можем дать общий рецепт разложения химического соединения: чтобы освободишь компонент А из соединения АВ, нужно ввести в реакцию с ним вещество С, которое соединяется с В легче, чем А. Железо более склонно к образованию соединения с кислородом, чем водород, и вследствие этого вытесняет его из воды. Другие металлы также способны к этому, например цинк, алюминий, магний или натрий. Такие металлы называют активными, в то время, как неактивные металлы: медь, серебро, золото и платина - не могут разлагать воду [1]. Металлы по их способности к соединению с кислородом можно поставить в ряд, который начинается с самого благородного металла - золота, и заканчивается наиболее реакционноспособными щелочными металлами - натрием, калием и т. д. Склонность к соединению с элементом называют в химии сродством. Золото обладает слабым, а натрий - очень сильным сродством к кислороду. Вытеснять водород из воды могут те металлы, сродство которых к кислороду больше, чем сродство к нему водорода. _____________________________________________ 1 Все сказанное относится к определенным условиям. Действительно, при обычных температурах железо не соединяется с водой, по крайней мере так быстро, как это происходит в описанном опыте. В то же время даже жидкая вода без нагревания взаимодействует с натрием. Указанный ряд металлов может быть вполне строго составлен, если достаточно ясно определить условия. Именно таким путем строится ряд напряжения, о котором пойдет речь ниже. - Прим. ред. |

|
|
Неблагородные металлы, такие как натрий или калий, бурно реагируют с водой с образованием оснований. Магний тоже уже при комнатной температуре может разлагать воду:
Мg + 2Н2O => Mg(OH)2 + Н2
Однако образующийся гидроксид магния растворяется в воде очень плохо. Он остается на металле в виде тонкой пленки, которая задерживает дальнейшее растворение. Благодаря такому торможению реакции многие металлы не растворяются в воде. Однако, если несколько минут кипятить в колбе немного магниевого порошка с 5 мл воды и несколькими каплями спиртового раствора фенолфталеина, то жидкость окрасится в красный цвет. Достаточно совсем незначительного количества гидроксида магния (менее 0,1 мг/л), чтобы индикатор показал основную реакцию. Этот маленький опыт дает представление о высокой чувствительности многих химических реакций. Теперь нужно обнаружить водород, который получился в результате разложения воды магнием. Так как в чистой воде разложение практически прекращается из-за образования защитной пленки, следует позаботиться о том, чтобы слой гидроксида непрерывно разрушался. Для этого используем добавки. Мы достигнем желаемого эффекта с помощью очень небольших количеств кислоты или солей, таких как хлорид железа (III) или хлорид магния. Поместим в широкие пробирки несколько кусочков магния или немного магниевого порошка, или по кусочку магниевой полоски. Одну из этих пробирок заполним водопроводной водой, другую - водой, в которую уже добавлены очень незначительные количества кислоты или уксуса, третью - разбавленным раствором хлорида железа (III) или поваренной соли. В подкисленной воде и в растворах солей образуются пузырьки газа, а магний энергично растворяется. Если наполнить узкую пробирку водой и, перевернув, погрузить ее в широкую пробирку, то можно собрать выделяющийся газ. Из подкисленной воды мы получим его так много, что сумеем провести пробу на гремучий газ. Образование поверхностной инертной пленки называют пассивированием. Если бы не это явление, хром, алюминий и многие другие металлы были бы в очень короткий срок разрушены кислородом воздуха или водяным паром. |

Магний |

|
|
Для разложения воды электрическим током чаще всего используют аппарат Гофмана. Кто не располагает таким аппаратом, может сам легко построить подобное приспособление. Возьмем кусок очень широкой стеклянной трубки (например, химический стакан или широкогорлую склянку без дна. Как удалить дно, описано в главе 8, а острые края надо оплавить на пламени бунзеновской горелки). Отверстие трубки или горло склянки закроем очень плотно подогнанной резиновой пробкой. В пробке на не слишком близком расстоянии друг от друга просверлим два отверстия, в которые в качестве электродов вставим два угольных стержня. Такие стержни можно купить или взять из батарейки для электрического карманного фонаря. Перед применением очистим угольные стержни длительным кипячением в воде. К нижним концам угольных стержней присоединим токоподводы из изолированной медной проволоки. Лучше всего достать у электрика подходящие клеммы и к ним припаять зачищенные концы проводов. В крайнем случае обмотаем стержень проволокой. Изоляционный лак с проволоки необходимо тщательно счистить, а число витков должно быть достаточно большим. Провода подсоединим к батарейке для карманного фонарика или, лучше, к свинцовому аккумулятору. Если найдется переменное сопротивление в несколько Oм, включим его в цепь. Тогда скорость электролиза будет хорошо регулироваться.
Наполним изготовленный электролизный сосуд примерно на две трети водой, в которую добавим немного разбавленной серной кислоты. Чистая вода проводит электрический ток очень плохо. Уже незначительное количество кислоты сильно повышает проводимость. Лучше всего, чтобы концентрация серной кислоты составляла 2-4 %. Осторожно - даже разбавленная серная кислота разъедает кожу. Запомните навсегда: при разведении кислоты ее следует очень медленно вливать в воду; ни в коем случае нельзя поступать наоборот - вливать воду в кислоту. Ячейка готова. Теперь замкнем электрическую цепь. На обоих электродах выделяется газ: на положительном полюсе (аноде) слабее, на отрицательном (катоде) - сильнее. Соберем газы для их изучения. Для этого поместим перевернутые наполненные водой пробирки над электродами - только, чтобы они не стояли на резиновой пробке, а то электрическая цепь прервется. В обеих пробирках соберется газ. В идеальном случае нужно ожидать, что на аноде образуется ровно вдвое меньше газа, чем на катоде. Ведь на аноде выделяется кислород, а на катоде - водород. Так как формула воды Н2О, то на один атом кислорода приходится два атома водорода, и при разложении воды должно образовываться в два раза больше атомов водорода, чем кислорода. С другой стороны, мы знаем из школьного курса, что в равных объемах газов всегда содержится ровное число молекул (закон Авогадро), а как молекула водорода, так и молекула кислорода содержат два атома элемента. Несмотря на правильность этой теории, мы будем несколько разочарованы, когда сравним полученные объемы газов. Кислорода будет мало, так как часть его соединится с углеродом электрода. Для точных исследований необходимо применять электроды из благородного металла (лучше всего платины). |

Электролиз воды |

|
|
Если при электролизе использовать достаточно мощный источник тока (например, аккумулятор), то можно получить значительные количества обоих газов и провести с ними простые опыты.
В наполненной водородом пробирке осуществим пробу на гремучий газ. Вообще, она дает отрицательный результат, и полученный чистый водород сгорает спокойно. Правда, можно получить и положительную реакцию - если водород смешивается с растворенным в воде пневматической ванны кислородом. Это может произойти при неосторожном насаживании пробирок или, чаще всего, при близком расположении электродов. Кислород легко обнаружить с помощью тлеющей лучины. Зажжем деревянную лучинку, оставим ее некоторое время гореть на воздухе, затем потушим пламя, быстро дунув на него. Тлеющий, обугленный конец лучины введем в пробирку с кислородом. Мы увидим, как тлеющая лучина воспламенится. Будем продолжать исследования до тех пор, пока в пробирках есть газ. С помощью нашего электролизного устройства мы можем также получить чистый гремучий газ и взорвать его. Для этого толстостенный стакан, наполненный водой, поместим одновременно над обоими электродами. Во время электролиза в нем соберется смесь кислорода и водорода. Как только стакан начнет наполняться, осторожно приблизим его, отверстием вниз, к пламени бунзеновской горелки. Последует сильный хлопок и стенки сосуда увлажнятся. Из отдельных элементов в результате реакции соединения мы получили воду. Только проводить этот опыт нужно непременно в защитных очках! Во избежание несчастного случая перед опытом нужно проинструктироваться у знающего специалиста. Кроме того, получать газовую смесь можно только в небольшом количестве, используя в самом крайнем случае стакан вместимостью не более 250 мл. Стакан обмотаем влажной плотной тканью (лучше полотенцем), чтобы не пораниться, если его разорвет. И еще: прежде чем поджигать смесь, в целях предосторожности откроем рот, чтобы защитить барабанные перепонки. Учтите также, что электролитическое получение водорода зачастую сопровождается взрывами. Это гремучий газ самовоспламеняется под действием электрической искры или каталитически действующих примесей. По этой причине можно получать только небольшие количества газа и во время опыта держаться на достаточном расстоянии. |

|
|
Вещества считаются особо чистыми, если они представляют собой однородные, достаточно крупные и хорошо сформированные кристаллы. Загрязненные вещества не образуют кристаллов вообще или они получаются мелкие и неправильной формы. Конечно, это не означает, что каждое некристаллическое вещество загрязнено. А как раз самые большие и прекрасные кристаллы часто содержат кристаллизационную воду, которая связана в кристалле и может быть удалена только с большом трудом; при этом кристаллы разрушаются. Кристаллизационную воду химики не относят к загрязнениям химического соединения. Во всех опытах, однако, если мы хотим получить количественно правильные результаты, нужно учитывать наличие кристаллизационной воды в твердых веществах. Например, голубые кристаллы медного купороса [сульфата меди (II)] содержат до 30 % воды, а так называемая кальцинированная сода (карбонат натрия) - даже 60 %. Следовательно: в 100 г кристаллического сульфата меди содержится только 64 г безводной соли, а покупая 1 кг кальцинированной соды, мы приобретаем воды в два раза больше, чем соды.
Внесем в термостойкую хорошо высушенную пробирку какую-нибудь соль (на кончике ножа) и нагреем ее сначала слабо, а затем сильнее на пламени бунзеновской горелки. Возьмем, например, сульфат меди, карбонат натрия, хлорид магния, хлорид натрия (поваренную соль) и другие соли. В большинстве случаев кристаллы растрескаются, а в верхней холодной части пробирки появятся капельки воды. Из указанных солей только чистая поваренная соль не содержит кристаллизационной воды. После нагревания сульфата меди остается белый осадок безводной соли, голубая окраска полностью исчезает с уходом кристаллизационной воды. Соли кобальта, присоединяя кристаллизационную воду, меняют цвет с голубого на красный. Можем проделать это с несколькими кристалликами хлорида кобальта (II) - вначале нагреть соль в пробирке, а затем поместить ее во влажный воздух. |
Кристаллы медного купороса |
Комната, покрытая кристаллами медного купороса (Лондон) |
|
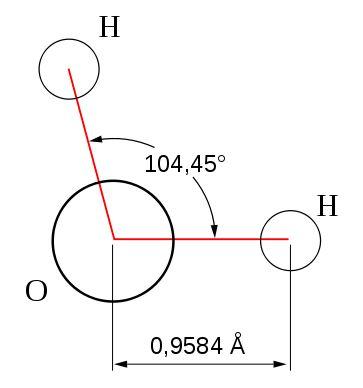
В молекуле воды связи, идущие от центра атома кислорода к обоим атомам водорода, образуют угол около 104°.
Как известно, атомы в соединениях склонны к образованию заполненных электронных оболочек. В нашем случае (с водой) это означает, что оба электрона связи водорода притянуты к кислороду, который более электроотрицателен. Но речь здесь идет не о полной ионизации, а о смещении центра тяжести заряда, когда образуется соединение частично ионного характера. В результате молекулы воды приобретают свойства электрического диполя с отрицательным концом на атоме кислорода, а положительным - на атомах водорода. Эта особенность имеет огромное практическое значение, так как многие по сравнению с другими жидкостями необычные свойства воды обусловлены природой диполя. Так, молекулы воды легко образуют тетраэдрическую структуру. Это упорядочение, которое усиливается ниже 4° С, объясняет, почему вода обладает минимальной плотностью при 4° С, а пористость молекулярной структуры льда примерно на 10 % больше, чем у жидкой воды. Большое внешнее давление не препятствует увеличению объема при замерзании - в этом с досадой убеждаются шоферы, поглядев на размороженный мотор или радиатор. Воспроизведем этот процесс: пузырек из-под лекарства до краев наполним водой, плотно закроем завинчивающейся крышкой и поставим на мороз или в морозильник. Соединение молекул воды можно представить себе как притяжение разноименно заряженных концов диполей. Атомы водорода соединены с двумя намного большими атомами кислорода специфической связью ионного характера, которую называют мостиковой водородной связью. Вследствие своего дипольного характера молекулы воды в особенной степени обладают способностью к адсорбции (присоединению) на поверхностях раздела. Большинство твердых веществ во влажном воздухе покрыто только мономолекулярным адсорбционным слоем воды. На стеклах благодаря присоединению молекул воды силикатами щелочных металлов образуются поверхностные пленки, в которых вода довольно прочно связана. Давайте убедимся в этом. В круглодонную колбу положим несколько кристалликов обезвоженного хлорида кобальта (II) и закроем колбу куском ваты. При нагревании на проволочной сетке в пламени бунзеновской горелки до температуры свыше 150 °С выделится значительное количество адсорбированной воды, которая при охлаждении частично поглотится хлоридом кобальта (II) и изменит его цвет с голубого на красный. Эффект проявится еще более отчетливо, если мы поместим в колбу немного толченого стекла или стеклянной ваты. При дальнейшем нагревании до температуры свыше 300 °С из стекла вновь выделяется вода, поэтому стеклянные части высоковакуумной аппаратуры отжигают до температуры размягчения. |
|
Молекула воды |

Айсберг |

|

|
|
Сегодня мы очень хорошо знаем земную атмосферу, толщина которой составляет более 1000 км. Воздушные шары с людьми и без них, самолеты и ракеты поднялись на большую высоту воздушного пространства и определили количественное содержание бактерий, давление, плотность и состав воздуха. А искусственные спутники Земли посылают на землю точные результаты измерений.
Тот, у кого есть глобус диаметром 35 см, может представить себе вокруг него двухсантиметровый слой, и получит, таким образом, представление о величине атмосферы. Атмосфера нашей планеты весит 5,1·1013 меганьютонов, а объем ее составляет более, чем 4·1018 м3. В воздухе содержатся величайшие ценности. Физики и химики размышляют над проблемой их использования. Линде, например, технически реализовал теоретические работы Андрюса, Фарадея, Джоуля и Томсона и развил методы сжижения воздуха. Жидкий воздух является важнейшим источником для получения кислорода, азота и инертных газов. Габер и Бош разработали метод, с помощью которого азот воздуха можно связать с водородом. То, что еще в прошлом столетии казалось утопией, например получение удобрений, кислот и других химических соединений из воздуха, в последние шестьдесят лет стало реальностью. До конца XVIII века считали, что воздух состоит из одного простого вещества. Только Пристли и Лавуазье, благодаря исследованию процессов сгорания, пришли к выводу, что воздух представляет собой смесь двух элементов. Более, чем через сто лет Рэлей и Рамзай открыли в воздухе другие элементы - инертные газы. Сухой воздух имеет следующий состав (по объему):
Гелий до сих пор получали из природного газа. Этот негорючий газ в большом количестве расходовали на заполнение аэростатов и воздушных шаров. Смесью кислорода и гелия дышат водолазы при работе на большой глубине. Ее применяют также для лечения больных астмой. Другие инертные газы получают при многократном ступенчатом испарении жидкого воздуха. Неоном, например, заполняют лампы дневного света и светящиеся трубки реклам, при пропускании электрического тока он излучает интенсивный оранжевый свет. Инертные газы для заполнения люминесцентных и специальных ламп с металлической нитью (например, криптоновых) получаются в качестве ценных побочных продуктов на всех больших предприятиях, которые производят технические газы с помощью сжижения воздуха. В защитной атмосфере аргона проводят сварку, к месту работ его доставляют в баллонах под давлением. |

Верхние слои атмосферы |
|
Кислород - самый распространенный элемент. Наша атмосфера, как вы уже знаете, содержит 21 % (об.) кислорода: исследованные 16 км земной коры - литосфера - состоит наполовину из кислорода, а водный бассейн - гидросфера - на 89 % (по массе).
Растения, животные и человек нуждаются в кислороде, так как от него зависит нормальное протекание жизненных процессов. В промышленности и технике он используется для окисления. Он содержится во многих химических соединениях. Чтобы получить чистый кислород, нужны исходные вещества, богатые этим элементом. К ним относятся нитраты и хлораты, то есть соли азотной и хлорноватой кислоты, а также пероксиды. В технике, где счет идет на тысячи тонн, используются широко распространенные сырьевые источники - воздух и вода. Необходимая для этого аппаратура очень сложна и дорога. В лабораториях, напротив, другие условия, так как в наших опытах часто имеем дело с объемами газов меньше миллилитра. Поэтому аппаратура в лаборатории должна быть дешевой и простой в обращении. Для небольших количеств, которые мы получаем, не имеет существенного значения высокая цена исходных продуктов. Укрепим пробирку из тугоплавкого стекла на штативе и внесем в нее 5 г порошкообразной селитры (нитрата калия KNO3 или нитрата натрия NaNO3). Поставим под пробирку чашку из огнеупорного материала, наполненную песком, так как при этом опыте стекло часто плавится и вытекает горячая масса. Поэтому и горелку при нагревании будем держать сбоку. Когда мы сильно нагреем селитру, она расплавится и из нее выделится кислород (обнаружим это с помощью тлеющей лучины - она воспламенится в пробирке). При этом нитрат калия перейдет в нитрит KNO2. Бросим затем тигельными щипцами или пинцетом кусок черенковой серы в расплав (никогда не держать лицо над пробиркой). Сера воспламенится и сгорит с выделением большого количества тепла. Опыт следует проводить при открытых окнах (из-за получающихся окислов серы). Полученный нитрит натрия сохраним для последующих опытов. Процесс протекает следующим образом: 2KNO3 => 2KNO2+ О2
Можно получить кислород и другими методами. Перманганат калия КМnО4 (калийная соль марганцевой кислоты) отдает при нагревании кислород и превращается при этом в оксид марганца (IV): 4КМnО4 => 4MnO2 +2К2O+3O2
(Эту реакцию правильнее было бы изобразить так: 2КМnO4 => МnO2 + К2МnО4 + O2. - Прим. ред.) Из 10 г перманганата калия можно получить примерно литр кислорода, значит двух граммов достаточно, чтобы наполнить кислородом пять пробирок нормальной величины. Перманганат калия можно приобрести в любой аптеке, если он отсутствует в домашней аптечке. Некоторое количество перманганата калия нагреем в тугоплавкой пробирке и уловим в пробирки выделяющийся кислород с помощью пневматической ванны. Кристаллы, растрескиваясь, разрушаются, и, зачастую некоторое количество пылеобразного перманганата увлекается вместе с газом. Вода в пневматической ванне и отводной трубке в этом случае окрасится в красный цвет. После окончания опыта очистим ванну и трубку раствором тиосульфата (гипосульфита) натрия - фотофиксажа, который немного подкислим разбавленной соляной кислотой. В больших количествах кислород можно также получить из пероксида (перекиси) водорода Н2О2. Купим в аптеке трехпроцентный раствор - дезинфицирующее средство или препарат для обработки ран. Пероксид водорода малоустойчив. Уже при стоянии на воздухе он разлагается на кислород и воду: 2Н2O2 => 2H2O + О2
Разложение можно существенно ускорить, если добавить к пероксиду немного диоксида марганца МnО2 (пиролюзита), активного угля, металлического порошка, крови (свернувшейся или свежей), слюны. Эти вещества действуют как катализаторы. Мы можем в этом убедиться, если в маленькую пробирку поместим примерно 1 мл пероксида водорода с одним из названных веществ, а наличие выделяющегося кислорода установим с помощью пробы лучинкой. Если в химическом стакане к 5 мл трехпроцентного раствора пероксида водорода добавить равное количество крови животного, то смесь сильно вспенится, пена застынет и вздуется в результате выделения пузырьков кислорода. Затем испытаем каталитическое действие 10%-ного раствора сульфата меди (II) с добавкой гидроксида калия (едкого кали) и без нее, раствора сульфата железа (II), раствора хлорида железа (III) (с добавкой железного порошка и без него), карбоната натрия, хлорида натрия и органических веществ (молока, сахара, размельченных листьев зеленых растений и т. д.). Теперь мы на опыте убедились, что различные вещества каталитически ускоряют разложение пероксида водорода. Катализаторы повышают скорость реакции химического процесса и при этом сами не расходуются. В конечном итоге они снижают энергию активации, необходимую для возбуждения реакции. Но существуют и вещества, действующие противоположным образом. Их называют отрицательными катализаторами, антикатализаторами, стабилизаторами или ингибиторами. Например, фосфорная кислота препятствует разложению пероксида водорода. Поэтому продажный раствор пероксида водорода обычно стабилизирован фосфорной или мочевой кислотой. Катализаторы необходимы для многих химико-технологических процессов. Но и в живой природе во многих процессах участвуют так называемые биокатализаторы (энзимы, ферменты, гормоны). Так как катализаторы не потребляются в реакциях, то они могут действовать уже в малых количествах. Одного грамма сычужного фермента достаточно, чтобы обеспечить свертывание 400-800 кг молочного белка. Особое значение для работы катализаторов имеет величина их поверхности. Для увеличения поверхности применяют пористые, испещренные трещинами вещества с развитой внутренней поверхностью, напыляют компактные вещества или металлы на так называемые носители. Например, 100 г платинового катализатора на носителе содержит только около 200 мг платины; 1 г компактного никеля имеет поверхность 0,8 см2, а 1 г порошка никеля - 10 м2. Это соответствует отношению 1 : 100 000; 1 г активного глинозема обладает поверхностью от 200 до 300 м2, для 1 г активного угля эта величина составляет даже 1000 м2. В некоторых установках катализатора - на несколько миллионов долларов. Так, бензиновая контактная печь в Белене высотой 18 м содержит 9-10 тонн катализатора. |

Тропический лес |
|
Применим собранный кислород для опытов по окислению. Внесем в наполненные кислородом пробирки небольшие, по возможности тонкоизмельченные, пробы свинца, меди, алюминия, цинка и олова и неплотно закроем пробирки ватой. При нагревании металлы сгорят с появлением яркого пламени; в пробирках останутся оксиды.
В чистом кислороде сгорит также тонкая железная проволока. Придадим ей спиралеобразную форму и укрепим на одном из концов пропитанного парафином куска дерева, который подожжем. Проволоку как можно скорее внесем в широкий химический стакан, наполненный кислородом. Чтобы стакан не дал трещину из-за падающих горячих частиц, необходимо погрузить дно стакана в слой песка или воды. Проволока сгорит с появлением ярких разлетающихся искр, в результате образуется оксид железа (II, III), так называемая окалина: 3Fe + 2O2 => Fe3O4
Кислород - газ без цвета, запаха и вкуса, частично растворимый в воде; 1 литр кислорода при 0 °С и 760 мм рт. ст. весит 1,429 г. Следовательно, кислород тяжелее воздуха (1 л воздуха при тех же условиях весит 1,293 г). Почти со всеми металлами и неметаллами кислород образует оксиды. |

Горение железа в кислороде angelo.edu |

|

|

|

|

|

|

|
|
В природе кислород встречается в виде двухатомных молекул. Атомарный кислород О обладает чрезвычайно сильной окислительной способностью. Он получается при разложении озона, молекула которого содержит три атома кислорода:
О3 => О2 + О
Если на налитую в фарфоровую чашку концентрированную серную кислоту насыпать немного тонкораспыленного перманганата калия, образуется озон. (Надеть защитные очки! Взрывоопасно!) Будем держать над чашкой: а) кусок крахмальной бумаги, смоченной иодидом калия, б) полоску лакмусовой бумажки. Из йодида калия выделится йод, который окрасит крахмальную бумагу в синий цвет (йодокрахмальная реакция); лакмусовая бумажка обесцветится. Наконец, погрузим на стеклянной палочке в смесь серной кислоты и перманганата немного ваты, пропитанной спиртом или скипидаром. Вата со взрывом сгорит. В высоких (30-45 км) слоях воздуха, в так называемой озоносфере, озон возникает под влиянием ультрафиолетовых лучей или при грозе, а в технике он чаще всего получается в результате тихого электрического разряда в озонаторе. Его используют для дезинфекции и озонирования воздуха в помещениях (больницах, холодильных камерах), а также для обеззараживания питьевой воды. |
Озонатор - прибор для получения озона |
|
Если бы в начале нашего века учитель географии в немецкой гимназии спросил своего ученика о Лёине, то он едва ли получил бы удовлетворительный ответ. В то время Лёйна была деревней в государственном округе Мерзебург и насчитывала около трехсот жителей. В географической книге 1899 г. говорится, что там расположены залежи бурого угля, который может быть использован для получения прессованного торфа, горного воска (парафина) и нефти - "солярового масла".
Нынешний ученик на такой же вопрос учителя без особого труда ответит, что Лёйна лежит на участке железнодорожного пути Мерзебург - Гросскорбета и там находится крупнейшее химическое предприятие республики [2]. Лёйна стала известна в последние годы. История предприятия Лёйны одновременно является и частью немецкой истории. Она началась во время первой мировой войны и, казалось, ей суждено было закончиться во время второй. В 1908 г. руководитель института физической химии и электрохимии в технической высшей школе в Карлсруэ доктор Габер пригласил в качестве сотрудника Карла Боша, который потом возглавил отделение по получению азота на анилиновой и содовой фабрике Бадена. Вместе с доктором Митташем и инженером Лаппе они с 1909 по 1912 г. провели в специально оборудованной лаборатории более 10 000 опытов с целью соединить азот воздуха с водородом в присутствии катализатора. В результате этой реакции образуется аммиак - исходный продукт для многих видов взрывчатых веществ и искусственных удобрений. Так был разработан способ Габера - Боша. Карл Бош выбрал место для большой установки аммиачного синтеза. 28 мая 1916 г. в Мерзебурге началось строительство завода по производству аммиака. В это время на западном фронте с незатухающей силой бушевали сражения. Через одиннадцать месяцев после первого удара лопатой, 27 апреля 1917 г., предприятие отправило первые цистерны с аммиаком - новым сырьем для смертоносной войны. Рабочие Лёйны, устраивая массовые забастовки, повели решительную борьбу против войны. Завод в Лёйне непрерывно расширялся. Аммиак был уже не единственным продуктом. Через два года после пуска началось производство сульфата аммония, в 1923 г. стали получать метанол, а с 1927 г. - бензин. В 1945 г. казалось, что огромное предприятие навсегда умерло - 10 000 бомб, сброшенные во время 23 налетoв, разрушили его на 80 %. Благодаря советской помощи оно возродилось снова, сначала как предприятие советского государственного акционерного общества по получению минеральных удобрений. В 1954 г. оно стало всенародным достоянием, и с тех пор его мощность, благодаря рационализации и расширению производства, неизменно увеличивалась. Установки завода занимают площадь в 4 км2. На две расположенные в 1,7 км друг от друга железнодорожные станции Завод Лёйна-север и Завод Лённа-юг ежедневно прибывает более 32 тысяч трудящихся, 13 гигантских дымовых труб, градирни и ректификационные колонны, длинные ангары и бункеры определяют силуэт завода. Наряду с таким важным сырьем, как бурый уголь, все больше возрастает роль нефти. В химические центры республики это важное сырье поступает по нефтепроводу "Дружба", протянувшемуся из Советского Союза через Польшу в Восточную Германию. Тысячи тонн более чем 400 видов основных и промежуточных химических продуктов, начиная с топлива и кончая сырьем для пластмасс, получают из нефти, воздуха и воды. При переработке нефти выделяются также многие неорганические химикаты. Аммиак и азотная кислота служат для получения удобрений и других продуктов. С 1 февраля 1966 г. Лёйна приобрела особое значение. Начали давать продукцию установки первой очереди Лёйны II - первой нефтехимической базы Восточной Германии. На площади 200 га было построено около 2000 действующих установок, которые обслуживают 2100 рабочих. Здесь получают этен (этилен), полиэтилен высокого давления, капролактам, фенол. Здесь же осуществляется крекинг бензина. Завод Лёйна II работает с высокой производительностью. Каждый рабочий на этом предприятии производит в 6 раз больше продукции, чем его коллега на заводе Лёйна I. Предприятие чрезвычайно способствовало достижению Восточной Германией мирового уровня в области нефтехимии. _____________________________________________________ 2 На заводах Лёйны было организовано одно из первых производств аммиака по реакции: N2 + 3H2 < = > 2NH3. Эта реакция носит обратимый характер, сдвигается в сторону образования NH3 лишь при высоких давлениях. Реализация технологического способа синтеза аммиака явилась заключительным этапом многолетней работы многих ученых по решению проблемы связанного азота. В процессе изучения этой реакции удалось кроме практически важного результата выяснить многие важнейшие вопросы, связанные с теорией химических реакций (сдвиг равновесия под влиянием температуры и давления, действие катализатора и др.) - Прим. ред. |


|

Заводы синтетического аммиака |

|
|
По способу Габера-Боша из воздуха, водяного пара и бурого угля (или буроугольного кокса) либо используя газификацию масел нефтяных остатков получают смесь азота и водорода. После очистки (удаления серы, оксида и диоксида углерода) на смешанном катализаторе при давлении 240 кгс/см2 и температуре 420-610 °С смесь превращается в аммиак:
N2+ 3H2 < = > 2NH3 + Q
Наибольший экономический эффект дает использование для синтеза отходов от процессов переработки нефти. Аммиак - бесцветный газ. Он раздражает дыхательные пути, а в больших концентрациях ядовит. Аммиак легче воздуха, 1 л газа весит 0,7709 г. Он чрезвычайно хорошо растворяется в воде, и в этом мы сейчас убедимся на опыте. Из продажного 25%-ного раствора аммиака (гидроксида аммония, NH4OH, нашатырного спирта) выделим при нагревании аммиак, который соберем в сухую круглодонную колбу. (Ни в коем случае нельзя использовать плоскодонную или эрленмейеровскую колбу! Эти сосуды не выдерживают вакуума и взрываются. Для этого опыта удобно также использовать нижние части склянок для промывания газов.) Затем закроем колбу резиновой пробкой, в отверстие которой вставлена оттянутая на конце стеклянная трубка. Большой химический стакан наполним водой с несколькими каплями фенолфталеина. Многократно погружая горлышко колбы в этот раствор, попытаемся ввести внутрь колбы через трубку несколько капель воды. Благодаря большой растворимости аммиака (в 1 объеме воды при 20 °С растворяется 702 объема аммиака) большая часть газа растворится. В колбе возникнет разрежение, и внешнее давление воздуха выбросит с большой силой воду из химического стакана в колбу. Красная окраска индикатора в колбе указывает на наличие там основной среды. |

Аммиачный фонтан job-stiftung.de |

|

|

|

|

|

|
|
С помощью каталитического окисления (метод Оствальда) можно перевести аммиак в азотную кислоту. На химическом комбинате Биттерфельд, смесь аммиака и воздуха с большой скоростью пропускают над платино-кобальтовым катализатором. Возникающий при этом бесцветный монооксид азота NO сначала превращается на воздухе в коричневый диоксид азота NO2, а затем при действии кислорода и воды - в азотную кислоту:
4NH3 + 5O2 => 4NO + 6H2O
Мы же соберем установку, изображенную на рисунке. 4NO+ 2O2 => 4NO2 4NO2 + O2 + 2Н2О => 4HNO3 Для того, чтобы приготовить катализатор, добавим по каплям раствор хлорида железа (III) к раствору гидроксида аммония. При этом выпадает коричневый осадок гидроксида железа (III). Отфильтруем его, промоем на фильтре холодной водой, смешаем сырую еще массу с асбестом (можно отщипнуть волокна от подставки под утюг, использовать кусочек асбестового шнура и т.п.) и сильно прокалим массу. При этом на асбесте выделится оксид железа (III). Пропустим сначала через установку поток воздуха (кран I открыт, кран II закрыт) с помощью водоструйного насоса (в крайнем случае, достаточно применить для отсоса воздуха резиновый вентилятор) и сильно нагреем катализатор. Затем закроем кран I и откроем кран II. Поток воздуха увлекает аммиак, который после сушки в U-образной трубке с негашеной известью СаО окисляется на катализаторе с образованием оксида азота. А он, взаимодействуя в конической колбе (так называемая колба Эрленмейера) с кислородом воздуха, превращается в диоксид. Наконец, в пробирке с боковой насадкой образуется азотная кислота. Хотя она очень разбавлена, мы можем обнаружить кислую среду с помощью лакмусовой бумажки, а наличие нитрат-иоиов - как описано в разделе "Анализ минеральных удобрений". Азотная кислота - бесцветная, очень едкая жидкость. Концентрированная кислота, 69,2%-ная HNO3 с плотностью 1,41 г/см3, относительно легко отдает кислород. Поэтому она является сильным окислителем. Благодаря этому свойству она растворяет различные неактивные металлы, такие как медь, ртуть и серебро. Золото она не разрушает, поэтому можно отделить золото от серебра с помощью азотной кислоты. Однако смесь одной объемной части концентрированной азотной кислоты и трех объемных частей соляной кислоты - царская водка - растворяет и золото и платину. Если мы хотим получить азотную кислоту более высокой концентрации, то смешаем в реторте 56 г сухой тонкораспыленной калийной селитры КNО3 с 32 мл концентрированной серной кислоты и перегоним получившуюся кислоту в хорошо охлаждаемый сборник. Если реторта с тубусом, закроем его корковой пробкой, обернутой алюминиевой фольгой. Горло реторты опустим как можно глубже в сборник, который будем охлаждать в стакане с ледяной водой или в проточной водопроводной воде. Для этой цели поместим сборник в воронку и укрепим над ретортой шланг, в который подается холодная вода. Из воронки с помощью шланга отведем холодную воду в ведро или раковину. На окончание опыта укажет выделение коричневых ядовитых паров NO2: 2KNO3 + Н2SО4 => К2SО4 + 2HNO3
Раньше азотную кислоту только таким методом и получали. Исходным продуктом служил встречающийся в Чили в больших количествах нитрат натрия NaNO3 (натриевая, или чилийская селитра).
|

Черкасский завод "Азот" - производит аммиак, азотную кислоту, аммиачную селитру, карбамид и другие важные продукты |
|
Тот, кто после напряженной работы или длительной прогулки по пыльной улице отведает лимонаду или газированной воды, ощутит освежающее действие этих напитков. Любителям газированных напитков необходим сифон, знаток восхваляет устойчивую пену пива, весело играет шампанское в бокалах на праздничном столе. Крошечные пузырьки газа разрыхляют тесто, благодаря ним булочки становятся мягкими. Во всех случаях здесь действует один и тот же углекислый газ (диоксид углерода). Тысячи кубических метров этого газа ежедневно выбрасываются из дымовых труб. В природном круговороте веществ он играет решающую роль, на нем основаны многие химические процессы, а в твердом виде он представляет собой чрезвычайно распространенное охлаждающее средство - сухой лед.
С помощью нескольких опытов мы можем познакомиться с важнейшими свойствами диоксида углерода, который является ангидридом угольной кислоты: Н2О + СО2 < = > Н2СО3
Известно, что многие кислоты образуются в результате взаимодействия оксидов неметаллов с водой. Ангидриды - это химические соединения, которые возникают из других соединений при отделении воды, и, наоборот, переходят в исходные соединения при поглощении воды. Угольная кислота в чистом виде не существует. Равновесие изображенной выше реакции сильно сдвинуто в сторону исходных продуктов. Угольная кислота диссоциирует в две стадии и образует сначала гидрокарбонат-, затем карбонат-ионы: Н2СО3 < = > Н+ + НСО3-
Соответствующие соли называются гидрокарбонаты и карбонаты. Сложим оба равенства, в результате получим: НСО3- < = > Н+ + СО32- H2CO3 < = > 2H+ + CO32-
Если записать равновесие диссоциации в виде закона действия масс, то константа диссоциации будет иметь вид: K=C2(H+)·C(CO32-)/C(H2CO3)
причем ее точное значение при 25 °С составит 2,4·10-16 моль2/л2. Из этого следует, что угольная кислота относится к слабым электролитам, то есть к таким, чья константа диссоциации меньше 10-4 моль2/л2.
|

Сухой лед (твердый диоксид углерода) |

|

При действии горячей воды сухой лед дает много тумана. Еще лучше использовать для этой цели жидкий азот |

|
|
Диоксид углерода можно получить из солей угольной кислоты (карбонатов), если вытеснить его с помощью более сильных кислот. В технике его получают при обжиге извести, т. е. в результате нагревания известняка при температуре примерно 1000 °С:
СаСО3 (известняк) => CaO (жженая известь) + CO2 [температура около 1000 °С].
В лабораторных условиях применим самый дешевый способ. Для этого в аппарате для получения газов, например в аппарате Киппа, зальем кусочки мрамора (карбоната кальция CaCO3) 20 %-ным раствором соляной кислоты: СаСО3 + 2НСl => CaCl2 + H2O + СО2
Само собой разумеется, что пригодны и другие карбонаты: сода (карбонат натрия Na2CO3), поташ (карбонат калия К2СО3), питьевая сода (гидрокарбонат натрия NaHCO3), и ряд кислот, в том числе даже относительно слабые - уксусная, винная и лимонная. Полученный в аппарате диоксид углерода уловим в пневматической ванне или лучше вытеснением воздуха. Диоксид углерода тяжелее воздуха, 1 л его при 0 °С и 760 мм рт. ст. весит 1,977 г, поэтому им можно наполнить стоячий сосуд, опустив газоотводную трубку на самое дно сосуда. Так как горящая лучина гаснет в атмосфере углекислого газа, то таким образом можно проверить, наполнился ли наш сосуд. Есть простое правило, которое помогает узнать, легче газ воздуха или тяжелее. Условимся число 29 считать относительной молекулярной массой воздуха и сравним молекулярные массы (М) газов с этой величиной. Например, молекулярная масса метана СН4 = 16, значит, метан легче воздуха; для азота N2 (М = 28), т. е. азот немного легче воздуха, a SO2 (М = 64) и СО2 (М = 44) значительно тяжелее воздуха. |

Аппарат Киппа - прибор для получения газов |
|
Диоксид углерода образует при взаимодействии с известковой водой осадок карбоната кальция, который при дальнейшем действии газа переходит в растворимый гидрокарбонат кальция:
Са(ОН)2 + СО2 => СaСО3 (нерастворим) + H2O
Для того чтобы получить известковую воду, зальем водой в химическом стакане негашеную или гашеную известь (защитить глаза!) и профильтруем отстоенный раствор или бросим кусочек карбида кальция в химический стакан с водой и после прекращения выделения газа профильтруем раствор. СаСО3 + Н2O + СО2 => Са(НСО3)2 (растворим) Даже незначительные количества солей угольной кислоты можно обнаружить с помощью следующей пробы: в маленькую пробирку введем несколько частичек карбоната и 2 капли соляной кислоты. Образовавшийся над жидкостью газ отсосем пипеткой (только не ртом, так как выдыхаемый воздух тоже содержит СО2!) и выпустим его во вторую пробирку с известковой водой. Как мы уже установили, углекислый газ в 1,5 раза тяжелее воздуха. Поэтому его можно "переливать", как воду, например. Наполним химический стакан углекислым газом, и осторожно, чтобы не "промахнуться", перельем невидимый газ во второй стакан. Там обнаружим его с помощью пробы лучинкой. Дым от погасшей лучины повиснет в СО2. Можно до переливания сделать газ видимым. Для этого добавим в стакан с газом две капли концентрированной соляной кислоты и две капли концентрированного гидроксида аммония (нашатырного спирта), затем осторожно перемешаем стеклянной палочкой образовавшийся туман хлорида аммония (нашатыря) с диоксидом углерода. Для забавы можно потушить в нем горящую свечку. Наполним широкий сосуд (чашку) углекислым газом до половины и будем выдувать мыльные пузыри таким образом, чтобы они с небольшой высоты падали на газ. После нескольких неудачных попыток нам удастся получить мыльный пузырь, который плавает на газе. Раствор для мыльных пузырей приготовим из жидкого мыла, которое смешаем с холодной дистиллированной водой и куда через несколько часов добавим несколько капель пропантриола (глицерина). Наполним пробирку углекислым газом, вольем 1-2 мл раствора едкой щелочи (гидроксида калия или натрия), тотчас закроем пробирку смоченным большим пальцем и встряхнем ее. (Осторожно! Не разбрызгивать щелочь! Сразу же после опыта вымыть руки!) Пробирка свободно повисает на пальце. Не отнимая пальца, перевернем ее, опустим в воду отверстием вниз и откроем. Вода устремится в пробирку и заполнит большую ее часть. Диоксид углерода взаимодействует со щелочами с образованием карбонатов, в результате в пробирке образуется вакуум. Внешнее давление воздуха прочно прижимает пробирку к пальцу. Эту реакцию применяют, если необходимо удалить диоксид углерода из газовой смеси. Смесь пропускают через большое количество промывных склянок, наполненных щелочью. Посмотрим, как газируется вода в сифоне. Насадим баллончик затворной стороной (алюминиевой пластинкой) на острие сапожного гвоздя, обернем тонкой хлопчатобумажной тканью (носовым платком) и сильно ударим молотком по дну патрона. Газ выделится с сильным шипением, белые пары пройдут через поры ткани, а в самом платке останется белый осадок - твердый диоксид углерода, так называемый сухой лед. Диоксид углерода можно сжижать под давлением при температуре ниже +31,3 °С (критическая температура). Жидким CO2 заряжены баллоны. Когда при ударе пробивается затворная пластина, СО2 выходит и испаряется очень быстро. Благодаря работе, производимой при испарении и расширении, газ очень сильно охлаждается, и часть его конденсируется. Сухой лед нельзя сжимать пальцами (обмораживание кожи!). Остерегайтесь, чтобы ни малейшей крупинки не попало в глаза. При работе снять с рук кольца! Сухой лед применяется, прежде всего, для охлаждения пищевых продуктов. Холода от него вдвое больше, чем от обычного льда, а кроме того, он удобен тем, что испаряется без остатка. У продавца мороженого обычно можно попросить сухой лед и провести с ним несколько интересных опытов. Наполним бутылку из-под пива или лимонада на четыре пятых фруктовым соком или водой, бросим внутрь кусочек сухого льда, тотчас закроем, подождем несколько минут и затем сильно взболтаем. Получится газированный напиток. (Ни в коем случае не брать много сухого льда, так как бутылка может взорваться, достаточно кусочка величиной с горошину. В целях безопасности обернем бутылку полотенцем.) Кусочек сухого льда бросим в наполненную на три четверти водой плоскодонную колбу (можно взять молочную бутылку или что-то похожее), затем закроем ее пробкой с отверстием. В отверстие вставим оттянутую на конце стеклянную трубку, которая вплотную доходит до дна сосуда. Вскоре вода будет сильной струей разбрызгиваться из трубки. Несколько кусочков сухого льда положим в полотняный мешочек и измельчим ударами молотка. (Надеть защитные очки!) Полученную массу смешаем в фарфоровой чашке с пропиловым спиртом или денатуратом до образования кашицы. В чашку положим кусок резинового шланга, цветок и небольшой плод. Температура охлаждающей смеси примерно -80 °С. Вытащенный резиновый шланг станет твердым и расколется, если по нему ударить молотком. Цветок и плод замерзнут и при падении на твердую поверхность разлетятся вдребезги. |

Огнетушитель |

|
| < Содержание > < Глава 1 > < Глава 2 > < Глава 3 > < Глава 4 > < Глава 5 > < Глава 6 > < Глава 7 > < Глава 8 > |