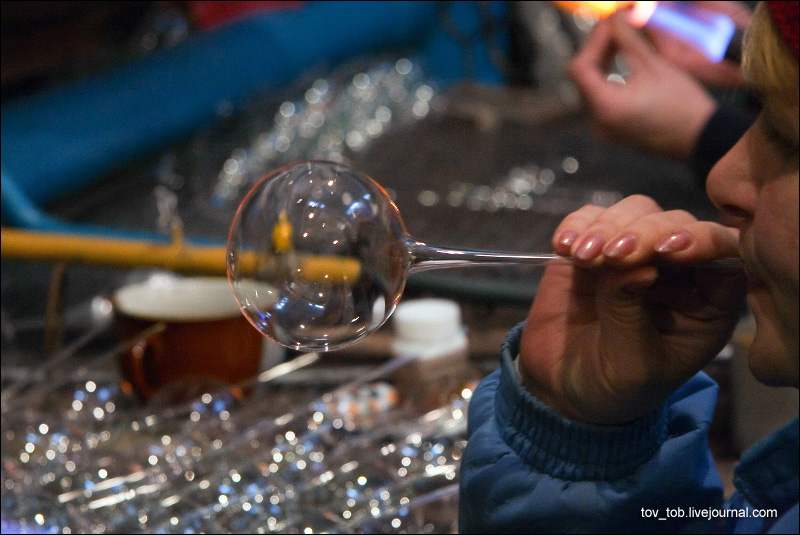Чтобы разрезать тонкую трубку, вначале сделаем в требуемом месте надрез трехгранным напильником или специальным ножом для резки стекла (из твердой стали). Затем возьмем трубку обеими руками как можно ближе к надрезу и так, чтобы надрез приходился как раз посередине. Надломим трубку, одновременно слегка растягивая ее. При этом трубку следует завернуть в кусок ткани, чтобы защитить руки от осколков стекла. После некоторой тренировки нам удастся резать трубки так, чтобы края у них были почти ровные. Эти острые края нужно еще оплавить, чтобы сгладить их. Для этого конец трубки поместим ненадолго в пламя горелки Бунзена. Неоплавленные концы трубок повреждают резиновые пробки и шланги, что часто приводит к неприятным последствиям.
Чтобы вставить стеклянную трубку в пробку или надеть на нее резиновый шланг, смочим конец трубки глицерином или, в крайнем случае водой, чтобы уменьшить трение. При этом свободный конец трубки, как правило, нужно оставлять коротким, иначе он образует длинное плечо рычага, и трубка легко ломается.
Толстые стеклянные трубки (диаметром более 25 мм) разрезать таким способом не удается. Нужно, чтобы они дали в требуемом месте круговую трещину. Для этого рекомендуется много способов, хотя все они не всегда дают хороший результат. (Для этой цели удобен самодельный электростеклорез, позволяющий обойтись без газовой горелки. См. И.Н. Чертков, И.А. Черняк, Ю.А. Колударов. Самодельные демонстрационные приборы по химии. М., "Просвещение", 1976. [ссылка] - Прим. перев.). Проще всего вначале сделать на трубке равномерный кольцевой надрез. Затем в несветящейся зоне пламени горелки нагревают стеклянную палочку до тех пор, пока конец ее не раскалится докрасна. При этом он размягчается до вязкотекучего состояния и окрашивает пламя в желтый цвет. Прижмем этот размягченный конец палочки к кольцевому надрезу. В результате резкого нагревания стекло обычно дает глубокую кольцевую трещину. В тонкостенной трубке часто можно получить такую трещину, если разогретое место затем быстро смочить капелькой воды. Таким же способом можно, например, отколоть дно от бутылки. Если повезет, края получатся ровными.
Чтобы согнуть трубку, нагреем ее до размягчения, но не слишком сильно. Трубка должна сгибаться уже под действием своего собственного веса, если держать ее за один конец. Разумеется, можно при этом держать ее и за оба конца. Вынем трубку из пламени и, сгибая ее, придадим ей требуемую форму.
Просто согнуть стеклянную трубку удастся каждому начинающему экспериментатору. А вот согнуть ее так, чтобы в месте сгиба не было сужения, складки, вздутия или других дефектов, не так-то просто - для этого требуется немалая тренировка. Важно поддерживать правильную температуру сгибания, прогревать трубку по всей окружности и на не слишком коротком участке, то есть при непрерывном и равномерном вращении.
При сгибании толстой трубки один конец ее нужно закрыть пробкой и после сгибания места сужения выровнять, вдувая в трубку воздух. Обычно вначале при этом получаются дырки - воздух вдувают слишком сильно.
Еще более толстые трубки и все крупные предметы из стекла, например, колбы, нужно предварительно равномерно нагревать при непрерывном вращении светящимся пламенем, чтобы они не лопнули. (Это общее правило, относящееся и к тонким трубкам. После обработки сильным пламенем стекло в конце операции прогревают светящимся пламенем, без подвода воздуха к горелке и оставляют медленно остывать. - Прим. перев). Согнутые трубки дают трещину, если их положить горячими на холодную подставку. Поэтому целесообразно изготовить пару деревянных подставок в виде брусков с выточенными канавками. Трубки нужно класть на подставку так, чтобы их горячая часть не касалась подставки и других предметов.
Для многих опытов нам понадобятся стеклянные трубки с оттянутым концом. Изготовить такую трубку нетрудно. Нагреем стекло до размягчения, вынем трубку из пламени, растянем ее и разрежем в месте сужения. В зависимости от температуры, до которой трубка была нагрета, а также от скорости растягивания мы получим трубку с длинным или коротким суженным концом.
Чтобы этот заостренный конец был не слишком тонким, нужно нагревать достаточно сильно и растягивать трубку совсем медленно, одновременно вращая ее. Если нам нужна аккуратно запаянная стеклянная трубка, то растягивать нужно быстро или в пламени. Тогда образуется тончайший капилляр, который легко заплавить. Затем мы можем нагреть этот конец трубки до размягчения и слегка подуть в нее.
При наличии паяльной горелки, интереса к стеклодувному делу и немалого терпения, можно попытаться перейти к более трудным операциям. Чтобы спаять трубки, нужно по возможности ровно обрезать их и соединяемые концы немного развернуть, то есть расширить, чтобы они приобрели форму воронки. Можно сделать это с помощью заостренного графитового стержня, который вы используете в качестве угольного электрода. При спаивании трубок разного диаметра одной из них сначала нужно дать немного сузиться в пламени. Оба конца одновременно нагревают, вынимают из пламени и прикладывают друг к другу. Затем вращением, нагреванием и размягчением, вытягиванием и поддуванием придают шву правильную форму. Если при этом появляются вздутия и отверстия, можно заварить их расплавленным концом стеклянной палочки. Недостаточный прогрев места спая и неровности в этом месте вызывают в стекле напряжения. В таких случаях через некоторое время в этом месте может появиться трещина.
Чтобы припаять одну трубку к другой под углом, в требуемом месте спая одну из трубок сильно нагревают до размягчения коротким пламенем паяльной горелки. Затем один конец этой трубки закрывают пробкой и дуют в трубку. В нагретом месте образуется пузырь с очень тонкой стеклянной оболочкой, которую легко можно удалить. В результате получается круглое отверстие. Его развертывают, придавая ему форму воронки (см. выше). Таким же образом развертывают конец той второй трубки, которую нужно припаять к первой. Конец второй трубки соединяют с отверстием первой и равномерно спаивают трубки, при поддувании выравнивая место спая. (Надежный спай получают, чередуя приемы нагревания, осаживания и поддувания. Более подробные сведения о работе со стеклом - см. М.М. Голь. Руководство по основам стеклодувного дела. Л., "Химия", 1974, [ссылка] - Прим. перев.). При этом два из трех концов спаиваемых трубок, разумеется, предварительно закрывают пробками.
Если нужно выдуть шар, то трубку оттягивают и заплавляют ее. При непрерывном вращении, наклонив трубку, сильно нагревают ее до тех пор, пока на конце не накопится достаточный излишек стекла. Затем вынимают трубку из пламени и, не прерывая вращения, слегка дуют в нее.
Все эти стеклодувные работы требуют, как мы уже говорили, немало терпения, так что вначале не обойдется без разочарований. Полезнее, чем слушать любые объяснения, понаблюдать за работой опытного стеклодува.
|