Химия и Химики № 7 2016
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 7 2016 Журнал Химиков-Энтузиастов |
Получение калия при невысоких температурах ч.1, 2, 3 Metallic potassium preparation at moderate temperatures Добрый химик |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Вступление
Щелочные металлы - литий, натрий и калий можно получить разными способами. Большинство из этих способов сводятся к двум группам: Introduction 1. Электролиз солей и гидроксидов; 2. Восстановлению соединений щелочных металлов такими восстановителями как алюминий, кальций и даже углерод и железо. Электролиз. Тут также возможно два варианта: 1. Электролиз расплавленных гидроксидов или солей щелочных металлов (высокая температура); 2. Электролиз неводных растворов солей этих металлов (комнатная температура или более низкая температура). Получить без проблем электролизом неводных растворов можно разве что литий. Например, для электролиза подходит раствор нитрата лития в ДМСО (диметилсульфоксид) [1] или в пиридине. Хотя, когда я написал "без проблем", - это было преувеличение: необходим инертный анод - платиновый или палладиевый. Если он есть, проведение электролиза не должно вызвать сложностей. Согласно литературным данным, натрий и даже калий также можно получить электролизом растворов их соединений в неводных растворителях (например, в ацетоне). Однако это скорее "ловкость рук", чем препаративный метод. В противном случае никто бы не проводил электролиз расплавленного хлорида или гидроксида натрия. Подробнее про получение щелочных металлов электролизом неводных растворов можно прочитать в книге: Фиалков Ю.Я., Грищенко В.Ф. Электровыделение металлов из неводородных растворов (1985) - С.138 и далее [ссылка]. Можно получить амальгамы щелочных металлов (т.е. их сплавы со ртутью) электролизом водных растворов их солей или гидроксидов с ртутным катодом, но отгонять ртуть из амальгамы с целью получения чистого щелочного металла - удовольствие ниже среднего. Натрий можно получить электролизом расплава хлорида или гидроксида натрия. Первый процесс требует высокой температуры (температура плавлення хлорида натрия 801°C), а во втором случае расплав агрессивен и дает едкий аэрозоль (хотя температура плавления гидроксида натрия гораздо ниже - 318°C). Если вы поставили задачу не собрать металлический натрий, а просто наблюдать за процессом его образования, эксперимент по электролизу расплавленного едкого натра не представляет сложностей [2] (при условии строго соблюдения техники безопасности). С электролизом расплава едкого кали - аналогично. Если металл необходимо собрать, катод делают со специальным колпачком: натрий образуется в расплаве, всплывает вверх (поскольку металлический натрий легче расплавленного едкого натра) и собирается под колпачком, который предохраняет расплавленный натрий от контакта с воздухом. Калий также можно получить электролизом (например, хлорида или гидроксида), но в литературе не рекомендуют использовать электролиз для получения металлического калия, т.к. выход низкий, а сам процесс опасен. В промышленности калий получают вытеснением калия натрием. В расплав хлорида калия подают пары натрия. Хотя натрий - менее активный металл, чем калий, последний имеет более низкую температуру кипения (температура кипения калия - 759°C, натрия - 883°C). - Как видите, разница между температурами кипения калия и натрия довольно существенная. Итак, в расплав хлорида калия подают пары натрия. В результате имеет место реакция: KCl + Na <=> NaCl + K Реакция обратима, но равновесие смещено в сторону образования калия (поскольку он более летучий компонент и его пары покидают зону реакции). Образуется смесь паров калия и натрия, которую подвергают разделению методом ректификации (в железных ректификационных колоннах). Остановимся на восстановлении натрия и калия алюминием, железом и углеродом. Хотя алюминий - менее активный металл, чем калий и натрий, но у последних двух металлов гораздо ниже температура кипения (алюминий кипит аж при 2470°C). Получение (в домашних условиях) металлического калия реакцией едкого кали и алюминия описал Иван Николаевич [3], аналогичная реакция в случае едкого натра и алюминия идет достаточно энергично. Принцип тот же, что и упомянутом выше случае, когда натрий вытесняет калий из его хлорида: не важно, какой металл активнее, важно, что один из металлов более летуч и покидает сферу реакции в виде пара (т.к. температура в реакторе выше температуры его кипения) - в результате равновесие сдвигается в сторону образования более активного металла. А менее активный металл переходит в соединение. Кстати, алюминий (и кальций) способны вытеснять не только натрий и калий, но даже рубидий и цезий - самые активные металлы (если не считать франций). Вместо едкого натра и едкого кали для получения металлических калия и натрия можно использовать и более безопасные исходные вещества - соду и поташ. Восстановителем в этом случае служил магний [4]. Я не ставил целью собрать металлические калий и натрий, поэтому проводил реакцию в стеклянных пробирках, но образование металлических калия и натрия было установлено четко. В XIX веке калий получали полукустарным способом, нагревая поташ с углем и мелом. Т.е. вместо алюминия или магния использовался гораздо более дешевый, хотя и менее активный восстановитель - углерод. Восстановителем для калия и натрия также может служить металлическое железо - металл гораздо менее активный, чем калий, натрий и их аналоги. Какой можно сделать вывод? В большинстве случаев щелочные металлы получают, либо электролизом расплавов их соединений, либо вытеснением щелочного металла из солей с помощью менее энергичных, но гораздо менее летучих восстановителей при сильном нагревании. Щелочной металл улетает в виде пара и конденсируется в приемнике. Все эти методы требуют высокой температуры. __________________________________________________ 1 См. обсуждение на форуме в теме: Получение лития электролизом [ссылка] 2 См. статью: Электролиз расплава едкого натра (образование и окисление натрия) [ссылка], аналогично проходит электролиз расплавленного едкого кали: Электролиз расплава едкого кали (образование и горение калия) [ссылка] 3 См. статью: Получение металлического калия в домашних условиях [ссылка] 4 См. статью: Реакция магния с поташом и содой ч.1 (Образование и горение паров калия) [ссылка] и Реакция магния с поташом и содой ч.2 (Образование и горение паров калия) [ссылка] |
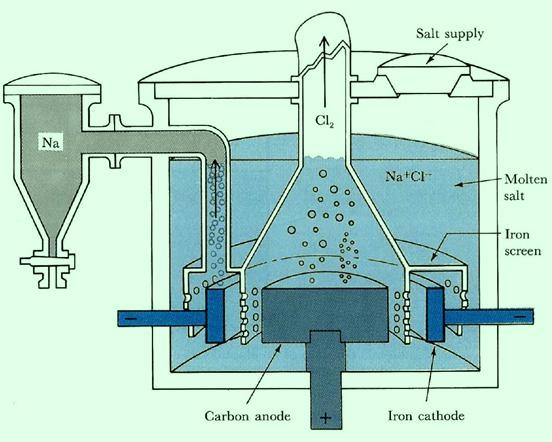
Электрохимическая ячейка для получения металлического натрия (электролизом расплава хлорида натрия в промышленных условиях) Electrolysis cell for molten sodium chloride (metallic sodium production)
|
Электрохимическая ячейка для получения металлического натрия электролизом (в домашних условиях) - sciencemadness.org Electrochemical cell for metallic sodium production
|
|
Метод получение калия при невысоких температурах
На форуме журнала разные участники, не сговариваясь, стали выкладывать ссылки на метод получения калия при невысоких температурах. Еще бы: оказывается, можно "сварить" металлический калий просто в колбе! Ссылки были на разные химические сайты, плюс на видео с youtube.com. Как оказалось, "ноги растут" из американского патента: Metallic potassium producing at moderate temperatures Process for producing alkali metals in elemental form - United States Patent 4725311 http://www.freepatentsonline.com/4725311.html Патент, несмотря на принятый у нас стереотип, не является научной публикацией. Это - юридический документ. Документ, который закрепляет за собственниками патента право на определенный процесс или объект (методику получения вещества, способ производства изделия, определенное изделие с определенными функциями и т.д.) Без разрешения автора (точнее - держателя патента) нельзя использовать в коммерческих целях объект или процесс, который охраняется патентом. - Вот и все. Авторы патента по определению не гарантируют, что запатентованная ими методика будет работать. Они не обязаны проверять на практике работоспособность того, что они патентуют. Патент означает, что вы "застолбили" определенный участок, однако, совсем не обязательно на этом участке будут золотые самородки (или хоть что-то полезное). Более того, некоторые патенты делаются только с одной целью - чтобы сбить с толку конкурентов и пустить их по ложному следу (впрочем, с научными публикациями, в т.ч. - и в солидных журналах такое тоже бывает). И даже если патент рабочий, авторы пытаются всячески замаскировать реальную методику, добавляя в описание патента массу "балласта" (это также способ расширить область действия патента: на всякий случай). Например, если мы патентуем тигли из оксида алюминия, то в описании патента указываем: "оксиды бора, алюминия, галлия, индия и таллия, железа, кальция, олова, а также их бинарные и более сложные комбинации с содержанием компонентов от 1 до 99%". Итак, американский патент по получению калия. Приведенный в патенте метод синтеза калия вызвал сомнения в его достоверности: EXAMPLE 1 Production of Potassium Metal From Potassium Hydroxide This Example concerns the production of potassium metal in a general process and experimental setup which can be used also to produce other alkali metals. In a 1-liter four-neck flask, 31.1 g (1.278 moles) magnesium chips, 61.2 potassium hydroxide (1.000 mole KOH, 0.278 mole H2O) and 500 ml Shellsol D 70 are heated to the boiling point of the solvent. At a temperature of about 100° to 130°C, a violent evolution of H2 is initiated (about 1 liter/min). 278 millimoles H2 have been evolved after 1 hour. The rate of gas evolution distinctly decreases toward the end of that time. At the boiling temperature (about 200°C.), about 6.0 grams tertiary butyl alcohol (80 millimoles) dissolved in 6 g Shellsol D 70 are slowly added in drops within half an hour. 80 millimoles H2 are evolved. Under constant stirring, the evolution of H2 (total 460 millimoles) and the formation of potassium metal are continues and are terminated after about 4 hours. This is succeeded by cooling to 70°C. with stirring. Then the stirrer is stopped and the cooling is continued under an argon atmosphere. Until the colorless reaction solution is cold, white magnesia and a regulus of potassium metal have settled to the bottom. The solvent is subsequently distilled off under a vacuum (p=1 torr) or is filtered off. 200 ml 1,4-dioxane are then added to the residue at room temperature, followed by heating to 60° to 100°C. As a result, the potassium rises to the surface and is comminuted by stirring to form spheres of suitable size. When the desired spherical shape has been achieved, the stirrer is stopped and the contents of the vessel is permitted to cool. The reaction product mixture is then transferred to a separating vessel and is washed with dioxane. When the magnesia has settled, the vessel is drained to separate the potassium from the MgO and dioxane. The potassium is then melted on a filter medium and is sucked under a slight vacuum into a flask. Potassium having a silvery luster is obtained in a yield of 34.0 g, corresponding to 87% of theoretical yield. The dioxane-MgO suspension is filtered at room temperature through a frit. The residue consisting of MgO is dried in a vacuum at room temperature. The dioxane is completely recovered from the filtrate by distillation. A residue is left, which consists of potassium tertiary butylate, which has been formed by the reaction of the tertiary butyl alcohol. Перевод: Пример 1 Производство металлического калия из гидроксида калия Этот пример относится к производству металлического калия, данный процесс и описанная установка могут быть использованы также для получения других щелочных металлов. В 1-литровую колбу с четырьмя горлами помещают 31,1 г (1,278 моль) магниевых стружек; 61,2 г гидроксида калия (1,000 моль KOH, 0,278 моль H2O) и 500 мл Shellsol D 70. Содержимое нагревают до температуры кипения растворителя. При температурах около 100-130°С начинается бурное выделение водорода Н2 (около 1 л / мин). 278 миллимоль Н2 выделилось за 1 час. К концу этого времени скорость выделения газа резко уменьшается. При температуре кипения (около 200°С) около 6,0 г трет-бутилового спирта (80 ммоль), растворенного в 6 г Shellsol D 70, медленно добавляют в колбу по каплям в течение получаса. Выделилось 80 миллимоль Н2. При постоянном перемешивании происходит выделение Н2 (общее количество 460 миллимолей) и образование металлического калия, процесс прекращают примерно через 4 часа. Для этого при перемешивании колбу охлаждают до 70°С. Затем мешалку останавливают и охлаждение продолжают в атмосфере аргона: до тех пор, пока бесцветный раствор не охладится, белый оксид магния и шарики металлического калия осядут на дно. Растворитель отгоняют в вакууме (р = 1 мм рт.ст.) или отфильтровывают. Затем к остатку добавляют 200 мл 1,4-диоксана, при комнатной температуре с последующим нагреванием до 60-100°С, в результате, калий поднимается на поверхность и измельчается путем перемешивания с образованием сфер подходящего размера. Когда желаемая сферическая форма была достигнута, мешалку останавливают, и содержимому сосуда дают остыть. Смесь продуктов реакции затем переносят в делительную воронку и промывают диоксаном. Когда оксид магния осядет, содержимое сливают для отделения калия от оксида магния и диоксана. Калий затем плавят на фильтре и засасывают под небольшим вакуумом в колбу. Калий, имеющий серебристый блеск, получается с выходом 34,0 г, что соответствует 87% от теоретического выхода. Суспензию диоксан - оксид магния, фильтруют при комнатной температуре. Остаток, состоящий из MgO, сушат в вакууме при комнатной температуре. Диоксан полностью извлекают из фильтрата путем перегонки. Остаток представляет собой калиевую соль третичного бутилового спирта, которая образовалась в результате реакции третичного бутанола и калия. Что такое "Shellsol D 70"? Приведем еще один фрагмент из патента: The organic solvents which are nonreactive with the alkali metal to be produced include saturated aliphatic or cycloaliphatic hydrocarbons, which particularly have 8 to 20 carbon atoms in straight or branch chains or in cyclic form, such as decane, undecane, dodecane, decahydro-naphthalene, also commercially available special gasolines having boiling ranges between 150 and 250°C., such as Shellsol T, Shellsol D 70, kerosene. Said special gasolines have, e.g., a composition of 5% naphthenes, 3% n-paraffins, 92% isoparaffins or a composition of 40% naphthenes, 30% paraffins, 30% isoparaffins. Перевод: Органические растворители, которые не реагируют со щелочными металлами и могут быть использованы для их получения, включают: насыщенные алифатические или циклоалифатические углеводороды, которые имеют от 8 до 20 атомов углерода в неразветвленной цепи или в разветвленной цепи или в циклической форме, например декан, ундекан, додекан, декагидронафталин (декалин). Кроме того, можно использовать коммерчески доступные специальные бензины (точнее - моторные топлива), имеющие диапазоны температур кипения от 150 до 250°С, такие как Shellsol T, Shellsol D 70, а также, керосин. Примеры - бензин состава: 5% нафтенов, 3% н-парафинов, 92% изопарафинов или бензин состава: 40% нафтенов, 30% парафинов, 30% изопарафинов. Другими словами, в патенте утверждается, что металлический калий образуется при реакции едкого кали и металлического магния в среде углеводородов с температурой кипения 200°С, катализатором процесса служит трет-бутанол. Невысокая температура и хороший выход металлического калия. Углеводороды (если верить патенту) - практически любые, главное, чтобы он не реагировали с калием и имели нужную температуру кипения. Разумеется, я этому не поверил. Тем более, что методика первый раз попалась мне без ссылки на оригинальный патент. Гидроксид калия действительно реагирует с магнием, но не при 200 же градусах и не в среде нейтральных углеводородов. Третичный бутиловый спирт - катализатор? Но ведь он связывается с калием в бутилат [K1]. Адепты методики любят писать реакцию: 2KOH + Mg = 2K + Mg(OH)2 Если калий стоит в ряду напряжений левее магния (для водных растворов), то в других растворителях может наблюдаться и обратная картина. Поэтому сама возможность вытеснения металлического калия магнием возражений не вызывает. Но такие реакции протекают в среде электролитов, к коим парафиновые углеводороды не принадлежат. Да и сама возможность сосуществования "K + Mg(OH)2" выглядит кощунственно. Другим возражением было то, как можно добавлять трет-бутанол с температурой кипения 82-83°C в углеводороды, нагретые до 200°С?(!) Эффект будет примерно такой же, как при попадании воды на сковородку с горячим маслом. В оригинальном патенте эта проблема решается просто: трет-бутанол перед добавлением смешивается с холодным растворителем (высококипящим), а уже потом вводится в колбу. Но многочисленные "переписыватели" эту подробность опустили как "несущественную" - именно в таком виде я и увидел методику. На форуме поступили предложения воспроизвести данную методику. Взвесил перспективы. Третичного бутилового спирта у меня не было. Гидроксид калия был, магний (чистый, не сплав "электрон") можно было достать. Моторного топлива "Shellsol D 70" в глаза не видел, однако, по идее его можно было заменить вазелиновым маслом или чем-то подобным. Аргон тогда был, диоксана - не было, однако получить калий можно и без него: диоксан использовался при отделении калия от продуктов реакции. Но самое главное, эта методика казалась нереалистичной. Поэтому принял решение не тратить время и реактивы впустую. На форуме разгорелась горячая дискуссия, которая, по сути, перестала быть дискуссией. В частности, один из участников не желал ударить палец о палец, чтобы воспроизвести методику, но ожесточенно доказывал, что эта методика действует: "Вы посмотрите вот ссылка и вот ссылка, а вот книга на испанском... Я, правда, не могу ее перевести, но вы обязаны опубликовать статью по данному методу в журнале!" Затем появился еще один адепт, который ссылался на авторитет человека, которого я не знал лично - разве что по другим форумам, где он не брезговал примитивным троллингом. Разумеется, в научной дискуссии это не аргумент, но это аргумент для случая, когда вас убеждают поверить на слово. Фотография колбы с блестящими шариками? - Помнится, на этом же сайте выкладывали фотографию "бабочки, которая производит капрон", подождали, пока безграмотные журналисты найдут и перепечатают статью, а затем объявили, что это была шутка. - Не очень хотелось попасть на место тех журналистов (тем более, тут уже не будешь оправдываться, "что это не твоя специальность - поверил на слово, а меня обманули..."). В суде действует принцип "презумпции невиновности": человек считается невиновным, пока его вина не будет доказана. Смысл этого принципа в том, чтобы случайно не осудить невиновного - ради этого иногда приходится оправдывать явных преступников. В науке действует обратный принцип - "презумпция вины": утверждение считается недостоверным (неподтвержденным) до тех пор, пока не доказано обратное. Это ведь не уголовный суд и автору утверждения (открытия, теории, экспериментального факта) не грозит тюремный срок, если окажется, что он ошибся. Зато принятие ложной истины за аксиому может дорого обойтись для науки. Научный принцип: "не доверяй и перепроверяй". В моем случае, чтобы я поверил в методику, которую считаю сомнительной, нужно чтобы я увидел сам, ну, в крайнем случае - чтобы о достоверности методики рассказали люди, в которых я уверен. Незнакомые люди к таковым не относятся (как можно быть уверенным в человеке, которого даже не видел и с которым почти не общался?). Ролики на ютьюбе? Видеомонтаж сейчас доступен каждому. Например, я не видел реакции стронция с водой - так же, как не видел реакции натрия с хлорной кислотой (даже на видео). Если кто-то скажет, что он провел реакцию стронция с водой и наблюдал выделение водорода - причин не верить не будет. Зато, если кто-то будет утвержадть, что бросил кусок натрия в хлорную кислоту, а он не стал реагировать, - одних слов незнакомого человека и невнятных объяснений механизма явления будет мало (калий, например, образует малорастворимый перхлорат, но перхлорат натрия растворим: нет явных причин, чтобы реакция с хлорной кислотой не пошла или пошла вяло). Но ведь при таком подходе можно проигнорировать что-то по истине необычное! То, что не вписывается в стандартные теории и может стать основой для новых - более адекватных теорий! - Да, но вероятность этого мизерна. Гораздо чаще "необычность явления" объясняется ошибками экспериментатора (вместо хлорной кислоты налил керосин и не обратил внимания - бывает...), иногда причина "удивительных явлений" - недобросовестность экспериментатора. Поэтому решил данным методом не заниматься, а само обсуждение на форуме выделил в отдельную тему и переместил ее в раздел "Флуд". Хотите обсуждать ЭТО? - Пожалуйста, сколько угодно, но не нужно засорять тему по щелочным металлам малоценными дискуссиями. Тем временем, дискуссия то продолжалась, то затихала. Все новые люди в очередной раз выкладывали одни и те же ссылки (не зная, что другие люди сделали это несколькими годами ранее). Все описанное выше не стоило бы того, чтобы о нем вспоминать, если бы не одно "но": в мае 2016 я увидел металлический калий, который был получен по описанному методу. |

Potassium / Металлический калий http://woelen.homescience.net |
|
Метод получение калия (из магния, едкого кали, тетралина и трет-бутанола)
Мое знакомство с методом получения калия при невысоких температурах - часть "эпопеи" по запаиванию металлического натрия в ампулы. Недавно я пересилил себя и описал все эти злоключения [5] - и работу с натрием, и особенности взаимоотношений специалистов и менеджеров.
Metallic potassium preparation (using magnesium, potassium hydroxide, tetralin and tert-butanol) С самого начала, когда я встретился с работодателем (далее - "директор") и его женой, они стали рассказывать много разных вещей: от наблюдения за сельскохозяйственными полями со спутников и получения калиевой производной нафталина, до истории того, как в школах Украины было введено внешнее независимое оценивание (украинская аббревиатура - ЗНО). Она - бывший депутат и один из авторов этой системы (еще одним автором оказался мой бывший школьный учитель...). Кстати, у обеих специальность "международные отношения". В числе прочего директор взял листок и начал рисовать, как его сотрудница получала калий. Как только он успел нарисовал колбу и формулу "КОН", я сразу все понял и спросил: - Неужели ЭТО действует?! Оказывается, да. Причем они хотят, чтобы я проводил такие синтезы. В частности, они сказали, что им нужно по 2 кг металлических калия и рубидия. Потом - после долгих разговоров "обо всем на свете", выяснилось, что именно сейчас им нужен не калий и рубидий, а "блестящий натрий", запаянный в ампулы. Дело в том, что они уже продали ампулы с "блестящим натрием" и "блестящим калием" (т.е. взяли деньги и обязались выслать товар до срока), а теперь ищут человека, которые смог бы их сделать. - Хотя бы ампулы с натрием, про ампулы с калием они сначала промолчали (по-видимому, из скромности). Повторно пересказывать все это не буду - хватит и одного раза [5]. Остановимся на получении калия. Директор нанял для этой цели выпускницу КПИ (Киевский политехнический институт), по специальности она - гальваник [далее - "студентка"]. Работа у нее была, причем по специальности. Но, по-видимому, студентке надоело возиться с мешками сульфата никеля, и она захотела сделать что-то новое. По словам директора, к работе студентка относилась формально ("без энтузиазма"). "Лучше взять на работу профессионального химика, причем энтузиаста, чем какую-то студентку..." Сразу сделаю оговорку: нельзя судить о человеке, основываясь на рассказах других людей. Даже если вы этим людям доверяете, даже если у них нет никаких личных причин хвалить конкретного человека или наоборот - наговаривать на него. Например, мой близкий друг - оптимист, он относится к людям хорошо (пока некоторые из них сильно его не "достанут"). Так вот, если какой-то явный негодяй еще не успел "достать" моего друга (ну или проявить себя слишком явно по отношению к другим людям) - друг всегда даст этому негодяю положительную характеристику: абсолютно искренне. Аналогично некоторые люди видят все в негативном свете, а если конкретный человек сделал им что-то плохое - можете себе представить, какой будет его характеристика. Если работодатель при приеме на работу рассказывает вам, какими плохими были ваши предшественники, то мотайте на ус: вполне возможно, что аналогичные вещи он будет рассказывать и про вас - работнику, который придет после. Тогда "плохими" будете вы. Итак, сам метод. Описание директор нашел в какой-то англоязычной книге по химическим синтезам в кустарных условиях. Названия я, к сожалению, не запомнил (слишком много разной информации вывалили на меня за короткое время). Например, в этой книге описано получение калия электролизом расплава (едкого кали или хлорида калия - не запомнил), над электродами делали колпачки из оксида магния (а может быть - из оксида кальция) - чтобы калий всплывал и собирался под этими колпачками, будучи изолированным от воздуха. Потом эти колпачки вместе с металлом переносились в масло, где металл отделялся. На мои возражения, что для металлического калия получение электролизом не рекомендуется, он ответил: "Но ведь в книге же описано". Эту книгу он купил через систему books.google: оказалось, что там ее можно смотреть из своего аккаунта, но не скачать. Тогда он достал "левый экземпляр" в форме pdf-файла. Обещал мне прислать (взяв обещание, что я не буду его распространять), но так и не прислал. В числе прочего, в этой книге был описан метод получения металлического калия, основанный на обсуждаемом американском патенте. Записи этой студентки директор тоже обещал мне показать, но так и не показал (было не до того - запарка с запаиванием "блестящего металлического натрия" в ампулы). Сначала директор сказал, что студентка может прийти в выходной и показать, как делать синтез калия, но потом вышла "заминка". Только через несколько дней он признался, что студентка у него: "Работала, но больше не работает, поскольку ей это не интересно". Директор не возражал против моей просьбы ее пригласить, но и не проявлял "этого-самого" энтузиазма. По-видимому, острого конфликта не было, но ушла она не от хорошей жизни и директору - с его специальностью "международные отношения" (т.е. дипломатия) будет нелегко убедить студентку возобновить сотрудничество хотя бы на один день. Мне скоро стало не до получения калия, учитывая необходимость запаять натрий в абсолютно неприспособленных условиях, при сроках выполнения работы "с сегодня на вчера". А потом в ампулы предстояло запаять калий-натриевый сплав, калий, рубидий и цезий. Но, несмотря на эту "запарку", я успел уловить суть, как получают калий. Кстати, я дал слово о неразглашении, но "не разглашать" нечего: директор книгу мне не прислал, записи студентки не показал, саму студентку не привел, видео, которое было снято с помощью веб-камеры, прикрепленной к венику(!) - тоже не показал. Ну а содержание американского патента по получению калия "разгласил" его автор в момент публикации (т.е. много лет назад). Реактивы и процедура. Магниевая стружка (мелкая), едкое кали, тетралин и трет-бутанол. Магний должен быть чистым. Сначала директор купил магний, с которым ничего не получилось. Отдал на анализ, оказалось, что магния там 90%. Я сразу сказал, что это сплав "электрон" - он содержит около 90% магния, остальное - алюминий и порядка 1% марганца. Электрон используется для изготовления частей самолетов, крылатых ракет, некоторых автомобилей, бытовых электроинструментов и т.п. Оказывается, электрон для данного синтеза не подходит. Гидроксид калия. Обычный продажный реактив. Учитывайте, что согласно ГОСТа (и аналогичных норм) твердый гидроксид калия содержит немало воды. Тетралин (1,2,3,4-тетрагидронафталин С10H12). В американском патенте он непосредственно не упомянут (хотя и подпадает под область действия патента), там упомянут декалин (полностью гидрированный нафталин). Очевидно, тетралин указан в той самой книге. Температура кипения тетралина - 207°C (т.е. подходит). Для синтеза студентка брала тетралин, взятый из бутылок. С другой партией тетралина, которая была в канистре, синтез не пошел. По-видимому, так есть какая-то примесь, которая мешает. Попытка использовать вместо тетралина вазелиновое масло не увенчалась успехом. Синтез проводили в конической колбе с обратным холодильником. Обогрев - плитка с регулированием температуры (через блок с термопарой). В ходе процесса добавляли трет-бутанол (по-видимому, предварительно разведенный в тетралине). Без обратного холодильника синтез не получался. Попытка использовать вместо трет-бутилового спирта трет-амиловый также не увенчалась успехом. Калий выделялся в виде шариков, которые собирали металлическим ситечком и сплавляли в вазелиновом масле. Я застал несколько банок с маслом, на дне которых остался сплавленный калий (см. фото в конце статьи). Некоторые банки были просто слегка прикрыты неподходящей крышкой - все делалось в явной спешке. Объем колбы - 300-500 мл. При попытке воспроизвести синтез в двухлитровой конической колбе (с пропорциональным увеличением количества веществ) калий не образовался, зато чуть не возник пожар. По-видимому, дело в отсутствии перемешивания (мешалки не было), что вызвало локальный перегрев. Из колбы повалил дым, процесс был остановлен. За эту неудачу директор переложил вину на студентку (и кто бы мог подумать): "Из колбы повалил дым, а она стоит, смотрит!". Потом директор пожаловался, что она: "Провоняла весь коридор тетралином" - как будто в этом виноват работник, а не отсутствие вытяжной вентиляции. А когда дошло дело до жалоб, что: "Ей интересно было посмотреть, как калий окисляется на воздухе: она достала кусок из масла и разрезала. Мне жалко, что пропадает товар, а ей было интересно". - Многое стало понятно. Как видите, последняя фраза делает полностью не состоятельными обвинения в "отсутствии энтузиазма". По-видимому, ее просто поставили в неприемлемые условия (как и меня). Был случай, когда она залила водой лоток с тетралином и остатками калия - смелый поступок (фейерверк был до потолка). По себестоимости полученный таким способом калий был примерно, как покупной. Чистота калия, как показал анализ, была хорошей. В этот раз поработать с калием мне так и не пришлось, хотя директор неожиданно захотел, чтобы кроме ампул с натрием, я запаял еще и сплав натрий-калий. Он, видите ли, пообещал покупателю ампулу с этим сплавом в подарок - как компенсацию за то, что покупатель согласился на отсрочку поставки ампул с натрием (которых на тот момент не существовало в природе). Плюс в процессе работы с натрием выяснилось, что они также взяли заказ на ампулы с калием (с предоплатой). Но я решил сосредоточиться на натрии, т.к. не следует браться за несколько дел одновременно. Надеюсь, в следующий раз повезет больше. Ниже привожу фото полученного данным методом калия, а также - видео с куском калия, на поверхности которого четко видно цвета интерференции (видео снял Иван Николаевич, данный калий не был получен описанным методом). __________________________________________________ 5 Рассказ о натрии, калии, рубидии и цезии (художественное произведение из области химии). Story about sodium, potassium, rubidium and cesium [ссылка] |

Potassium / Металлический калий |

|

|

|

|

|

|
|
Комментарии
К1
Трет-бутанол, очевидно, является катализатором межфазного переноса. Гидроксид калия нерастворим в углеводородах, а трет-бутилат калия должен быть заметно растворим. Таким образом достигается эффективный контакт реагентов. Процесс восстановления должен происходить по следующей схеме: 1. KOH(тв) + t-BuOH(р-р) < -- > H2O(р-р) + t-BuOK(р-р) (на поверхности гидроксида калия) 2. Mg(тв) + H2O(р-р) -- > MgO(тв) + H2(г) (на поверхности магния) 3. Mg(тв) + 2 t-BuOK(р-р) -- > 2K(ж) + Mg(t-BuO)2(р-р) (восстановление калия) 4. Mg(t-BuO)2(р-р) + H2O(р-р) -- > MgO(тв) + 2 t-BuOH(р-р) (регенерация катализатора) Процесс восстановления калия магнием в данных условиях термодинамически возможен, так как один из продуктов реакции оксид магния - очень прочное соединение. Вероятно, в качестве катализатров межфазного переноса в данном случае можно использовать и другие вещества. Требования к катализатору таковы: 1. реакция с гидроксидом калия с образованием растворимых в углеводородах солей калия; 2. отсутствие побочных реакций в сверхосновной восстановительной среде при повышенных температурах (с калием, магнием); 3. отсутствие пассивации поверхности магния. Некоторые возможные кандидаты - ароматические краун-эфиры, ароматические 1,2 - диолы (дифенолы). Основной вопрос в том, что такой процесс получения калия экономически невыгоден, так как требует дорогого магния. Себестоимость же калия, полученного промышленно восстановлением хлорида калия натрием, сопоставима с себестоимостью электротехнической меди. По этой причине оптимизацией данного патента не занимались. А в нормальных лабораторных условиях металлические калий получают из банки... |