Химия и Химики № 3 2020
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 3 2020 Журнал Химиков-Энтузиастов |
Гальванические ванны (фото и видео) - ч.1b Galvanizing baths (photos and video) В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Ванна щелочного цинкования
Анализ электролита ванны щелочного цинка и работа ванны описаны в статьях: Ванна щелочного цинкования. Alkaline zinc galvanizing bath [ссылка], а также -
Гальванические ванны (фото и видео) ч.1, 1a. Galvanizing baths (photos and video) [ссылка].Alkaline zinc galvanizing bath Конечно, хочется сделать что-то более интересное, чем фотографировать гальванические ванны и описывать их работу. Например, химический вулкан из килограмма бихромата аммония (чтобы убедиться, что этот же опыт, но со ста граммами бихромата выглядит красивее). Или опыт "химические часы" или горение термитной смеси... Но, как говорил один нехороший человек (по совместительству - бывший президент): "Имеем, что имеем". Если я сделаю во дворе завода термит, то пару цехов прибегут на это посмотреть, а потом будет трудно объяснить начальству, чем это таким я там занимался... Светлым и ярким... Прецеденты были. Поэтому, продолжим рассказ про будни технолога гальванического производства. Источником цинка в электролите щелочного цинкования служат растворимые аноды. В процессе работы ванны цинковое покрытие садится на изделия, концентрация цинка в электролите падает, а чтобы ее поддерживать (в пределах допустимых значений) служат цинковые аноды. Растворяются они не за счет прохождения через раствор электрического тока (как это происходит в случае медных, никелевых или оловянных анодов), а за счет образования гальванической пары цинк-железо (цинк помещают в железные корзинки). Т.е., по технологии цинковые аноды не подключены к анодной штанге. Ванна работала. В один прекрасный момент растворение цинковых анодов замедлилось. Не будут растворяться аноды - не будет цинка в электролите - нужно что-то делать. Я посоветовался с одним человеком (который долго проработал на гальванике) и проигнорировал этот запрет: подключил аноды к штанге напрямую, чтобы через аноды потек ток. Это должно было ускорить растворение цинковых анодов за счет явления... анодного растворения (простите за тавтологию). Часто такая процедура помогала, но не всегда. Скорость растворения цинка также зависит от температуры и концентрации в электролите щелочи. Помню, как обстоит дело с другом металлом - алюминием. Реакцию алюминия с раствором щелочи можно использовать для получения водорода. На холоду алюминий реагирует с крепкими растворами щелочи спокойно (не очень интенсивно), но в результате реакции выделяется тепло, раствор греется - реакция ускоряется. Быстрее протекает реакция - больше выделяется тепла, больше тепла - выше температура, выше температура - быстрее реакция. В результате раствор сильно нагревается, реакция становится бурной и выходит из-под контроля (смесь часто выплескивается из колбы). Но достаточно охладить колбу водой - и бурное выделение водорода становится спокойным. Т.е., факторов, от которых зависит растворение металлического цинка в щелочи, много. В результате наступил момент, когда и ухищрение с подключением анодов не помогло. Аноды - половинки цинковых плит, обмотанные железной проволокой (2 шт) или помещенные в железную корзинку (1 шт). Те аноды, что обмотаны проволокой, я подключил к анодной штанге (чтобы лучше растворялись - по технологии это не предусмотрено). Когда холодно, цинк в щелочи растворяется плохо. Плюс куча соды (карбонат натрия) на дне ванны в осадке. Сказал, чтобы рабочий добавил половину 25 кг мешка едкого натра. Через пару дней гальваник, которая работает на этой ванне, сказала, что анодов... нет. Растворились. Остались огрызки. Вот что значит зависимость скорости реакции от концентрации. Проблема 1. Нужно достать железную корзинку с остатками анода, а дно этой корзинки вросло в плотный осадок соды. Женщина не может ее выдернуть. Надел перчатку (электролит едкий - 110-150 г/л едкого натра). Выдернул... верхнюю часть: корзина разломалась - ее нижняя часть так на дне ванны и осталась (точнее - В дне). |

Сломанная стальная корзинка для анодов |

|
|
Проблема 2. Второй анод рабочая достала. Достаю третий - от него остались только верх и проволока. Проволока тоже вросла в дно. Часть выдернул, часть так в ванне и осталась. Еще один кусок цинка гальваник с трудом выловила металлическим совком.
Загнул края корзинки, чтобы в нее можно было положить куски анодов. Пытаюсь замотать стальной проволокой, которая еще два месяца назад была упругой (ее приходилось несколько минут сгибать плоскогубцами туда-сюда, чтобы переломать). Теперь - после пребывания в щелочной ванне - проволока стала хрупкой - ломается при любой попытке согнуть. Кое-как обмотал дно корзинки, засунул куски цинка, опустил в ванну. Проволока и корзинка покрылись каким-то черным налетом. Пачкает руки, как грязь. Думаю, это металлы, более пассивные, чем цинк. |

Остатки цинковых анодов |

|

|

|

Стальная корзинка с кусками цинка в ванне |
|
Проблема 3. Новые цинковые аноды. Позвонил начальнику, объяснил, что нужно. Заказов на цинк много, а пополнять потерю цинка в электролите - нечем. Он пообещал, но вы помните, сколько лет ждут обещанного. А еще - нужно подписать служебную у директора - разрешение на закупку чего-либо дает он (фактический начальник - официально только поставщик).
Заодно в ванну нужно два дополнительных ТЭНа: есть один и греет он слабо - зимой раствор успевает остыть за ночь. Ванна холодная - сода в осадке, щелочь плохо растворяет аноды. Сходил к менеджерам - озадачил. В принципе ТЭНы можно купить и на базаре - было бы желание. Для цинковой ванны подойдут обычные из нержавейки. Что у них нет денег - не поверю. Аноды купили - и быстро. Не успел даже служебную написать. Запускаем линию металлизации пластика, стоим, смотрим - будет ли "тянуться" (будет ли поверхность пластиковых изделий покрываться медью)? Стою возле линии - приходит начальник: - Ты цинковые аноды получил? - Нет. - Иди, получи и опусти в ванну - их уже привезли. Чтобы они начали растворяться! - Сразу опускать нельзя. Цинковые плиты нужно отнести слесарям, чтобы разрезали. - Ну так иди, отнеси. Чтобы аноды к концу дня были в ванне! Не пошел - жду, будет ли покрываться пластик медью? Будет ли работать ванна, изначально приготовленная на низкой концентрации палладия? Покрывается, но плохо - ждать приходится долго, медью затягиваются не все детали на подвеске. Пошел за цинком - оказалось, что аноды еще не привезли. Возвращаюсь к линии металлизации, смотрю, что не так с пластиком. Телефонный звонок - привезли аноды. Спускаюсь, получил, отнес слесарям. Выслушал лекцию про магарыч, дополнительную оплату и т.п. Послал их... к директору. С него пусть и требуют. - Тебе срочно? Можно завтра? - Начальник меня подгоняет, но это подождет до завтра. Ушел на гальванику. Стою возле линии, гальваник проводит процесс. Опять звонок: - Идите аноды получать - вас кладовщица ищет! - Я получил. - Она звонила только что. Опять спускаюсь, спрашиваю у кладовщицы: - Как это понимать? Оказывается, слесаря уже разрезали аноды (обычно у них не допросишься, а тут - сразу). Спускаюсь, беру 4 цинковых анода (2 плиты разрезали пополам). Два отдал рабочей, чтобы она спрятала, два - нужно накрутить на них железную проволоку и опустить в ванну. Желательно - подключить к анодной штанге. Пробую накрутить проволоку, которую снял с остатков старых анодов, но она стала хрупкой и ломается. Снова спускаюсь вниз - в отдел золочения, беру новую стальную проволоку (проволока - нержавейка, для ванны цинка ее использовать нельзя, нужна черная сталь, но я это проигнорировал). Возвращаюсь на гальванику, накручиваю упругую сталюку на цинк... Снова звонок. Звонит менеджер, который привез аноды: почему я не написал служебную на их покупку? - Наша бухгалтер выставила ему претензии. Написать - минутное дело, но нужно подписать у директора. Директора может не быть, он может не принимать или отказаться подписывать и т.п. Кое-как накрутил, опустил аноды в щелочную ванну, один подключил к штанге, второй - не достает... Помыл руки от металла и щелочи - пошел печатать служебную. Подписал у директора, отнес бухгалтеру. |

Новые цинковые аноды |

|

|
|
А через несколько дней сделал анализ цинка и щелочи в ванне. Щелочь - в норме (124 при норме 110-150 г/л), зато цинк - сходу не получился: не было перехода эриохрома черного Т. В чем дело? Взял вдвое меньшую аликвоту. Есть переход, хоть и не очень четкий.
Оказалось, что содержание цинка в ванне - почти две нормы (29,1 при норме 10-15 г/л). Обычно было наоборот - концентрация цинка еле дотягивала до половины. Сказал рабочей, которая занимается этой ванной. Два новых анода вынул, а корзинку с остатками старых она попросила оставить. Кстати, остатки старых анодов реагируют со щелочью достаточно активно, а новые аноды - почти нет. Или контакт с проволокой неплотный, или марка стали совсем неподходящая? Трудно сказать. Позже - сообщил мастеру и зав. тех. бюро. Формально заведующая - мой начальник, реально - совсем нет, и после нескольких разговоров с нелитературными словами (с моей стороны) она это осознала. Но они с мастером собирают заказы на эту ванну, потом - отдают рабочим. Поэтому сообщил. Смотрю - через день они сказали рабочей вынуть и ту корзинку с остяками цинковых анодов, что была в электролите. |

Анализ электролита щелочного цинка |

|

|

|
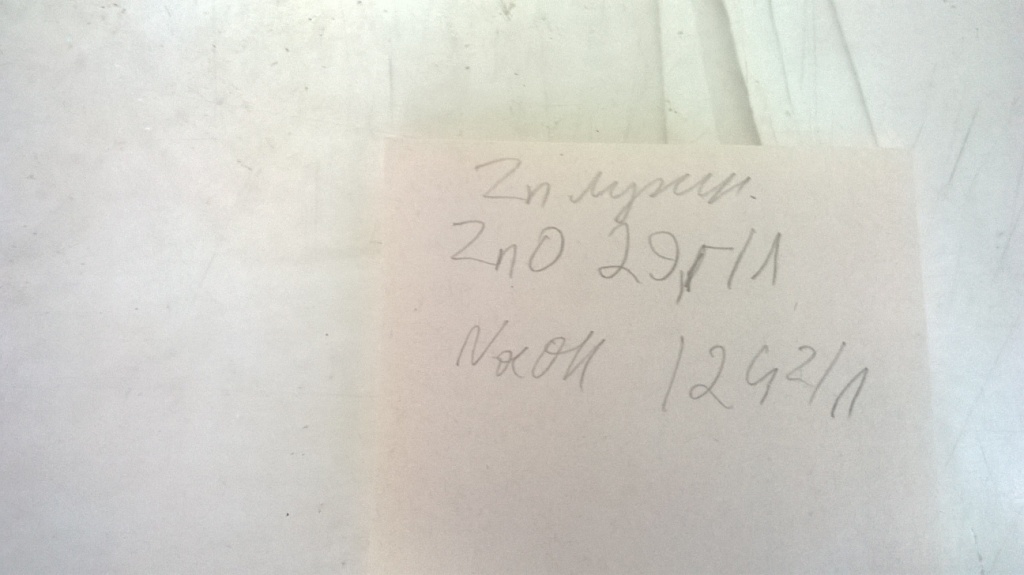
|

Корзинка с кусками цинка в ванне (остатки анодов). Видны многочисленные кристаллы соды (карбонат натрия) |

|

Новые цинковые аноды в ванне |

|

Цинковые аноды с обмоткой из железной проволоки (вынул из ванны) |

|
|
Потом - меня забрали в армию на месяц. Уже в самом конце этого месяца позвонили ребята с гальваники - оказывается, что пришел заказ на покрытие цинком гильз. Ванна работала нормально. Потом - завод закрыли на карантин. Сидим по домам, ждем...
|

Работа ванны щелочного цинка |

|

|

|

|
Гальванические ванны (фото и видео) - ч.6 Galvanizing baths (photos and video) В.Н. Витер |
|
Ванна золочения. Gold plating bath
Ванн золочения у нас две, одна - для печатных плат, другая - для декоративных изделий. Среди последних доминирует церковный инвентарь - все, что должно быть желтым и блестеть, чтобы привлекать людей в опиумный притон для народа. Чтобы позолота блестела, оказывается, она не должна быть толстой. Наоборот, после "толстого" золочения (1-10 ммк, например) изделия особо не блестят, а если снизу под золотом - медь (слой меди или если само изделие - медное), то возможна встречная диффузия атомов золота и меди (что не очень хорошо). Но, если нанести тоненький слой золота в 0.1 ммк поверх слоя блестящего никеля, - изделие будет выглядеть ярким, блестящим, словно оно из чистого золота. Какая вера - такое и "золото".
К ваннам золочения я прямого отношения не имею. И это - хорошо: меньше мороки и меньше ответственности. Работа с драгоценными металлами - не совсем приятная вещь, учитывая их стоимость. Но все равно иногда приходится ними заниматься. Например, когда в ванне золочения плат накопилось много органики и стоял вопрос, что нужно приготовить новую ванну, мне пришлось прогонять электролит на ячейке Хулла (см. статью: Ячейка Хулла (электролит золочения). Hull Cell (electrolyte for gold plating) [ссылка]). Плюс, время от времени, отбираю на анализ электролит на анализ из той ванны золочения, которая для "ширпотреба". Сам анализ мы не делаем, т.к., в лаборатории нет даже аналитических весов. Образцы сначала возили на завод "Электромаш", потом - стали возить в университет. На "Электромаше" золото, вероятно, анализировали гравиметрическим методом: осаждали металлическое золото из раствора гидразином, фильтровали, сжигали на беззольном фильтре и взвешивали. Метод надежный и точный (по сути - арбитражный), но одновременно - длительный и трудоемкий. Плюс - требует квалификации персонала. Научить делать анализ можно и обезьяну, но нужно именно научить: показать и заставить выучить общий ход, четко показать и заставить выучить, что следует, и чего, ни в коем случае, не следует делать. Тогда незнающий химию исполнитель будет делать анализы лучше, чем грамотные химики. - До тех пор, пока ему не дадут делать другой анализ, которому его не научили. В университете золото анализируют методом атомно-адсорбционной спектроскопии (ААС). Метод быстрый, но не особо точный и не всегда надежный. В пламя впрыскивают раствор, содержащий пробу золота, через пламя проходит луч, который имеет длину волны, как у линии поглощения атомов золота. Атомы золота поглощают свет - тем сильнее, чем их больше в пламени. Ослабление светового потока фиксирует фотоэлемент (не всего, а только того, что соответствует длине волны поглощения золота). Сначала проводят калибровку - в пламя впрыскивают стандартные растворы с известным содержанием золота и строят калибровочный график зависимости поглощения от содержания золота. Потом в пламя впрыскивают анализируемый раствор, измеряют его поглощения и, с помощью калибровочного графика, определяют по поглощению содержание золота в анализируемом образце. К сожалению, измеряемое поглощение света в пламени зависит не только от содержания золота в образце, но и от целого ряда факторов, например, - скорости подачи раствора в пламя, точности работы фотоэлемента, посторонних примесей, которые могут мешать атомизации золота, примесей, которые сами горят и меняют температуру пламени и т.д. Но есть и более существенная причина для ошибок. Какая? - Сейчас посмотрим. Итак, было два анализа. Предыдущий - сделанный некоторое время назад гравиметрическим методом. Далее ванна эксплуатировалась, в ней покрыли сколько-то дециметров плат золотом при такой-то толщине покрытия. Сколько золота ушло из ванны - примерно можно рассчитать. После этого сделали второй анализ золота - атомно-адсорбционным методом. Оказалось, что: 1. золота в ванне осталось очень мало - 0.7 г/л (при общей концентрации по регламенту 3-4 г/л); 2. неизвестно куда делся 1 г/л золота или 30 г на всю ванну. Сделали корректировку, добавив в ванну соль золота, снова отдали электролит на анализ. И оказалось, что 1 г/л золота "нашелся". Т.е. новый результат равнялся: старый результат + корректировка + пропавший 1 г/л. Откуда такое расхождение? Человек, который делал анализ, сказал, что раньше у него был старый стандарт (стандартный раствор) золота, а теперь он купил новый. Другими словами, если стандартный раствор золота, который использовался для построения калибровочного графика, имеют не ту концентрацию, то все результаты всех анализов на ААС идут коту под хвост. Или, если калибровка делалась давно, и новые измерения на приборе сопоставляются со старой калибровкой. Перед тем, как отнести пробы электролита золочения на анализ, я предлагал дать им контрольную пробу: одну из проб электролита развести водой точно в 2 (или 3) раза и сказать, что это - еще один образец. На случай, если анализ не делают вообще, а только пишут его результаты, такая проверка эффективна. Но если исходный стандарт золота для калибровки не соответствует действительности или если калибровка прибора "поплыла" - такое ухищрение не поможет. Анализ покажет, что в контрольной пробе золота в 2 (или в 3) раза меньше, чем в исходной неразведенной пробе. Но, обе эти цифры будут неверными. Тут нужно, или готовить раствор с точно известной концентрацией золота для проверки, или воспользоваться методом добавок. Вопрос с "испарившимся" золотом, которое потом опять "конденсировалось", пришлось решать другим технологам - у меня и без этого дел достаточно. Зато соседство участка золочения с лабораторией - наша общая проблема. Электролит, как любит говорить нам начальство, - "безцианидный". Дицианоаурат калия K[Au(CN)2], лимонная кислота и добавка, содержащая соль кобальта. Тем не менее, соседки постоянно жалуются, что летят "цианы". На прошлых работах они имели дело с цианидами - электролитами серебрения и золочения - поэтому в курсе, как они пахнут. Даже я иногда ощущаю - и запах, и само действие. Дело в том, что у нас одна общая вентиляция с комнатой золочения, которая почти не тянет. А иногда - отключается (выбивает тепловую защиту двигателя). В результате от них к нам перетягивает все прелести. Комплекс K[Au(CN)2] сравнительно прочный, но не при низких рН, плюс, если золото садится на покрываемых изделиях, а анод - инертный (платинированный титан), то куда девается радикал цианида, расставшись с золотом? Много раз нам обещали сделать вытяжку, но все упирается в необходимость установки более мощного двигателя. Типичная ситуация. В конце дня замечаю, что кто-то оторвал полоску бумаги от страницы моего лабораторного журнала. С краю - словно отгрыз. Рассердился и пообещал, узнаю кто - заставлю весь журнал съесть (раз он такой голодный). На следующий день приходим на работу - в лаборатории газовая камера. Вентиляция не работает и не включается. Мало того, что улитка (вентилятор) у нас очень слабый, так еще и тот не включается. Рядом - комната с ванной с дицианоауратом калия, у нас - общая с ними вентиляция, оттуда все прет к нам. Вызвали электрика. Он покопался, включил и сказал, сломался пускатель - постоянно выбивает. А чтобы в очередной раз проверить, тянет или нет, - попросил бумажку. Понял я, кто поднял руку на мой лабораторный журнал. Но съесть журнал его не заставил. Вместе с соседками придумали что-то получше. Сказали: или вы почините вытяжку, или мы вас вместе с энергетиком в комнате золота запрем. На часок-другой. Вы же говорите, что без вытяжки ничего страшного - значит, мы не сделаем ничего плохого. Как покрывают золотом платы - непосредственно не наблюдал. Зато церковную утварь и т.п. - видел. Подготовленную поверхность опускают в декапир (раствор для декапирования, в нашем случае - разбавленная соляная кислота), потом подсоединяют изделие к катоду и опускают на несколько секунд в ванну золочения. Блок питания - самый обычный, такие блоки везде продаются. Анод - сетка из платинированного титана. Сразу же образуется тонкое сплошное желтое покрытие. Изделие вынимают, промывают и сушат обдувкой сильным потоком воздуха из специального пистолета. Все. Корректируют электролит дицианоауратом калия и фирменной добавкой, похожей по цвету на разбавленный раствор соли кобальта. И не только по цвету - с этой добавкой в электролит золочения вводится кобальт, который осаждается в небольшом количестве вместе с золотом. Т.е., фактически осаждается не чистое золото, а сплав золото-кобальт, который имеет лучшие механические свойства, чем золото. Есть аналогичные электролиты и для осаждения сплавов золото-никель. Полный состав таких электролитов приведен, например, в книге Справочник по электрохимии/ Под ред. А.М. Сухотина. - Л.: Химия, 1981 [ссылка]: |


Составы электролита (по справочнику) |
|
Теперь - немного фотографий.
|

Ванна золочения Gold plating bath |

|

|

|

|

|

|

|

|

|

Позолоченное изделие (образец покрытия) |

|

Вблизи - покрытие олово-висмут, чуть дальше - покрытие золото (образцы для заказчика) |

Дицианоаурат калия K[Au(CN)2] - источник золота в электролите |

|

Взвешивание дицианоаурата калия K[Au(CN)2] |

|
Гальванические ванны (фото и видео) - ч.7 Galvanizing baths (photos and video) В.Н. Витер |
|
Ванна электрохимического обезжиривания
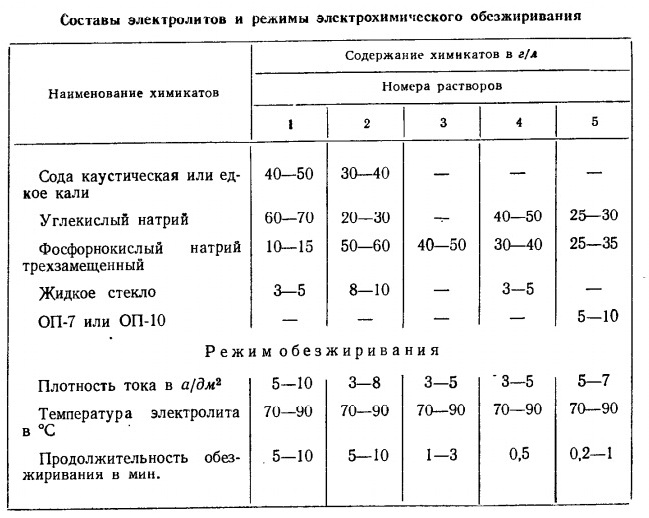
Идея покрыть дешевый и недефицитный металл более дорогим и дефицитным металлом, который обладает рядом ценных свойств (блеск, химическая и механическая стойкость), стара, как мир. Но не все тут так просто. Нужно еще, чтобы это покрытие держалось, было равномерным и не имело механических дефектов. А достичь этого непросто. Способов покрыть один металл другим изобретено много и большинство из них требует предварительной подготовки поверхности покрываемого металла, нередко - многостадийной подготовки. Гальваника - не исключение. Electrochemical degreasing bath Прежде всего, следует удалить с покрываемой поверхности загрязнения, которые мешают нанесению покрытия и уменьшают его адгезию (сцепление) с поверхностью. Загрязнения могут иметь разную природу, но чаще всего отравляют жизнь гальваникам жиры и минеральные масла (они же - смазочные масла; представляют собой углеводороды). Жиры и масла почти всегда присутствуют на поверхности покрываемых изделий и должны быть удалены, иначе гальваническое покрытие получится с дефектами или не получится вовсе. Жиры и масла могут попасть на изделие при механической обработке (смазка для уменьшения трения), при контакте с руками работников, могут быть нанесены на изделие умышленно для защиты его от коррозии (антикоррозионная смазка). Методов обезжиривания известно много: обезжиривание с помощью органических растворителей, с помощью ультразвука, химическое обезжиривание, электрохимическое обезжиривание. Каждый из методов имеет свою область применения, свои преимущества и недостатки. У нас в цеху для обезжиривания изделий применяется электрохимический метод. Жиры представляют собой эфиры глицерина и высших жирных кислот. В воде он практически нерастворимы, зато хорошо разрушаются горячими растворами щелочей, переходя в глицерин и в соли жирных кислот (мыла). Процесс называется - реакция омыления. Минеральные масла (смеси углеводородов) щелочами не разрушаются, зато под действием горячих щелочей они частично отделяются от поверхности, образуя эмульсию. Однако, этого недостаточно, поэтому для стабилизации эмульсии и облегчения отделения капелек масла от поверхности добавляют эмульгаторы. Эмульгаторы представляют собой поверхностно-активные вещества, желательно - дешевые, например: жидкое стекло (натриевые и калиевые соли кремниевых кислот) и мыла. Мыла, кстати, образуются в растворе сами по себе - при реакции щелочи с жирами. Описанный выше процесс удаления жиров и масел называется химическое обезжиривание. Электрохимическое обезжиривание проводится с использованием аналогичных растворов для обезжиривания. Разница состоит в том, что процесс проводят в электрохимической ванне с инертным анодом (железо), а обезжириваемые изделия подключают к катоду. В результате электролиза на катоде выделяется газ (водород), который нарушает сцепление масляной/жировой пленки с поверхностью и облегчает отделение капелек масла. За счет этого можно уменьшить концентрацию щелочи и эмульгатора в растворе для обезжиривания (по сравнению с химическим методом). Иногда обезжириваемые изделия приходится подвешивать не к катоду, а к аноду (см. ниже). Типичные растворы для химического и электрохимического обезжиривания содержат едкую щелочь (гидроксид натрия), щелочные соли, дающие щелочь при гидролизе (кальцинированная сода, поташ, трехзамещенный фосфат натрия) и эмульгаторы (жидкое стекло, мыло). Много щелочи - даже при чисто химическом обезжиривании - давать нецелесообразно, поскольку при высоких концентрациях щелочи в растворе плохо растворимы мыла, которые образуются в реакции, плюс поверхность черной стали может покрыться оксидной пленкой, что усложняет обезжиривание. Избыток эмульгаторов (поверхностно-активных веществ - ПАВ) тоже может принести неприятности при электрохимическом обезжиривании, т.к., образуется много пены. Пены с пузырьками водорода и кислорода, эта пена легко вспыхивает и взрывается от любой искры. Поэтому, в качестве эмульгатора для электрохимического обезжиривания используют жидкое стекло, а органические ПАВ в эти составы обычно не добавляют (если и добавляют, то в 3-5 раз меньше, чем при химическом обезжиривании), иногда приходится использовать гасители пены (кремнийорганические жидкости). Менеджер рассказывал про одно производство. Там тоже есть ванна электрохимического обезжиривания. Объем - 5 кубов (у нас две аналогичные ванны, но их объем - около куба). В процессе работы выделяется водород (и кислород). Над ванной - шапка пены. При загрузке-выгрузке деталей периодически проскакивает искра и... происходит взрыв: окружающих забрызгивает щелочной пеной. Потом пена опять накапливается и [в самый неподходящий момент] взрыв повторяется снова. Чтобы наши ванны электрохимического обезжиривания взрывались - не видел и не слышал. Хотя шапка пены над ними бывает часто. Зато у нас есть ванна снятия бракованных никелевых покрытий. Состав электролита - серная кислота и глицерин. Над раствором собирается пена. Ее немного, но ванна часто взрывается. Звук такой, как будто на стальной лист упустили 16-кг гирю с нескольких метров. Наблюдал за этим процессом с близкого расстояния: взрыв происходит, когда проволока, на которой подвешена деталь к аноду, накаляется и поджигает пену. Чем хороша ванна электрохимического обезжиривания: ее уже лет 5, как никто не анализировал (а, может, - и гораздо дольше). Если раствор перестает работать, гальваники просто берут мешок с составом для ее приготовления и высыпают половину мешка в ванну. Фотографии наших ванн электрохимического обезжиривания, а также "ванны, которая взрывается" вы найдете в статье, посвященной именно этой ванне - Взрывающаяся ванна (ванна снятия никелевых покрытий). Exploding bath (bath for electrolytic stripping of galvanic coatings made of nickel) [ссылка]. Приведу составы ванн электрохимического обезжиривания из книги: Грилихес С.Я. Подготовка изделий перед гальваническими покрытиями и отделка покрытий. М., Л., "Машгиз" (1958) [ссылка] (также см. книгу Грилихес С.Я. Обезжиривание, травление и полирование металлов (5-е издание, 1983) по приведенной ссылке). Снизу для сравнения - состав ванн электрохимического обезжиривания нашего цеха. |
|

Составы ванн электрохимического обезжиривания Degreasing baths |
|
Электрохимическое обезжиривание дает более тщательную очистку поверхности, чем химическое, но оно целесообразно для снятия с поверхности металла не очень толстого слоя загрязнений (иначе - химическое обезжиривание и другие методы).
Детали из цветных металлов все время обрабатывают на катоде (как описано в начале статьи), детали из черных металлов также обрабатывают на катоде, но перед завершением процесса их перевешивают на анодную штангу. Дело в том, что катодная обработка черных металлов может привести к их насыщению водородом, что ведет к ухудшению механических свойств (хрупкость). Для стальных пружин и тонких закаленных деталей применяют только анодное обезжиривание (иначе они могут стать хрупкими). Такой процесс, когда черный металл становился хрупким за счет насыщения водородом, мне приходилось наблюдать, но не в ванне электрохимического обезжиривания, а в другой ванне, которая стоит с ней по соседству. Ванна щелочного цинкования (см. статью Ванна щелочного цинкования (ч.1b). Alkaline zinc galvanizing bath [ссылка]). По технологии цинк вводится в электролит за счет растворения цинковых анодов, которые непосредственно не подключены к анодной штанге, а просто помещены в железные корзинки (чтобы образовалась гальваническая пара железо-цинк). В результате цинк постепенно растворялся с выделением водорода. Из-за нехватки корзинок, я просто обмотал плиты цинка упругой стальной проволокой. Не черный металл, а низкосортная нержавейка, но эффект оказался тот же. Потом - после растворения цинковых анодов - я достал из ванны проволоку. Она стала очень хрупкой и легко ломалась при попытке ее согнуть. Изначально проволока была упругой и, чтобы ее переломить, проволоку приходилось несколько минут активно сгибать-разгибать. В чем дело, я тогда не знал. Подумал, что может быть - действие щелочи. Лишь значительно позже понял, что так действует на сталь водород. Есть даже термин "водородная хрупкость". Еще одна интересная подробность. В один прекрасный день понадобилось почернить детали из меди - буквально несколько штук мелких деталей. Процесс чернения у нас давно никто не делал, технолог, которая знала эту процедуру, уволилась, нужных растворов не было, а работа - копеечная. Но это был "заказ, от которого нельзя отказаться". Для чернения деталей их нужно опустить в нагретый раствор на основе полисульфидов натрия. Состав этого раствора неизвестен - его готовят из концентрата, которого у нас не было. Концентрат пришлось бы покупать. Потом - готовить из него раствор, потом - заниматься "творческими экспериментами". В инструкции, ни кратность разведения концентрата, ни время обработки конкретно не указаны. Сказано только, что при слишком малом времени обработки эффект будет недостаточным, а если изделия в растворе продержать слишком долго, покрытие будет отслаиваться. Нужно подобрать золотую середину. Сколько бы мне пришлось с этим возиться - неизвестно. Но рабочие взяли эти детали и подсоединили к аноду ванны электрохимического обезжиривания. В результате детали стали черными (покрылись оксидом). Проблема в том, что такое покрытие плохо держится - потому так делать нельзя. Ничего: высушили, покрыли лаком - прошло. |