
Хлор пропускают через воду со льдом
Клатрат хлора
| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 3 2012 Предварительный вариант |
Опыты с трубкой Фарадея (получение сжиженных газов) ч.4 И.Н. Григорьев |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Получение жидкого хлора
Как было сказано в первой части, описанный в статье метод получения жидких газов Майкл Фарадей открыл, нагревая в изогнутой трубке несколько кристаллов гидрата хлора [1]. Было бы логично попытаться получить жидкий хлор, повторив опыт Фарадея. Для этого нужно сначала получить клатрат (гидрат) хлора, потом запаять его в Г-образную трубку и нагреть. При этом не следует забывать, что хлор стал первым боевым отравляющим веществом, успешно использованным в больших масштабах (бои в районе города Ипр, 1915 год) - нужна предельная осторожность.
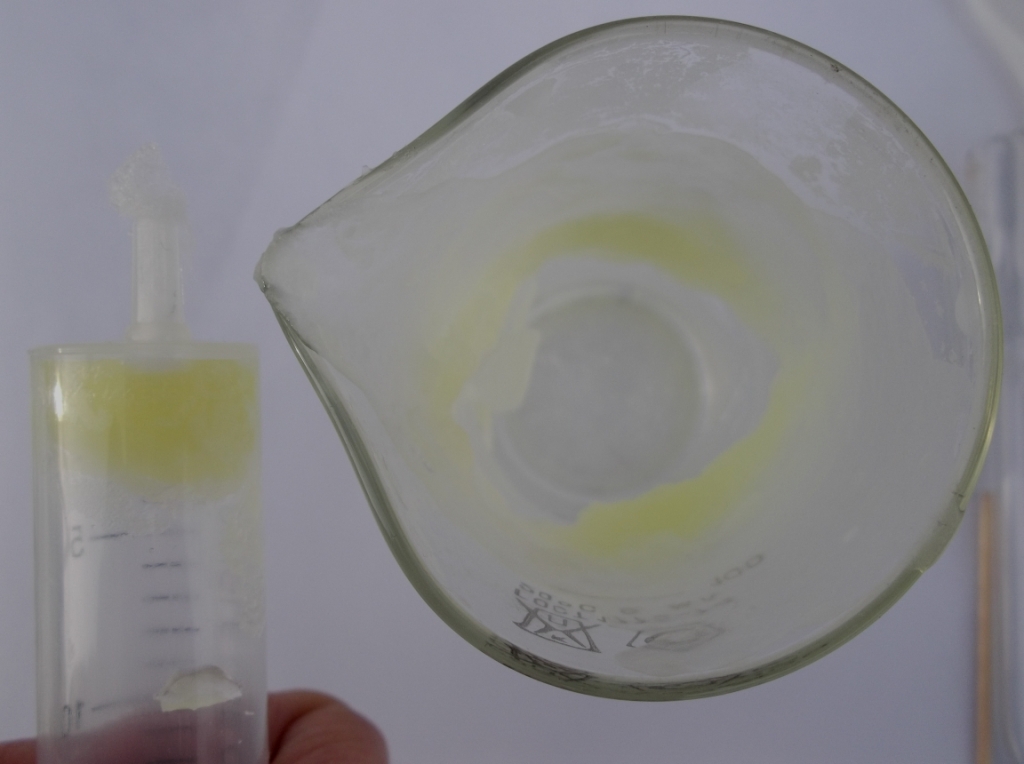
Гидраты хлора образуются при пропускании хлора через охлажденную воду. Согласно учебнику Некрасова [2] описано два кристаллогидрата хлора - Cl2·6H2O и Cl2·8H2O, однако эти формулы условны, поскольку гидраты хлора (как и другие клатраты) имеют переменный состав. При этом давление хлора над гидратом Cl2·6H2O достигает 0.1 МПа (1 атмосфера) при температуре 9.6°С [3]. Другими словами, гидраты хлора легко разлагаются даже при слабом нагревании. Итак, мы попробовали получить гидрат хлора. Через ледяную воду (с кристаллами льда) пропустили хлор. Постепенно вода в стакане приобрела желтовато-зеленый оттенок, начала образовываться пена (надо взбалтывать), потом вода превратилась в своеобразную кашицу. Опыт проводили на открытом воздухе (температура минус 20°С), поэтому снять ролик не удалось: на второй минуте эксперимента от холода отключился фотоаппарат. Чтобы отделить кашицу гидрата хлора от воды, взвесь налили в 20 мл шприц с ватой в носике и, вставив поршень, выдавили воду. Получились желтые кристаллы, чувствуется запах хлора. Оказалось, что набить изогнутую трубку полученным клатратом крайне трудно. Мы попробовали провести эксперимент с небольшой трубочкой, затрамбовали в нее гидрат хлора деревянной палочкой и запаяли трубку. К сожалению, свободный конец трубки был запаян некачественно (трубка оказалась слишком короткой, кроме того, помешало давление хлора), что сильно помешало опыту. Погрузив трубку в горячую воду, мы наблюдали процесс разложения: гидрат плавится и теряет цвет, превращаясь в жидкость. В противоположном конце трубки образовалась капелька сжиженного хлора. Потом трубка разгерметизировалась, но мы успели заметить, что по цвету жидкий хлор очень похож на хлористый азот. Таким образом, "классический вариант" опыта по сжижению хлора не удался по ряду причин. Эксперимент необходимо проводить в длинной трубке, которую следует запаивать горелкой с узким пламенем (в противном случае при малейшем нагреве создается давление хлора, что мешает запаиванию). Разумеется, колено с гидратом хлора должно охлаждаться. Опыт необходимо проводить в вытяжном шкафу: при пропускании хлора он поглощается водой лишь отчасти - даже на открытом воздухе чувствовался сильный запах. Проводить опыт на морозе (открытый воздух) - одно мучение: руки моментально замерзают, фотоаппарат быстро выходит из строя. _____________________________________________ 1 Оригинальную статью Фарадея вы можете прочесть по ссылке. 2 Б.В. Некрасов Основы общей химии ссылка 3 И.Л. Кнунянц (ред.) и др. Химическая энциклопедия, т.5 ссылка |

Хлор пропускают через воду со льдом |

Клатрат хлора |
|
Неудача первого опыта с клатратом хлора побудила нас найти более надежный и более удобный источник этого газа. Внимание привлекла статья в журнале Химия и Жизнь, в которой был описан способ получения хлора из сульфата меди и хлорида натрия.
Нагрейте до кипения насыщенный раствор медного купороса и добавляйте к нему хлорид натрия до тех пор, пока он не перестанет растворяться. В осадке будет Na2SO4 и избыток NaCl, в растворе - хлоридный комплекс меди: CuSO4 + 4NaCl <=> Na2[CuCl4] + Na2SO4 (осадок)
Осторожно слейте раствор с осадка, перелейте его в пробирку и упарьте. Вы получите зеленую смесь кристаллов NaCl и CuCl2. Когда вся вода испарится, закройте пробирку пробкой с газоотводной трубкой и нагрейте ее. Твердое вещество станет сначала коричневым, потом черным, а пробирка заполнится желто-зеленым газом - хлором. Мы повторили приведенный рецепт. После упаривания раствора на кипящей водяной бане и сушки твердого остатка образовался желто-коричневый продукт. Полученный порошок запаяли в трубку. Однако нагревом трубки получить хлор не удалось. Масса лишь сплавилась, выделилось немного воды и все. Видимо, образование хлора идет при высокой температуре. Такой способ для получения сжиженного хлора непригоден. |

Остаток после выпаривания раствора, полученного из сульфата меди и хлорида натрия |

Запаянная трубка перед экспериментом |
|
К счастью мы вспомнили, что раствор бихромата калия в концентрированной соляной кислоте выделяет хлор при нагревании, причем, если нагревание прекратить, образование хлора останавливается.
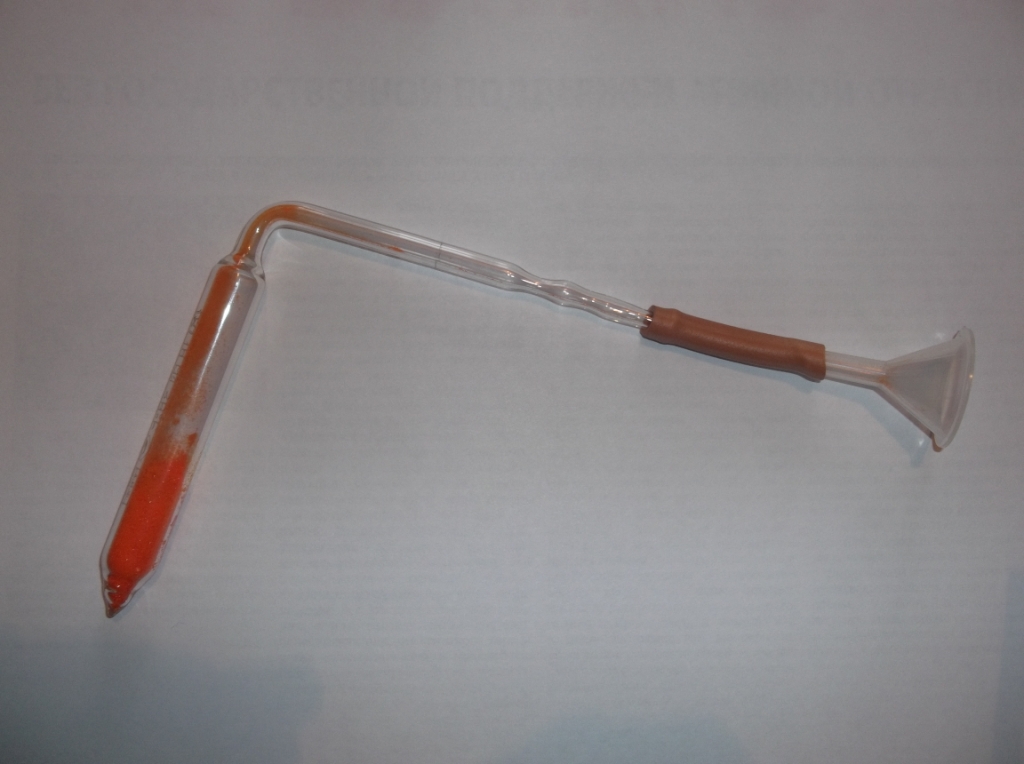
Опыт сделали "на скорую руку", но все получилось, причем оказалось, что провести такой эксперимент довольно просто. При нагревании трубки в холодном колене собрались две жидкости: сжиженный хлор и вода. |

Трубка для получения жидкого хлора |

Жидкий хлор и вода |
|
В отличие от многих газов хлор легко переходит в жидкое состояние при сравнительно небольшом увеличении давления. Так при 0°С давление насыщенных паров хлора 3.6 атмосфер, при 25°С оно достигает 7.9 атмосфер. Стеклянные трубки легко выдерживают такое давление. Разумеется, всегда существует вероятность взрыва установки, поэтому обязательно нужно использовать защитные очки, желательно - защитный экран.
Для опыта мы взяли пипетку на 10 мл. Внешний диаметр трубки - 6.4 мм, внутренний - 4.0 мм. Расширенная часть пипетки использовали как реакционная емкость. При отсутствии установку можно спаять из любой подходящей трубки. Был изготовлен простой прибор. С помощью воронки внутрь насыпали немного дихромата калия. Для очистки поверхности стеклянной трубки от пыли дихромата, которая могла помешать спаиванию, внутрь протолкнули небольшой кусочек кварцевой ваты. Можно было "почистить" трубку проволочкой с тампоном из обычной (хлопковой) ваты. Затем шприцем с присоединенной к нему оттянутой стеклянной трубкой влили соляную кислоту. Трубку запаяли с помощью "горелки-карандаша". Запаянное колено поместили в холодную воду, для удобства наблюдения была использована пробирка. Расширение пипетки (в котором располагалась реакционная смесь) осторожно прогрели горелкой. Начал выделяться хлор и вскоре холодное колено стало заполняться оранжевой жидкостью - сжиженным хлором. Опыт завершился успешно, однако прибор с жидким хлором представлял потенциальную опасность, и было решено от него избавиться. Удобнее всего издалека бросить трубку о кирпичную стену. Вскрывать прибор, просто отломив трубку, нельзя - он может взорваться в руках - от внутреннего давления. |
Трубка для получения жидкого хлора (загрузка бихромата калия) |

Получение жидкого хлора |

|

|
|
Позже мы решили переделать опыт и посмотреть, будет ли заметная разница по сравнению с первыми экспериментами. Были подозрения, что в предыдущих опытах на окраску хлора повлиял бихромат калия: хлор ведь получается влажный, а кристаллики бихромата вполне могли прилипнуть к стенкам (и остаться там, несмотря на протирание). Это подтвердил опыт с небольшой трубкой, которую мы не стали протирать (стенки колена были загрязнены пылью дихромата). Конденсирующийся хлор был ярко-оранжевого цвета. Повторив несколько раз переливание конденсирующегося хлора (назад в нагреваемое колено), удалось значительно изменить его цвет.
В последнем опыте внутреннюю поверхность трубки тщательно протерли от пыли дихромата. Соляную кислоту влили с помощью шприца через силиконовый капилляр. Полученный жидкий хлор несколько раз сливали обратно - в нагреваемое колено, однако цвет конденсата со временем не менялся. Сколь-нибудь заметное количество воды в холодном колене не конденсировалось, хотя немного капелек образовалось в месте перегиба трубки. Таким образом, чтобы избежать искажения цвета жидкого хлора, нужно тщательно протирать трубку от пыли дихромата перед опытом, особенно вблизи места изгиба, а конденсирующийся первый раз хлор можно слить обратно в реакционную смесь. _____________________ Дополнения Соединения шестивалентного хрома ядовиты и обладают канцерогенными свойствами. Особую опасность представляют летучие соединения хрома (VI) - хромовый ангидрид CrO3 и хлористый хромил CrO2Cl2. Некоторые коллеги считают, что искажение цвета жидкого хлора может быть обусловлено примесью хлористого хромила. Однако, по нашему мнению такой вариант маловероятен, поскольку хлористый хромил легко разлагается водой (которой внутри запаянной трубки было достаточно). |

Получение жидкого хлора |

|

|

|

|

|

|

Газовая атака (фотография сделана с аэроплана) |