Жидкий азот наливают в сосуд Дьюара
| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 3 2012 Предварительный вариант |
Опыты с жидким азотом ч.1a В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
О жидких газах (начало)
Сжиженные газы прочно вошли в нашу жизнь. Баллоны с жидкой пропан-бутановой смесью используются как источник топлива, сжиженный углекислый газ - для получения газированных напитков. Сернистый газ, который используют в качестве консерванта, также дозируют из баллонов со сжиженным газом. Жидкий аммиак применяется в холодильных установках.
В промышленности в крупных масштабах получают жидкий воздух, который потом разделяют на азот, кислород и инертные газы. Азот является сырьем для получения аммиака и азотной кислоты, которые в свою очередь необходимы для получения удобрений, красителей, лекарств, взрывчатых веществ и т.д. [1] Горючие материалы (вата, солома, опилки и т.п.), пропитанные жидким кислородом, при поджигании взрываются [2]. Такие взрывчатые вещества называются оксиликвиты. Оксиликвиты использовали для горных работ (особенно, когда не хватало более качественной взрывчатки). Жидкий азот используют не только для охлаждения, но и в качестве источника газообразного азота (аналогично и с жидким кислородом). ____________________________________ 1 В наше время способ производства аммиака через стадию разделения (ректификации) воздуха теряет свое значение. Основное количество азотно-водородной смеси для производства аммиака теперь получают последовательной каталитической конверсией метаново-воздушной смеси без промежуточного разделения воздуха. 2 Оксиликвиты являются довольно дешевыми взрывчатыми веществами. Такие заряды готовят непосредственно на месте подрыва, а срок их пригодности исчисляется десятками минут (пока не испарится кислород). Тем не менее, последнее обстоятельство во многих случаях является дополнительной гарантией безопасности. |
Жидкий азот наливают в сосуд Дьюара |
|
Разумеется, так было не всегда. Ученые прошлого не знали, что газ и жидкость - только разные агрегатные состояния вещества, которые способны переходить друг в друга. Газы и жидкости рассматривались как что-то абсолютно различное.
Конечно, еще алхимики наблюдали, как жидкость превращается в пар, а пар снова конденсируется в жидкость. Логично предположить, что газы - это пары жидкостей с очень низкой температурой кипения. Например, Лавуазье высказал гениальную догадку: "Если бы Земля внезапно попала в среду с очень низкой температурой, подобной, например, температуре Юпитера или Сатурна, - вода, которая ныне образует наши реки и моря и, вероятно, значительное большинство из известных нам жидкостей превратились бы в горы и твердые скалы. В этом случае воздух или, по крайней мере, часть газов, его составляющих, изменили бы свое состояние, превратившись в жидкость из невидимого газа, который существует благодаря нахождению в среде с достаточно высокой температурой, при этом переходе воздуха из одного состояния в другое образовались бы новые, доселе даже не предугадываемые жидкости". |

Спутник Ио (диаметр 3600 км) на фоне Юпитера |
|
Еще в 1726 году Джонатан Свифт в книге "Путешествия Гулливера" (ч. 3. Путешествие в Лапуту) описал деятельность местного ученого:
В его распоряжении были две большие комнаты, наполненные удивительными диковинами, и пятьдесят помощников. Одни сгущали воздух в вещество сухое и осязаемое, извлекая из него селитру и процеживая водянистые и текучие его частицы... По сути это намек на современную технологию разделения воздуха. |

Джонатан Свифт |

Лапута |
|
Однако на практике не все было так просто. Заставить газы конденсироваться, как пары воды долгое время не удавалось. Это укрепляло уверенность в том, что газы и жидкости имеют разную природу. Таким образом, газы не являются парами жидкостей. Приведенная цитата из книги Свифта была отнюдь не описанием технологии (пусть фантастической), а сатирой на тогдашних ученых, причем довольно едкой.
Успех пришел лишь в конце 18 - в начале 19 веков. Ван-Марум исследовал (1792 г), насколько точно аммиак подчиняется закону Бойля-Мариотта. Для этого он сжимал в запаянной стеклянной трубке порцию газа с помощью столбика ртути. Ван-Марум неожиданно обнаружил, что при давлении 7 атмосфер аммиак превратился в несколько капель прозрачной жидкости. Монж и Клуэ охладили сернистый ангидрид в U-образной трубке смесью льда и соли (при атмосферном давлении). В результате трубка заполнилась бесцветной жидкостью. Чтобы получить аналогичным способом жидкий аммиак, потребовалась смесь льда и хлорида кальция (дает температуру около минус 50°С). |
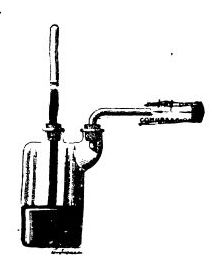
Первый опыт по сжижению газов (Ван-Марум, 1792 г) |
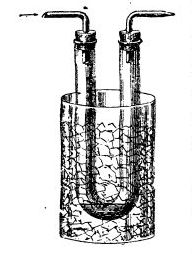
Сжижение сернистого ангидрида |
|
Следующий шаг сделал Майкл Фарадей, который был тогда всего лишь скромным лаборантом у Гемфри Дэви. Дэви поручил ему исследовать гидрат хлора - соединение включения, которое образует молекула Cl2 с водой. Чтобы проверить, как ведет себя это соединение при нагреве, Фарадей поместил несколько кристаллов гидрата хлора в закрытое колено изогнутой Г-образной трубки, после чего другое колено запаял. Далее он нагрел кристаллы, при этом свободное колено оставалось холодным. Кристаллы расплавились и дали зеленовато-желтые пары, пары сконденсировались в холодном колене с образованием маслянистой жидкости, которая оказалась жидким хлором.
|
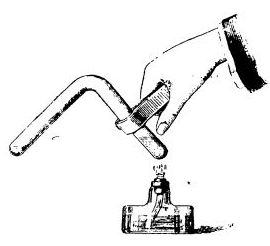
Получение жидкого хлора (опыт Фарадея) |
|
Фарадей открыл новый метод сжижения газов: не обязательно было получать газы в одном сосуде и закачивать их в другой сосуд, где будет производиться сжижение. Газы удобно переводить в жидкое состояние в том же сосуде, где они образуются. Таким способом на протяжении 1823 года Фарадею удалось перевести в жидкое состояние сероводород, сернистый газ, углекислый газ, закись азота.
Дальнейший прогресс связан с одновременным применением холода и повышенного давления. Давление создавалось насосом, а холод - твердым углекислым газом. Оказалось, что при стремительном испарении жидкого углекислого газа на воздухе часть его переходит в твердую массу, похожую на лед: за счет поглощения теплоты при испарении часть жидкости замерзает. Твердый углекислый газ получил название сухой лед. Смесь сухого льда и эфира позволяет достичь температуры минус 79°С, а если поместить ее под вакуумный колокол и откачать воздух - то и минус 110°С. Таким способом удалось перевести в жидкое состояние хлористый, бромистый и иодистый водород, мышьяковистый и фосфористый водород, этилен. Многие газы, например сероводород, хлороводород и закись азота, были не только сжижены, но и заморожены. |
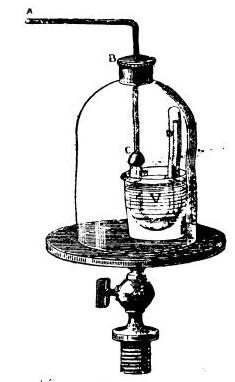
Вторая установка Фарадея для получения сжиженных газов |

Сухой лед |
|
Однако, некоторые газы - водород, кислород, азот, окись углерода и метан не переходили в жидкое состояние даже при температуре минус 110°С и давлении 50 атмосфер. С упомянутыми газами неудачи преследовали не только Фарадея, но и его коллег.
Например, в 1828 году Колладон сжал воздух до давления 400 атмосфер при температуре минус 30°С. В 1843 году Эме погружал сосуды с водородом и кислородом в море на глубину более 2 км (что позволило создать давление 220 атмосфер). В 1850 году Бертело получил фантастическое для того времени давление, с помощью простого прибора. Он помещал исследуемый газ в трубку ртутного термометра. При нагревании столбик ртути расширялся и сдавливал газ, который находился над ним. Таким способом удалось сжать кислород до давления 780 атмосфер. Однако даже когда газ охладили сухим льдом, он не сконденсировался. В 1854 году Наттерер смог сжать "упрямые" газы до давления 2800 атмосфер. В результате их объем составлял только ничтожную долю от первоначального, а плотность стала больше плотности воды, но они так и остались газами. После многочисленных неудач ученые склонились к мысли, что перевести в жидкое состояние водород, азот, кислород, окись углерода, метан, а также открытые позже фтор и гелий не представляется возможным. Их стали называть постоянными газами (чтобы подчеркнуть отличие от газов, которые можно перевести в жидкое состояние). К счастью, не все согласились с таким определением. Причем первый шаг к успеху был сделан не со стороны газов, а со стороны жидкостей. В 1822 году Каньяр де Ла-Тур открыл существование критической температуры для жидкостей. В этой точке жидкость превращается в газ, который уже не может быть переведен снова в жидкость действием столь угодно большого давления. (Если сказать более точно, различия между жидкостью и паром при нагреве в закрытом сосуде постепенно уменьшаются, а в критической точке они исчезают вовсе). Схема опыта была достаточно проста. Каньяр запечатал в пушечном стволе воду (а позже - спирт или эфир), поместив в средину ствола камень. Нагревая ствол до различных температур, он наблюдал за звуком прыгающего в стволе камня. Выше некоторой температуры камень перестал стучать. Исчезновение звука означало исчезновение жидкости: вся жидкость резко перешла в пар. Поскольку объем ствола оставался практически постоянным, не вызывало сомнений, что давление внутри должно быть очень высоким. Опыты Каньяра прошли почти незамеченными, но на них обратил внимание Фарадей. Он писал: "Очевидно, при этой температуре никакое увеличение давления, как бы велико оно ни было, не может сжижить образовавшийся газ. Следовательно, возможно, что для кислорода, азота и водорода температура -110°C выше этой нужной, а поэтому нельзя ожидать, чтобы какое бы то ни было давление, (не сопровождаемое большим понижением температуры, чем то, которого достигают) могло заставить эти элементы изменить газообразному состоянию". Фактически, Фарадей объяснил причину многочисленных неудач при попытках перевести в жидкое состояние "постоянные газы". Роль высокого давления была преувеличена, а пониженной температуры - явно недооценена. |
Ртутный термометр |
|
Предположение Фарадея экспериментально подтвердил Эндрьюс. Потерпев неудачу при попытках перевести в жидкое состояние "постоянные газы", он благоразумно взялся за более простой объект - углекислый газ, решив на его примере исследовать все обстоятельства процесса сжижения.
Ученый поместил газ в капилляр с толстыми стенками и поднял давление до тех пор, пока часть углекислого газа не превратилась в жидкость. Потом он стал нагревать капилляр. Оказалось, что при температуре 31°С мениск исчезал (мениск - граница жидкости в капилляре или тонкой трубке). Весь капилляр был заполнен однородным веществом, но стоило хоть немного понизить температуру, и начинали появляться струйки.
Эндрьюс констатировал, что при превышении температуры, при которой состояние жидкости не отличается от газообразного состояния вещества, переход газа в жидкое состояние невозможен, как бы ни было велико давление, под которым газ находится. Таким образом, при температуре выше 31°С углекислый газ приобретает свойства истинного постоянного газа. А ведь это дает основание предполагать, что и "постоянство" других газов зависит от тех же причин и что их сопротивляемость сжижению есть тоже только вопрос температуры. |

Баллон со сжиженным углекислым газом (с редуктором и манометрами) |

Поверхность Титана (спутник Сатурна). На поверхности этого небесного тела вода находится в замерзшем состоянии и имеет плотность камня, зато идут метановые дожди, есть метановые озера, а, возможно - метановые реки и моря (вспомните предсказание Лавуазье).
|

Титан |

Поверхность Титана глазами художника |