Установка для получения нитроглицерина
| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 6 2011 |
|
Нитроглицерин (ч.7) Козьма Прутков |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Нитроглицерин. Методики получения.
Для сравнения приведем методику получения нитроглицерина из другой замечательной книги:
С.А. Зонис, С.М. Мазуров Лабораторно-лекционные опыты и демонстрационные материалы по органической химии (1961)
[ ссылка ]
|
|
Получение нитроглицерина CH2OH-CHOH-CH2OH + 3HNO3 [в присутствии H2SO4] => CH2ONO2-CHONO2-CH2ONO2 + 3H2O
Реактивы, посуда и оборудование
Азотная кислота (уд. вес 1.52) - 30 млСерная кислота (конц.) - 60 мл Глицерин - 8 мл Баня - 1 Батарейный стакан (с деревянной или железной крышкой; 300 мл) - 1 Электрический мотор с мешалкой и реостатом - 1 Термометр - 1 Колба (250 мл) - 1 Капельная воронка (50 мл) - 1 Сборка прибора
В батарейный стакан вставляют термометр, мешалку и капельную воронку, как показано на рисунке.
Выполнение опыта
До лекции приготавливают нитрующую смесь, для чего в колбе смешивают азотную и серную кислоты. Нитрующую смесь переливают в батарейный стакан, помещенный в баню с охлаждающей смесью.
На лекции пускают в ход мешалку и к охлажденному до -10°С раствору приливают из капельной воронки глицерин с такой скоростью, чтобы температура ни в коем случае не поднималась выше нуля (при более высокой температуре опыт не безопасен!) Образовавшийся нитроглицерин осаждается [точнее - всплывает - прим. ред.] в виде тяжелого масла. Примечание. Нитроглицерин и нитрующую смесь с капельками нитроглицерина нельзя хранить или выливать в раковину, а необходимо их разложить концентрированным раствором щелочи. Нитроглицерин обладает не только сильными взрывчатыми свойствами, но и физиологическим действием. Взрывчатые свойства нитроглицерина
Нитроглицерин - 2 млРеактивы и посуда Капилляр - такой же, как при определении температуры плавления (длина 10-15 см), с маленьким расширением по средине - 1 Выполнение опыта
Конец капиллярной трубки погружают в нитроглицерин и засасывают с противоположного конца так, чтобы расширенная часть наполнилась нитроглицерином.
Наполненный капилляр быстро вносят горизонтально в пламя горелки; нитроглицерин взрывается. Примечание. Иногда содержимое капиллярной трубки при нагревании выбрасывается без взрыва. Опыт следует проводить в предохранительных очках. |
Установка для получения нитроглицерина |
|
Как видите, данная методика имеет несколько отличий от описанной в книге.
А. Штетбахер Пороха и взрывчатые вещества (1936). И это логично.
Методика, которую приводит Штетбахер, рассчитана для лабораторий нитроглицериновых заводов. Зонис и Мазуров описывают получение нитроглицерина как лекционную демонстрацию. Соответственно, количества веществ уменьшены, чтобы свести к минимуму возможные последствия. Авторы настоятельно не рекомендуют поднимать температуру реакционной смеси выше нуля - это еще одна мера перестраховки (согласно Штетбахеру, максимально допустимая температура 30°С). Исключены стадии промывки и нейтрализации нитроглицерина, поскольку полученный продукт не планируется хранить. Предполагается, что нитроглицерин сразу же будет использован для демонстрационного эксперимента, а его остатки (равно как и оставшаяся нитрующая смесь) будут обезврежены щелочью. Теперь обратимся к книге Солонина А.А. Лабораторное приготовление взрывчатых веществ. Пособие для практических занятий в лаборатории (1925) [ ссылка ] Глицерин, употребляющийся для приготовления нитроглицерина, должен быть, по возможности свободен от всяких примесей. < ... > Удельный вес глицерина должен быть близок к 1.26, при 15°С, т.е. содержание воды не более 2-3%. Если же он менее, вследствие большого содержания воды, то повышение удельного веса достигается нагреванием до требуемого удельного веса при температуре 130°С. После проверки удельного веса и чистоты глицерина, приготовляется смесь азотной и серной кислот. Обыкновенно берется на 3 весовых части азотной кислоты HNO3 (удельного веса 1.50) - 5 весовых частей серной (удельного веса 1.84), причем на 1 часть глицерина требуется 8 частей кислотной смеси, следовательно, при обработке 10 гр. глицерина надо 30 гр. азотной кислоты и 50 гр. серной. Серная кислота выливается тонкой струей в стакан, где находится азотная кислота, охлажденная снегом или льдом до 0°С; причем во время приливания серной кислоты производится перемешивание смеси стеклянной палочкой. Когда смесь остыла до 0°С, то начинается приливание отвешенного количества глицерина из капельной воронки в стакан, который охлаждается снегом или льдом (лучше прибавить немного соли); приливать надо глицерин по каплям и все время наблюдать за термометром, чтобы температура была не выше 5°С. Если же температура поднимается выше, то перестают капать и отходят от вытяжного шкафа, где производится приготовление нитроглицерина, и предупреждают присутствующих об опасности взрыва. Во все время капания смесь нужно перемешивать стеклянной палочкой. Когда кончилось капанье, надо до тех пор перемешивать палочкой, пока смесь не примет температуру около 0°С. Затем всю смесь из стакана выливают в сосуд с большим количеством холодной воды и продувают, для лучшей промывки, воздух через нитроглицерин, опустившийся на дно сосуда. Затем, когда нитроглицерин отстоится, повторяют эту операцию, смывши предварительно большое количество воды сифоном. Промывка производится около 10 раз (пока синяя лакмусовая бумажка не перестанет краснеть). Затем окончательно промывают нитроглицерин 1% раствором соды. Потом опять промывают чистой водой для удаления соды, красная лакмусовая бумажка не должна синеть и на разделительной воронке отделяют нитроглицерин, который затем фильтруют; для высушивания на фильтре кладут порошок, предварительно прокаленной, измельченной и остуженной поваренной соли. Затем переливают нитроглицерин в маленький стаканчик, ставят его в эксикатор, из которого затем выкачивают воздух. Нельзя пользоваться эксикатором с серной кислотой, а обязательно - эксикатором с хлористым кальцием. Все сосуды, где могут находиться капли нитроглицерина, надо мыть очищенным древесным (CH3OH, метиловым) спиртом. Выход нитроглицерина должен быть около двойного веса взятого глицерина. Как видите, эта методика в целом аналогична методикам, которые приводят Зонис, Мазуров, а также Штетбахер. В отличие от автора последней книги, Солонин также рекомендует низкую температуру нитрования - не выше 5°С. По нашему мнению такая предосторожность является необязательной: согласно книги И.В. Лебедев Справочник для инженеров и мастеров по производству взрывчатых веществ (1934) [ ссылка ] в промышленности нитрование глицерина проводят при 23-25°С (но ни в коем случае не выше 30°С). Напоследок рассмотрим "метод получения" нитроглицерина из Википедии. |
|
Получение
В лаборатории получают осторожным нитрованием глицерина смесью концентрированной азотной и серной кислот (1:1 по мольному соотношению). Кислоты и глицерин должны быть очищены от примесей. Для этого предварительно по-каплям при постоянном перемешивании смешивают кислоты, изготавливая таким образом нитрующую смесь, и добавляют к глицерину.
Описание реакции: -HSO4+-NO3<=>-2HS[O]O4+NO·2 В концентрированном состоянии серная кислота диссоциирует только на один протон на молекулу. Атом серы VI является сильным акцептором электронных пар и "отнимает" у нитратного иона атом кислорода с электронной парой. Образуется свободный радикал ·NO2. Реакция равновесна с сильным смещением равновесия влево. Затем эту смесь кислот и глицерина выдерживают 8 часов при температуре 40 °C на водяной бане(чем дольше идёт нитрование - тем выше выход нитроглицерина). Жидкость расслаивается на два слоя. Нитроглицерин тяжелее глицерина и опускается на дно - это нижний слегка желтоватый слой. Описание реакции: CH2OH-CHOH-CH2OH+3NO·2+3-2HS[O]O4+3+H => CHONO2 (CH2ONO2)2+3-HSO4+3H2O Нитроглицерин отделяют от непрореагировавшего глицерина и кислоты и промывают содовым раствором до полной нейтрализации кислот. При добавлении спирта чувствительность резко падает. В промышленности получают непрерывным нитрованием глицерина нитрующей смесью в специальных инжекторах. В связи с возможной опасностью взрыва, НГЦ не хранят, а сразу перерабатывают в бездымный порох или взрывчатые вещества. |
Нитроглицерин. Цитата из Википедии |
|
Легко видеть, что люди, которые это писали, не имеют ни малейшего понятия о химии вообще, и о получении нитроглицерина в частности. Однако главным является не это. Четко проступает злой умысел, а именно: попытка увеличить число несчастных случаев среди незадачливых "химиков". Такое предположение подтверждает и тот факт, что аналогичные "случайные ошибки" были и в прошлых вариантах статьи о перекиси ацетона. Ничего не поделаешь: Википедию пишет много людей, и не у всех из них добрые намерения [K1].
Думаю, детально анализировать эту методику не стоит (ввиду очевидности). Остановимся только на некоторых моментах. Во-первых, для приготовления нитрующей смеси кислоты смешивают не по каплям. При условии охлаждения эта операция не требует особой техники выполнения. Во-вторых, не нитрующую смесь добавляют к глицерину, а глицерин к нитрующей смеси. Делать это нужно осторожно, по каплям (или небольшими порциями), при хорошем перемешивании и охлаждении. В-третьих, температура во время нитрования глицерина не должна превышать 30°С, в противном случае возможен взрыв. В лучшем случае произойдет бурное разложение нитроглицерина с выделением большого количества оксидов азота. Если температура реакционной смеси поднимется выше 30°С, необходимо срочно вылить реакционную смесь в большое количество воды (в нашем эксперименте для этой цели было заранее приготовлено ведро с водой - см. ч.5). Несмотря на это, в Википедии сказано, что температура смеси должна быть 40°С. Выводы делайте сами. В-четвертых, слишком большое время нитрования (8 часов - как в приведенной методике) не только резко увеличивает вероятность взрыва, но и резко снижает выход - за счет деструкции нитроглицерина. Желающим узнать, к чему могут привести подобные несоответствия, рекомендуем посмотреть фотографии ниже. Любое нарушение техники безопасности при работе с нитроглицерином может иметь непоправимые последствия. |
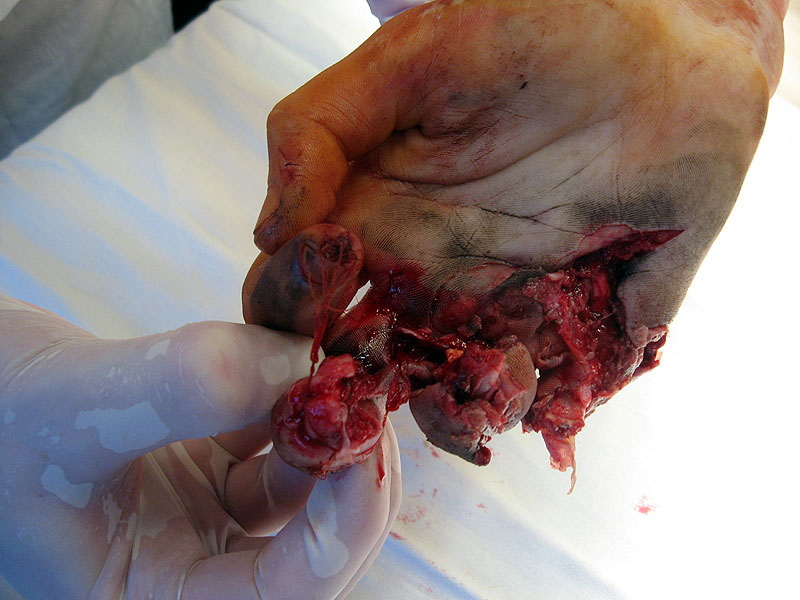
Тяжелая травма кисти |
|
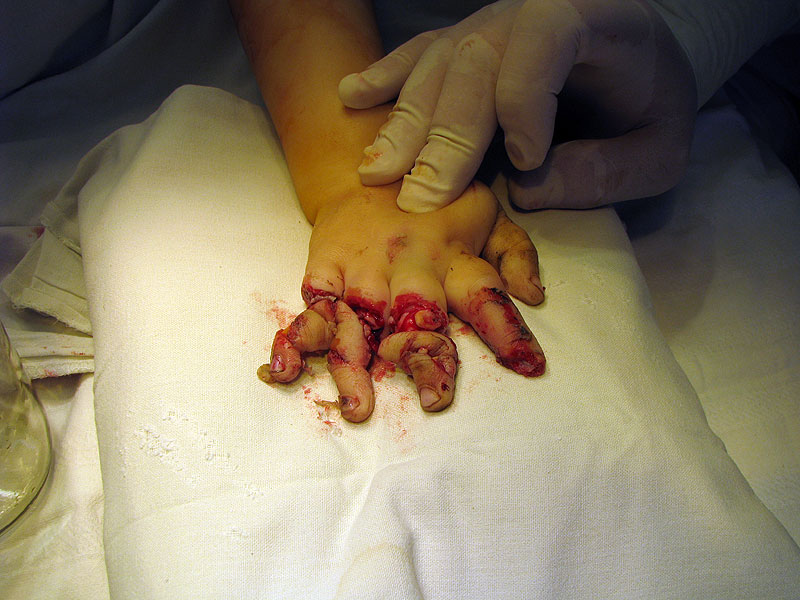
Тяжелая травма кисти |
|
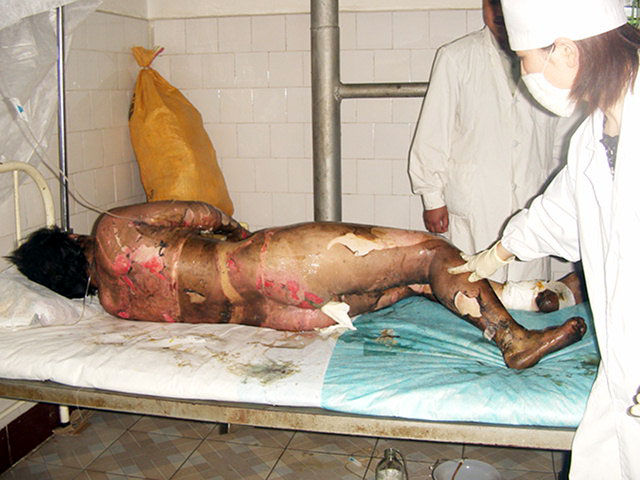
Ожоги |
|
Комментарии
К1
Подобные некорректные правки часто преднамеренно вносятся сотрудниками правоохранительных органов. Направлены они в первую очередь на выявление юных химиков, т.к. дипломированный химик обратиться к соответствующей литературе, а просто взрослый "любитель", по крайней мере, попытается спросить у профессионалов. А вот школьники чаще всего используют информацию из интернета. В случае несчастного случая без травматизма - на начинающего химика донесут соседи. А там можно привлечь родителей с угрозой внесения семьи в категорию неблагополучной, учителей - за то, что проглядели и так далее. В общем, работать есть с чем. Если не обошлось без травмы, то см. выше + повод закрутить гайки - блокировка химических сайтов, привлечение их админов и модераторов к уголовной ответственности. А если при этом появится доступ к базе данных ресурса, то и участников. Работы еще больше. Так, что как это ни цинично звучит, но оторванные пальцы у школьника из-за неграмотной статьи приносят сплошную выгоду правоохранителям.
|