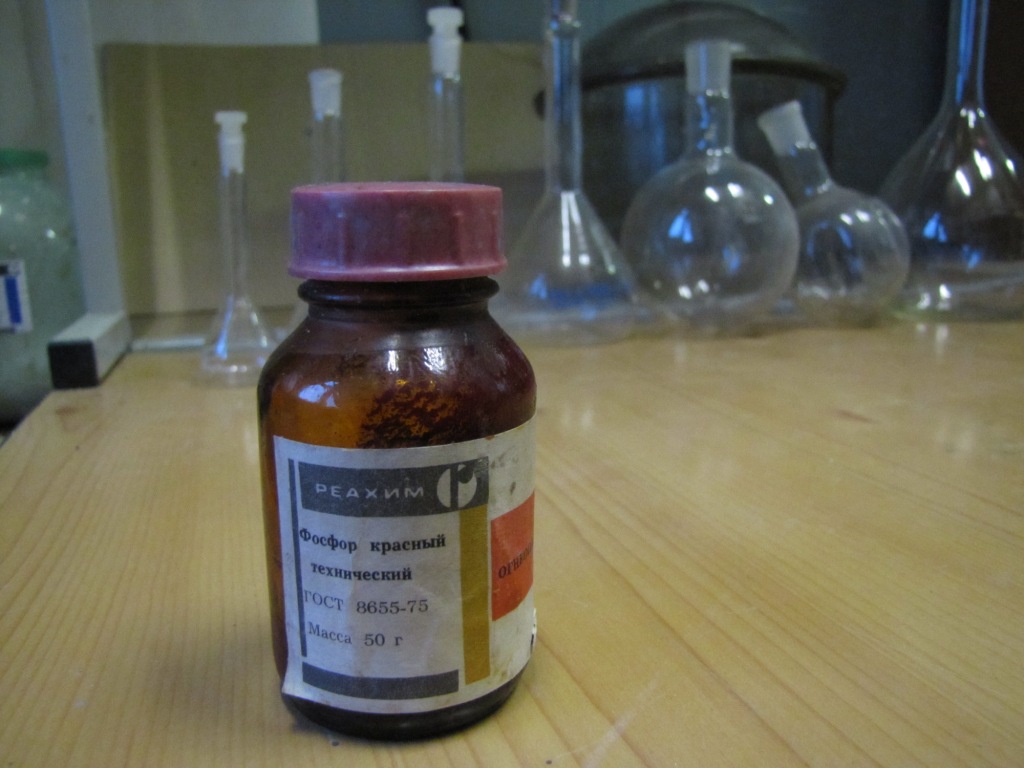
Красный фосфор









| Оглавление | Видео опыты по химии | На главную страницу |
|
Химия и Химики № 4 2012 Предварительный вариант |
Опыты с фосфором ч.1 В.Н. Витер |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Возгонка красного фосфора (получение белого фосфора)
Красный фосфор при нагревании сублимируется без плавления. При последующей конденсации пара образуется не красный, а белый фосфор. Данный способ не совсем удобен, но он позволяет получить небольшие количества белого фосфора для экспериментов. Если использовать загрязненный (технический) красный фосфор, при возгонке образуется продукт желтого цвета, который так и называют "желтый фосфор". По сути, желтый фосфор представляет собой технический белый фосфор.
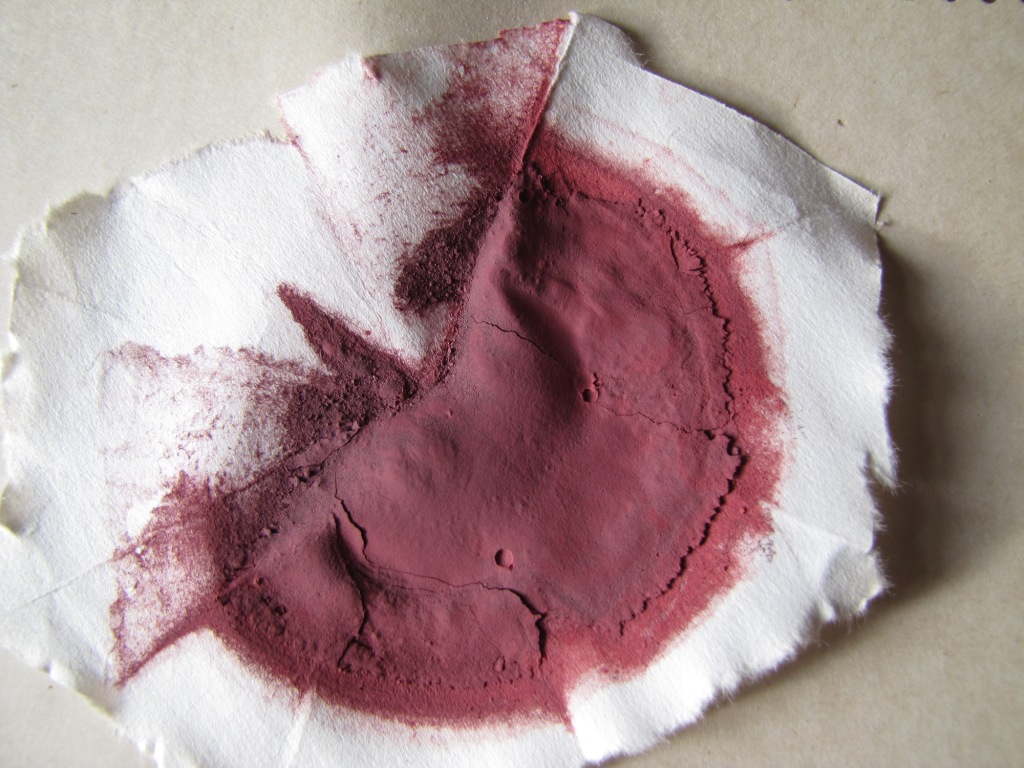
Красный фосфор при хранении на воздухе устойчив, однако технический красный фосфор содержит примесь белого фосфора, который под действием воздуха окисляется. В результате фосфор "плывет" - покрывается жидкой пленкой фосфорных кислот. Чтобы удалить фосфорные кислоты, красный фосфор промывают водой и сушат. Мы взяли несколько грамм технического красного фосфора, который благодаря фосфорным кислотам представлял собой кашеобразную массу. Фосфор взмутили в дистиллированной воде, суспензию отфильтровали, осадок фосфора промыли несколько раз водой на фильтре, после чего высушили. Для возгонки мы взяли 1 г сухого красного фосфора. Фосфор поместили в маленькую пробирку, которую вставили в горлышко колбы. Соединение уплотнили минеральной ватой (подойдет и хлопковая вата, но не забывайте, что она горит). Колбу закрепили в штативе и начали нагревать фосфор. Вскоре в пробирке появились белые пары, которые сначала осели на стенках. Чтобы этого не происходило, стенки периодически прогревали горелкой. Когда пары фосфора попали в колбу, они вспыхнули, однако горение скоро прекратилось (поскольку был израсходован кислород). На стенках колбы стал оседать сначала белый, потом - желтый налет. Тепла от горелки Теклю оказалось недостаточно: в пробирке оставалось еще немало твердого вещества, поэтому мы воспользовались горелкой, которая дает более горячее пламя, а кроме того - слегка постукивали по стенкам пробирки. В результате колба покрылась желтым налетом, на дне собралась капля желтой жидкости - это и есть технический белый фосфор. В пробирке осталось немало черного порошка: исходный красный фосфор содержал много примесей. Опыт представляет значительную опасность: белый фосфор легко загорается от контакта с воздухом, образуя густой белый дым. Пламя фосфора очень горячее. Красный фосфор загорается труднее, но горит не хуже белого [1]. Ожоги от фосфора очень болезненные, глубокие и долго незаживающие. Фосфор используется как боевое зажигательное и дымообразующее вещество. Если пробирка треснет или упадет, это может стать причиной пожара. Не забывайте также, что белый фосфор очень ядовит (смертельная доза - 0.1 г). Про опасность фосфора мы наглядно узнаем из следующих частей статьи. __________________________________________ 1 При горении красный фосфор частично переходит в белый за счет тепла реакции. Если горящий красный фосфор потушить, то впоследствии он может самовоспламениться на воздухе. Такой фосфор ни в коем случае не следует хранить: его нужно либо немедленно уничтожить, либо очистить от примеси белого (например, тщательной промывкой раствором азотной кислоты и водой) - прим. чит. |

Красный фосфор |

|

|

|

|

|

|

|

|

|

|

|
|
|

Возгонка красного фосфора |

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|

Желтый фосфор |