Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Получение фосфина
При нагревании белого фосфора с крепким раствором щелочи фосфор диспропорционирует, в результате образуется фосфат и фосфин PH3. Одновременно с фосфином образуется небольшое количество дифосфина P2H4 (фосфористый аналог гидразина), который легко вспыхивает на воздухе. Одновременно образуется водород. Если газоотводную трубку направить под воду, пузырьки фосфина всплывая вспыхивают; при этом образуются кольца белого дыма.
Приведем описание опыта из практикума Рипан Р. Четяну И. Руководство к практическим работам по неорганической химии ссылка.
Получение фосфористого водорода нагреванием белого фосфора с 30-50%-ным раствором едкого кали. Уравнение реакции:
4P + 3KOH + 3H2O = PH3 + 3KH2PO2
При этом способе получения кроме газообразного фосфористого водорода образуется также жидкий фосфористый водород, газообразный водород и кислый гипофосфит калия [1] по уравнениям:
6P + 4KOH + 4H2O = P2H4 + 4KH2PO2
2P + 2KOH + 2H2O = H2 + 2KH2PO2
2P + 2KOH + 2H2O = H2 + 2KH2PO2
Жидкий фосфористый водород, взаимодействуя с гидроксидом калия в водной среде, образует газообразный фосфористый водород, водород и кислый гипофосфит калия по уравнениям:
2P2H4 + KOH + H2O = 3PH3 + KH2PO2
P2H4 + 2KOH +2H2O = 3H2 + 2KH2PO2
P2H4 + 2KOH +2H2O = 3H2 + 2KH2PO2
Кислый гипофосфит калия в щелочной среде превращается в ортофосфат калия с выделением водорода:
KH2PO2 + 2KOH = 2H2 + K3PO4
Согласно приведенным уравнениям реакций, при нагревании белого фосфора с гидроксидом калия образуется газообразный фосфористый водород, водород и ортофосфат калия.
Полученный этим способом фосфин самопроизвольно воспламеняется. Это происходит потому, что он содержит некоторое количество паров самовоспламеняющегося жидкого фосфористого водорода (дифосфин) и водород.
Вместо гидроксида калия можно воспользоваться гидратами окиси натрия, кальция или бария. Реакции с ними протекают аналогично.
Прибором служит круглодонная колба емкостью 100-250 мл, плотно закрытая резиновой пробкой, через которую должна быть плотно пропущена трубка, направляющая газообразные продукты в кристаллизатор с водой.
Колбу на 3/4 ее объема заполняют 30-50%-ным раствором едкого кали, в который бросают 2-3 кусочка белого фосфора, величиной с горошину. Колбу укрепляют в зажиме штатива и с помощью газоотводной трубки соединяют с кристаллизатором, наполненным водой (см. рисунок).
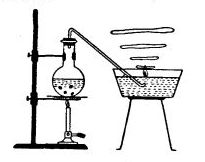
При нагревании колбы гидроксид калия реагирует с белым фосфором согласно приведенным выше уравнениям.
Жидкий фосфористый водород (дифосфин), достигнув поверхности жидкости в колбе, сразу же воспламеняется и сгорает в виде искр; это происходит до тех пор, пока не будет израсходован оставшийся в колбе кислород.
При сильном нагревании колбы жидкий фосфористый водород перегоняется и над водой воспламеняется газообразный фосфористый водород и водород. Фосфористый водород сгорает желтым пламенем, образуя фосфорный ангидрид в виде белых колец дыма.
По окончании опыта уменьшают пламя под колбой, вынимают пробку с отводной трубкой, прекращают нагревание и оставляют прибор под тягой до его полного охлаждения.
Неизрасходованный фосфор тщательно промывают водой и сохраняют для последующих опытов.
Мы решили получить фосфин. В пробирку насыпали едкого натра и налили до половины воды. Часть щелочи осталась в осадке. Пробирку закрепили наклонно в штативе, положили в нее кусочек желтого фосфора размером с горошину и закрыли пробкой с газоотводной трубкой, конец которой опустили в кристаллизатор с водой. Начали нагрев.
В кристаллизаторе стали пробулькивать пузырьки газа. Со временем начались желтые вспышки, сопровождаемые хлопками: пузырьки лопались и загорались на воздухе. После вспышек часто образовывались красивые белые дымовые кольца, которые поднимались вверх.
По нашим наблюдениям опыт лучше всего получался тогда, когда жидкость в пробирке активно кипела и происходил проброс части жидкости в воду кристаллизатора. В некоторых случаях оказывалось, что вспышки происходили реже и слабее, если конец газоотводной трубки слишком глубоко опустить в воду.
В целом "фейерверк с дымовыми кольцами" продолжался до нескольких минут. Можно с уверенностью сказать, что это один из самых красивых опытов.
________________________________________
1 Такое название не совсем верно, поскольку фосфорноватистая кислота H3PO2 одноосновная: два атома водорода из трех связаны с атомом фосфора (- прим. чит.).





















































