Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Техника безопасности при работе с фосфором. В чем опасность фосфора? Оказание первой помощи при отравлениях фосфором
Белый фосфор - весьма опасное вещество. Во-первых, он ядовит, во-вторых - очень огнеопасен. Красный фосфор неядовит и загорается труднее, чем белый. Однако технический красный фосфор практически всегда содержит примесь белого, что обуславливает его токсичность. Кроме того, пламя красного фосфора довольно горячее, а при его горении образуется едкий дым фосфорного ангидрида.
Белый фосфор является боевым зажигательным веществом, а красный - боевым дымообразующим веществом.
Таким образом, работа с фосфором требует не только надлежащих мер предосторожности, но и знания приемов оказания первой помощи, а также хотя бы поверхностного знания того, как фосфор действует на организм человека.
Для начала приведем отрывок из практикума Рипан Р. Четяну И. Руководство к практическим работам по неорганической химии ссылка.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛОГО ФОСФОРА
Фосфор известен в нескольких аллотропических модификациях: белый, красный, фиолетовый и черный. В лабораторной практике приходится встречаться с белой и красной модификациями.
Белый фосфор - твердое вещество. В обычных условиях он желтоватый, мягкий и по внешнему виду похож на воск. Он легко окисляется и воспламеняется. Белый фосфор ядовит - на коже оставляет болезненные ожоги. В продажу белый фосфор поступает в виде палочек разной длины диаметром 0.5-2 см. Белый фосфор легко окисляется, и поэтому его хранят под водой в тщательно закупоренных сосудах из темного стекла в мало освещенных и не очень холодных помещениях (во избежание растрескивания банок из-за замерзания воды). Количество кислорода, содержащееся в воде и окисляющее фосфор, очень невелико; оно составляет 7-14 мг на литр воды.
Под воздействием света белый фосфор переходит в красный.
При медленном окислении наблюдается свечение белого фосфора, а при энергичном окислении происходит его воспламенение.
Белый фосфор берут пинцетом или металлическими щипцами; ни в коем случае нельзя дотрагиваться до него руками.
При ожоге белым фосфором промывают обожженное место раствором AgNO3 (1 : 1) или KMnO4 (1 : 10) и накладывают мокрую повязку, пропитанную теми же растворами или 5%-ным раствором сульфата меди, затем рану промывают водой и после разглаживания эпидермиса накладывают вазелиновую повязку с метиловым фиолетовым. При тяжелых ожогах обращаются к врачу.
Растворы нитрата серебра, перманганата калия и сульфата меди окисляют белый фосфор и тем прекращают его поражающее действие.
При отравлении белым фосфором принимают внутрь по чайной ложке 2%-ного раствора сульфата меди до появления рвоты. Затем при помощи пробы Митчерлиха на основе свечения устанавливают присутствие фосфора. Для этого к рвоте отравленного добавляют воды, подкисленной серной кислотой, и перегоняют в темноте; при содержании фосфора наблюдают свечение паров. В качестве прибора пользуются колбой Вюрца, к боковой трубке которой присоединяют холодильник Либиха, откуда перегоняемые продукты поступают в приемник. Если пары фосфора направлять в раствор нитрата серебра, то выпадает черный осадок металлического серебра.
Уже 0.1 г белого фосфора является смертельной дозой для взрослого человека.
Режут белый фосфор ножом или ножницами в фарфоровой ступке под водой. При пользовании водой комнатной температуры фосфор крошится. Поэтому лучше пользоваться теплой водой, но не выше 25-30°С. После разрезания фосфора в теплой воде его переносят в холодную воду или охлаждают струей холодной воды.
Белый фосфор - очень огнеопасное вещество. Он воспламеняется при температуре 36-60°С в зависимости от концентрации кислорода в воздухе. Поэтому при проведении опытов во избежание несчастного случая необходимо учитывать каждую его крупинку.
Высушивание белого фосфора производят быстрым прикладыванием к нему тонкой асбестовой или фильтровальной бумаги, избегая трения или надавливания.
При воспламенении фосфора его гасят песком, мокрым полотенцем или водой. Если горящий фосфор находится на листе бумаги (или асбеста), этот лист запрещается трогать, так как расплавленный горящий фосфор можно легко разлить.
Белый фосфор плавится при 44°С, кипит при 281°С. Плавят белый фосфор под водой, так как в соприкосновении с воздухом расплавленный фосфор воспламеняется. Сплавлением и последующим охлаждением белый фосфор можно легко извлечь из отходов. Для этого отходы белого фосфора от различных опытов, собранные в фарфоровом тигле с водой, нагревают на водяной бане. Если на поверхности расплавленного фосфора заметно образование корки, добавляют немного HNO3 или хромовой смеси. Корка окисляется, мелкие крупинки сливаются в общую массу и после охлаждения струей холодной воды получают один кусок белого фосфора.
Остатки фосфора ни в коем случае нельзя бросать в раковину, так как, скопляясь в изгибах колена сточных труб, он может причинить ожоги ремонтным рабочим.
Более обстоятельное (и по нашему мнению - более интересное) описание работы с фосфором дано в практикуме В.Н. Верховский Техника и методика химического эксперимента в школе. Том 2. Описание опытов ссылка.
Хранение фосфора и обращение с ним
Обращение с красным фосфором (phosphorus amorphus) никаких особенных предосторожностей не требует, хранить же его лучше в банке с залитой парафином пробкой. Красный фосфор в плохо закрытом сосуде обыкновенно постепенно отсыревает и при продолжительном хранении делается совсем мокрым и непригодным для нижеописанных опытов. Это происходит, по всей вероятности, вследствие примеси белого фосфора, который постепенно переходит в фосфорную кислоту, притягивающую влагу из воздуха.
Если имеется запас такого отсыревшего фосфора, то его следует хорошо промыть на фильтре водой и затем, отжав между листами фильтровальной бумаги, высушить при комнатной температуре. Для сушения его лучше рассыпать тонким слоем на листе фильтровальной бумаги. Сушить, конечно, нужно в таком месте, где фосфор не мог бы загореться от случайно брошенной спички и т.п. Можно воспользоваться и эксикатором.
Белый фосфор (phosphorus albus), как вещество крайне огнеопасное (воспламеняется при 36-60°С) и ядовитое (см. ниже), требует целого ряда предосторожностей при хранении и обращении с ним.
Имеющийся в лаборатории белый фосфор должен храниться вместе с другими особо ядовитыми веществами в особом, всегда запертом на ключ шкафу, согласно инструкции, и под ответственностью лица, на это уполномоченного. Всякий расход фосфора должен строго регистрироваться.
Брать белый фосфор можно только щипцами или пинцетом, но никоим образом не руками. Хранить белый фосфор можно только под водой, причем куски фосфора не должны выставляться из воды. Сосуд с фосфором должен быть хорошо закрыт. Лучше всего банку с имеющимся запасом белого фосфора закрыть корковой пробкой, которую хорошо залить парафином. Затем удобно иметь еще банку с притертой стеклянной пробкой, в которой держать небольшое количество фосфора для текущих опытов, и, кроме того, особую банку для мелких обрезков и остатков фосфора.
Так как белый фосфор на свету постепенно краснеет, то банки с фосфором должны стоять в темноте. Проще всего поместить каждую банку в соответствующих размеров картонку или, лучше, жестянку (из-под какао и т.п.). Жестянка будет, кроме того, предохранять банку от случайных толчков и ударов.
Банки с белым фосфором после работы следует немедленно убирать на место. Ни в коем случае не следует ставить банки с фосфором в ящик за окном, в холодный чулан и, вообще, в неотапливаемое помещение, где вода, в которой хранится фосфор, могла бы замерзнуть. При замерзании воды банка может лопнуть, а затем, когда вода растает и вытечет из банки, фосфор загорится и может произойти пожар [1].
Все остатки и обрезки белого фосфора, даже самые маленькие кусочки, следует тщательно собирать в банку с водой и никогда не бросать в раковину. Брошенный в раковину кусочек может случайно остаться в застое и затем, при чистке застоя, причинить ожоги тому, кто это будет делать.
Если бы случилось уронить кусочек белого фосфора на пол, то кусочек необходимо разыскать и поднять, так как неразысканный фосфор может послужить причиной пожара (такие случаи описаны в литературе).
Остатки белого фосфора, когда их накопится достаточное количество, можно сплавить в один кусок. Для этого лучше всего поместить кусочки фосфора в фарфоровый тигель с достаточным количеством воды и нагреть на водяной бане (или в стакане с горячей водой) до плавления, а затем охладить в чашке с холодной водой. Вместо тигля можно взять и другой какой-либо сосуд, но несколько расширяющийся кверху. Из цилиндрического сосуда, например, из пробирки, белый фосфор будет труднее вынуть.
Если остатки белого фосфора хранились в недостаточно плотно закрытом сосуде и покрылись с поверхности коркой, то эта корка отчасти всплывает на поверхность расплавленного фосфора в виде пленки. Такую пленку можно удалить, прилив к воде, покрывающей расплавленный фосфор, немного азотной кислоты или хромовой смеси. Пленка окисляется, и по охлаждении получается кусок фосфора с гладкой поверхностью. Муть, остающуюся в расплавленном фосфоре и не всплывающую на поверхность, этим способом удалить не удается. Таким же способом можно очищать и запасы белого фосфора, если он сильно изменился от действия воздуха или света.
Расплавленный под водою белый фосфор ни в коем случае не следует переливать из одного сосуда в другой, так как при этом он вспыхивает, и брызги горящего фосфора могут причинить опасные ожоги.
При плавлении белого фосфора под водой случается, что маленький кусочек фосфора всплывает на поверхность воды вместе с пузырьком воздуха и начинает гореть. Это горение продолжается обыкновенно очень недолго (так как всплыть может только очень маленький кусочек) и ничего опасного не представляет.
Резать белый фосфор можно только под водой. Сосуд, в котором режется фосфор, должен быть толстостенный - фарфоровая ступка, тарелка, простоквашница и т.п., так как тонкостенный сосуд, как фарфоровая чашка, кристаллизатор, легко можно при резании раздавить. Нож должен иметь закругленное на конце лезвие, которым следует надавливать на кусок фосфора сверху, как показано на рисунке (не пилить), слегка покачивая вперед и назад.
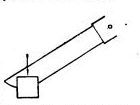
Разрезание белого фосфора
Вместо того чтобы резать белый фосфор, можно заранее заготовить кусочки с горошину величиной. Для этого нужна соответствующих размеров ложечка. Ею зачерпывается расплавленный под водой фосфор и переносится в холодную воду, чтобы затвердел.
Высушивание белого фосфора производится обыкновенно при помощи фильтровальной бумаги. Кусочек фосфора, вынутый из холодной воды, кладется на сложенную в несколько слоев фильтровальную бумагу и затем сверху к нему прижимается пальцем (не тереть! ) другой кусок бумаги, также сложенный в несколько слоев. Затем фосфор переворачивается пинцетом, переносится на сухое место, и к нему снова прижимается бумага, и так до тех пор, пока кусок не будет высушен со всех сторон. Удобнее всего, если кусочки фосфора кубической формы: его приходится поворачивать только три раза. Кроме того, важно, чтобы поверхность срезов была гладкая.
Высушивание необходимо вести возможно быстро, особенно если в помещении тепло.
При указанных предосторожностях белый фосфор обыкновенно не загорается, но на всякий случай для тушения загоревшегося фосфора необходимо, чтобы рядом находилась чашка с песком, которым можно было бы засыпать фосфор, если бы он случайно загорелся
Можно также тушить фосфор и водой или мокрым полотенцем. Если фосфор загорится на бумаге, то не следует поднимать или передвигать бумагу, так как расплавленный фосфор очень подвижен и легко может стечь по бумаге на руку (подобный случай я наблюдал на практике).
При сушении белого фосфора его ни в коем случае не следует тереть бумагой или катать по бумаге, так как при этом он очень легко может загореться.
Начинающим при сушении белого фосфора лучше всего класть бумагу не прямо на стол, а на кусок асбестового картона, жестяную пластинку и т.п. Тогда, если даже фосфор и загорелся бы, к этому можно отнестись совершенно спокойно. Вдыхание незначительного количества дыма фосфорного ангидрида P2O5 не опасно, пожара же при указанной предосторожности произойти не может.
Для того чтобы не иметь преувеличенного представления о способности белого фосфора воспламеняться и обращаться с ним спокойно, полезно попробовать вызвать воспламенение небольшого кусочка белого фосфора трением о бумагу, держа фосфор в щипцах и производя опыт под тягой, в таких условиях, чтобы он был вполне безопасен.
Вместо фильтровальной бумаги при высушивании белого фосфора очень удобно пользоваться асбестовой бумагой (тонкий картон). Она очень хорошо впитывает влагу, и, если бы фосфор при высушивании загорелся, это не представит никакой опасности.
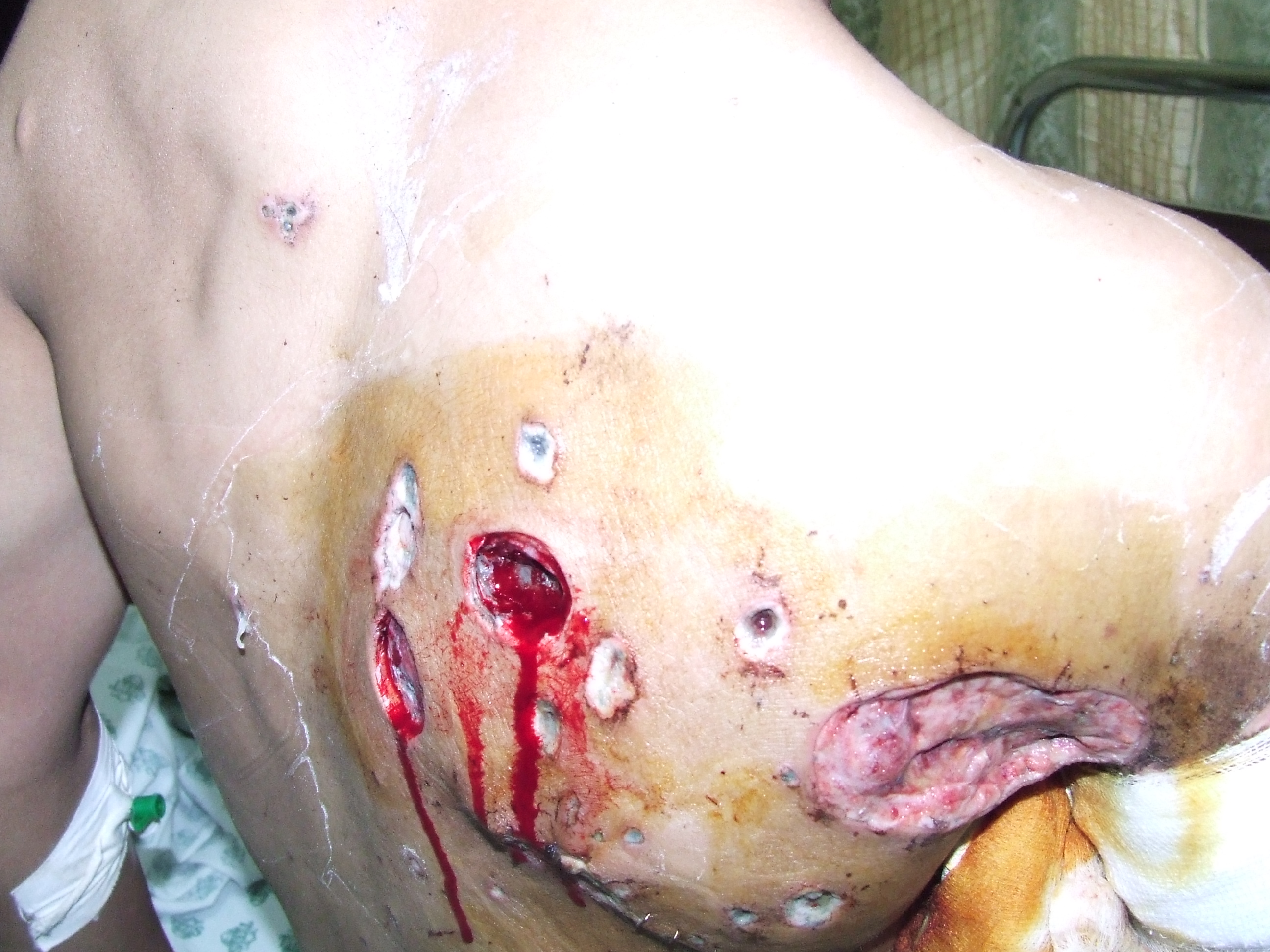
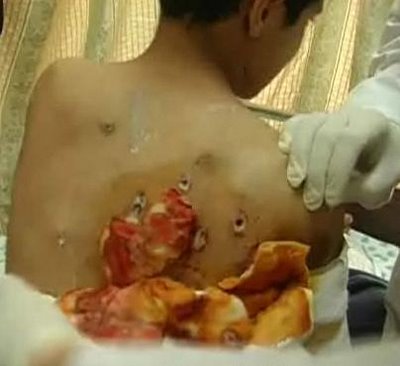
Ожоги от горящего фосфора очень болезненны, дают медленно заживающие раны b, если не принять своевременно мер, опасны, так как могут повлечь воспаление лимфатических сосудов и общее отравление. При ожогах фосфором прежде всего необходимо окислить оставшийся в ране фосфор, для чего служит раствор 1:10 ляписа AgNO3, (argentum nitricum), которым следует смочить обожженное место. Можно даже приложить на. некоторое время смоченную раствором ляписа тряпочку или вату. Раствор ляписа при работах с фосфором должен всегда находиться поблизости. После смачивания ляписом рана обмывается водой и перевязывается обычным способом при помощи стерильной марли и бинта. При серьезных ожогах, после смачивания обожженного места ляписом и перевязки, следует, конечно, обратиться к врачу. Вместо ляписа можно воспользоваться и другими окислителями: обмыть обожженное место слабым раствором белильной извести (calcarнa chlorata) [современное название - хлорная известь (прим. ред.)] или марганцовокалиевой соли KMnO4 (перманганат калия, kalium hyperman-ganicum) 1 : 10 [2].
При всех опытах с фосфором его лучше не выставлять заранее на лекционном столе, а приносить с собой к началу урока.
_________________________________________________________________
1 Такой случай произошел в одном французском лицее. См. Journal de physique, chimie et histoire naturelle elementaires. Janvier, 1912.
2 Мне известен случай (в 1904 г.) очень сильного ожога фосфором (горящий фосфор потёк по руке и покрыл поверхность не менее 10 см2), который, однако, окончился сравнительно благополучно благодаря тому, что к обожженному месту сейчас же был приложен компресс из ляписа. На общем состоянии здоровья ожог не отразился, но при лечении была, видимо, сделана какая-то ошибка. Рука бинтовалась с согнутыми пальцами и образовавшаяся под струпом новая кожа не позволяла пострадавшему совсем разогнуть пальцы.
В другом случае (в 1924 г.) очень серьезный ожог обеих рук окончился вполне благополучно без каких-либо последствий. После ожога сейчас же было применено смачивание раствором перманганата. Дальнейшее лечение в больнице производилось по новейшему способу - краской метилвиолет [метиловый фиолетовый ]. Обожженные места смазывались вазелином с метилвиолетом.
При бинтовании очень важно, чтобы обожженные участки кожи были растянуты. Если, например, обожженную ладонь руки при бинтовании не расправлять, а бинтовать в согнутом состоянии, то новая кожа на обожженном месте вырастает короче, чем нормальная, и руку потом нельзя бывает разогнуть (как было в первом из описанных случаев).
Приведем также отрывок из книги Голиков С.Н. Неотложная помощь при острых отравлениях (1978) ссылка. Несмотря на то, что книга больше рассчитана на специалистов-токсикологов, она может быть полезна и химикам, работающим с фосфором в лабораториях (или - чего греха таить - у себя дома).
Фосфор (Phosphorus, Р) существует в форме красного, гранулированного, не всасывающегося и не ядовитого вещества и в виде белого или желтого фосфора, представляющих большую опасность. Значительная часть белого фосфора перерабатывается в красный и используется в производстве спичек. Кроме того, белый и желтый фосфор применяют в качестве ядов для грызунов и насекомых [K1], в пиротехнике, для производства удобрений и др.
При действии кислот на металлы, содержащие фосфор, выделяется фосфин.
Белый и желтый фосфор ядовиты. Примерная смертельная доза желтого фосфора для человека 50 мг. ПДК в воздухе производственных помещений 0.00003 мг/л.
Фосфор - ферментный яд, тормозящий внутриклеточные окислительные процессы. Вызывает поражение печени. Длительное поступление фосфора в организм приводит к серьезным поражениям костной ткани (особенно челюстей).
Фосфор проникает в организм в виде паров через легкие, в виде пыли и при случайном приеме внутрь, а также через кожу в области ожога фосфором.
Клиническая картина отравления. Через 1-2 ч после приема внутрь желтого фосфора появляются тошнота, боли в области желудка, рвота и понос. Рвотные массы и выдыхаемый воздух могут иметь чесночный запах.
Смерть на фоне коматозного состояния может наступить в первые 2 сут. Иногда после первоначальной острой реакции происходит ослабление симптомов отравления, а затем через 1-2 дня появляются тошнота, рвота, диарея, увеличение и болезненность печени, желтуха, прострация, понижение артериального давления, олигурия, множественные петсхиальные кровоизлияния, дыхание Чейна-Стокса, судороги, кома.
В случае ингаляционного отравления фосфином понижается артериальное давление, появляются рвота, расстройство дыхания, отек легких, судороги, кома. Смерть наступает в пределах 4 дней, реже в отдаленные сроки.
В случаях тяжелого отравления фосфором может быть острая атрофия печени и диффузное токсическое поражение почек. Если желтый фосфор попадает на кожу, то он быстро воспламеняется и вызывает ожог II-III степени. При этом может произойти всасывание фосфора через ожоговую поверхность, что влечет за собой общее отравление.
При хронической интоксикации фосфором наблюдаются следующие симптомы: слабость, потеря аппетита, похудание, анемия, некроз нижней челюсти.
Неотложная помощь и лечение. При попадании фосфора в желудок его промывают повторно 0.2-0.3% раствором сульфата меди (медный купорос) или перманганатом калия (1:1000). После промывания пострадавшему дают 120 мл растительного масла и 30 г сульфата натрия, разведенного в 250 мл воды. Прием слабительного повторяют через 2 ч. В случае попадания фосфора на кожу или в глаза его смывают водой из-под крана (не менее 15 мин).
Лечение, направленное на борьбу с шоком и отеком легких, проводят по общим правилам. Для восполнения потерь кальция в сыворотке крови применяют хлорид кальция или глюконат кальция (10 мл 10% раствора внутривенно). В остальном лечение симптоматическое.
Мы отлично понимаем, что описание последствий поражения белым фосфором не всем читателям показались убедительными. Некоторые попросту не стали его читать.
Ну что же: читателям, которые поленились и проигнорировали описание, предлагаем посмотреть "картинки". Заранее предупреждаем: фотографии не для слабонервных.